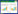文章信息
- 王晓凤, 赵敏
- WANG Xiaofeng, ZHAO Min
- 基于网络药理学研究黄连治疗百草枯中毒致急性肝损伤的分子机制
- Molecular mechanism of Huanglian for the treatment of paraquat-induced acute liver injury based on network pharmacology
- 中国医科大学学报, 2023, 52(8): 724-730
- Journal of China Medical University, 2023, 52(8): 724-730
-
文章历史
- 收稿日期:2023-04-21
- 网络出版时间:2023-07-28 11:13:16
百草枯中毒是急诊常见的急危重症,其特点为病情变化快,伴随多器官功能损害,如肝功能[1]、肾功能、肺功能等。目前尚无特效解毒药物,因此死亡率较高,是临床治疗难点之一[2]。放大的级联炎症反应可加重毒物导致的器官损伤,所以炎症反应在百草枯中毒导致的急性肝损伤的分子机制中发挥重要作用[3]。
黄连是中医经典用药,传承已久。已有研究[4]表明,黄连提取物黄连素具有抗炎、抗氧化等生物作用。以黄连为主要成分的配伍药物黄连吴茱萸,可以减轻肝脏炎症损伤,减少炎症小体的产生[5]。因此推测,黄连可能通过某些分子机制,对百草枯导致的肝损伤起到一定的治疗作用。本研究采用网络药理学方法,预测和分析黄连在治疗百草枯中毒导致的急性肝损伤时的有效成分及潜在作用靶点,并进行动物实验验证,为后续研究提供了一定的实验依据,同时也为中草药治疗百草枯中毒导致的急性肝损伤提供了新的思路和方法。
1 材料与方法 1.1 试剂与仪器百草枯标准品,购自美国Sigma-Aldrich公司;黄连,购自安徽饮片有限公司,经辽宁中医药大学附属第二医院药剂科鉴定为正品;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒,购自碧云天生物科技有限公司;谷丙转氨酶(alanine aminotransferase,ALT)和谷草转氨酶(aspartate aminotransferase,AST)活性比色法试剂盒,购自中国南京建成公司;丝氨酸/苏氨酸激酶1(serine/threonine kinase 1,AKT1)、磷酸化AKT1(phospho-AKT1,p-AKT1)抗体,购自美国CST公司;β-actin抗体,购自中国Proteintech公司。
1.2 动物C57小鼠,购自北京华阜康生物有限公司,饲养在中国医科大学附属盛京医院本溪实验基地动物部,昼夜节律为12 h~12 h。所有小鼠在20~25 ℃、40%~70%湿度下自由活动、摄食水。适应性喂养1周后,进行下一步实验。本研究通过中国医科大学附属盛京医院伦理委员会审查(2022PS631K)。
1.3 网络药理学分析 1.3.1 数据收集在中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP,https://tcmspw.com/tcmsp.php)中,以“黄连”为中药材名称在“Herbname”中搜索,通过口服生物利用度(oral bioavailability,OB)、类药性(drug likeness,DL)对成分进行整理,最后获得黄连的活性成分。在瑞士靶点预测数据库(Swiss Target Prediction,STP,http://www.swisstargetprediction.ch/)中进行靶点预测,得到黄连成分对应的靶点基因名称。以“acute liver injury”和“paraquat”为关键词,在人类基因数据库GeneCards(https://www.genecards.org)中检索,收集急性肝损伤和百草枯中毒相关的靶点基因并整理。
1.3.2 交集靶点基因的获取首先获取急性肝损伤和百草枯中毒相关靶点基因的交集,然后获取黄连药物成分靶点基因与上述靶点基因的交集,探究黄连在治疗百草枯中毒导致的急性肝损伤的潜在作用靶点基因。
1.3.3 药物-成分-疾病靶点网络图的构建把黄连、药物成分、靶点基因导入Cytoscape 3.7软件,构建药物-成分-疾病靶点网络图。
1.3.4 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)将获得的靶点基因导入STRING(https://string-db.org)中,以“homosapiens”为检索物种,同时置信度≥0.4,进行数据筛选,获得PPI网络图,将STRING数据库检索的数据导出,整理并筛选出重要蛋白。
1.3.5 交集靶点基因的富集分析将上述获得的交集靶点基因在注释、可视化和集成发现数据库(the Database for Annotation,Visualization and Integrated Discovery,DAVID,https://david.ncifcrf.gov/)中进行检索,并进行富集分析,主要进行基因本体(gene ontology,GO)分析和京都基因与基因组数据库(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,筛选并整理排序前10位关系密切的相关富集分析结果,采用在线工具制作成气泡图。
1.4 动物实验 1.4.1 黄连水煎剂的制备用精密仪器称取黄连10.0 g,在100 mL烧杯中粉碎,加入10倍量的水充分浸泡,武火煮沸后文火煎煮0.5 h,纱布过滤,滤渣加纯化水重复上述步骤。经过2次过滤后,水浴浓缩,获得0.57 g/mL黄连水煎剂[6]。
1.4.2 动物造模和分组将18只C57小鼠随机分为3组,对照组(A组)、百草枯染毒组(B组)、百草枯染毒+黄连组(C组),每组6只。B组和C组小鼠腹腔注射30 mg/kg百草枯溶液(10 mg/mL溶于生理盐水)[7],建立小鼠百草枯染毒模型。C组小鼠腹腔注射百草枯溶液后,立即给予黄连5.7 g/kg(70 kg成人等效剂量的3倍)灌胃[8],1次/d,连续3 d,A组和B组小鼠每日同时间灌注等量生理盐水。
1.4.3 标本保存连续灌胃结束后,腹腔注射1%戊巴比妥钠(40 mg/kg)进行麻醉,常规消毒,将注射器刺入右心室,缓慢取血,将取得的血液放入EP管内,4 ℃、3 000 r/min离心10 min,留取上清并进行分装。上述操作完成后,打开腹腔,迅速取出肝脏,清洗干净血渍后,取一部分肝脏组织置于4%多聚甲醛中固定,用于病理检测,另一部分组织置于-80 ℃冰箱,保存备用。
1.4.4 小鼠肝脏HE染色小鼠肝脏组织在4%多聚甲醛中固定,经过乙醇脱水、二甲苯透明后,放入包埋机进行浸蜡、包埋,切成4 μm进行后续染色。制作肝脏HE切片,树胶封片后观察肝脏病理改变。
1.4.5 小鼠血清中TNF-α、ALT、AST水平检测取分装好的适量小鼠血清,严格按照说明书配置各溶液,按照说明书的步骤进行检测。
1.4.6 小鼠肝脏中AKT1、p-AKT1蛋白水平检测取适量小鼠肝脏组织,用蛋白裂解液提取蛋白,采用BCA法测定蛋白浓度,100 ℃下金属浴进行蛋白变性。取适量蛋白进行电泳,电泳结束后,用0.45 μm PVDF膜进行转印,用5%脱脂奶粉室温封闭1 h,4 ℃孵育一抗AKT1(1∶2 000)、p-ATK1(1∶2 000)过夜,二抗室温孵育1 h,洗膜3次后,用ECL发光液在凝胶成像仪上成像。采用ImageJ软件进行灰度分析,用p-AKT1与AKT1灰度比值表示蛋白磷酸化水平。
1.5 统计学分析应用GraphPad Prism 8.0软件进行统计学分析。计量资料以X±s表示,先进行方差齐性检验,再进行独立样本t检验,组间比较采用单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 黄连的活性成分在TCMSP数据库中筛选黄连药物活性成分,设置条件为OB≥30和DL≥0.18,最终获得14个活性成分。活性成分分别为黄麻甲甙、穆坪马兜铃酰胺、黄藤素、广玉兰素、氢化小檗碱、槲皮素、甲基黄连碱、黄柏酮、表小檗碱、小檗碱、氧化小檗碱、小檗红碱、掌叶二蒽酮、黄连碱。
2.2 黄连与百草枯中毒导致的急性肝损伤交集靶点基因构建在STP数据库中检索黄连药物成分,获得相关靶点基因,经过筛选去重后得到278个靶点基因。在GeneCards数据库中,检索百草枯中毒,获得相关靶点基因319个,检索急性肝损伤,获得相关靶点基因9 136个,获得百草枯中毒和急性肝损伤共同靶点基因294个。将294个靶点基因与黄连药物成分靶点基因取交集,最终得到32个共同靶点基因,这些共同靶点基因可能是黄连治疗百草枯中毒导致的急性肝损伤的潜在靶点基因。
2.3 活性成分-交集靶点网络图将黄连药物成分与最终获得的靶点基因导入Cytoscape3.7软件中,绘制药物-成分-疾病靶点的网络图(图 1)。其中,绿色节点代表黄连成分,黄色节点代表潜在靶点基因。图中绿色节点可以连接不同黄色结点,代表同一成分可以作用于不同靶点基因。同时,同一黄色节点可以连接不同绿色节点,代表同一靶点基因也可以对应不同成分。这充分体现出黄连在治疗百草枯中毒导致的急性肝损伤时具有多成分、多靶点基因的特点。
|
| 图 1 药物-成分-疾病靶点网络 Fig.1 Drug-components-disease targets network |
2.4 PPI网络分析
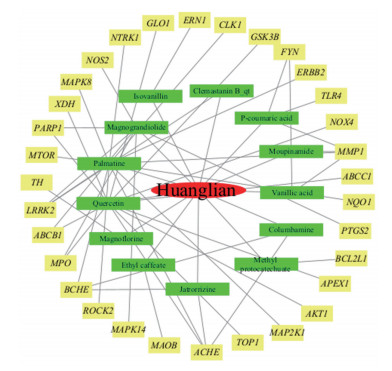
利用STRING数据库分析黄连在百草枯中毒导致的急性肝损伤中发挥作用的靶点,导出PPI网络图(图 2)和相关数据,利用中介中心性和接近中心性2个数值的均值作为筛选指标,结果显示,AKT1、TOP1、ErbB2、TLR4、PTGS2、MPO靶点蛋白连接度值较大,说明上述靶点蛋白是黄连在治疗百草枯中毒导致的急性肝损伤时的潜在靶点蛋白。
|
| 图 2 PPI网络 Fig.2 Protein-protein interaction network |
2.5 交集靶点基因的富集分析
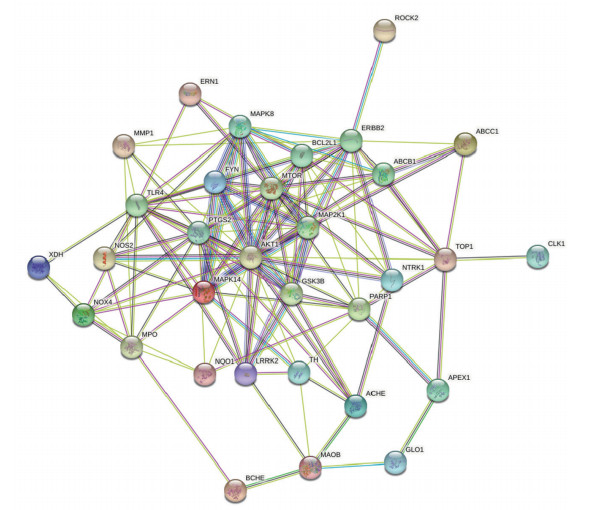
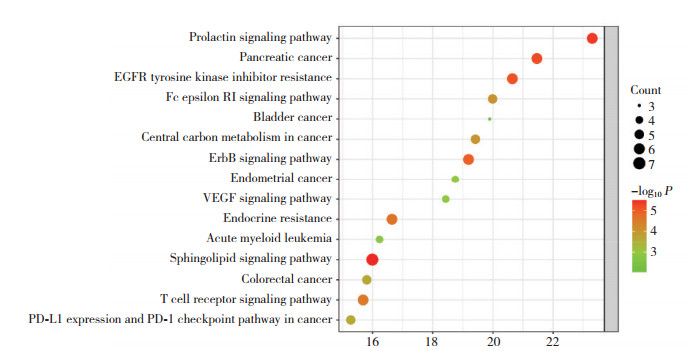
在DAVID数据库中分析交集靶点基因(图 3),最后得到GO富集分析通路195条,KEGG富集分析通路98条。这些靶点富集在生物过程127个,其中乙酰胆碱分解代谢过程、羧酸跨膜转运、环化酶活性的正向调控、正调节成纤维细胞生长因子的产生等富集程度较大;富集在细胞组成34个,其中Wnt信号体、核周内质网、后突触等富集程度较大;富集在分子功能34个,其中乙酰胆碱酯酶活性、胆碱酯酶活性、羧酸跨膜转运体活性等富集程度较大。KEGG排名前15条通路(图 4)包括催乳素信号通路、胰腺癌、表皮生长因子受体酪氨酸激酶抑制剂耐药性、FcεRI信号通路、膀胱癌、癌症中的中心碳代谢、ErbB信号通路、子宫内膜癌、血管内皮生长因子信号通路、内分泌抵抗、急性白血病、鞘脂信号、结肠癌、T细胞受体信号通路等。以上结果提示,上述通路可能在黄连治疗百草枯中毒导致的急性肝损伤中起到至关重要的作用。
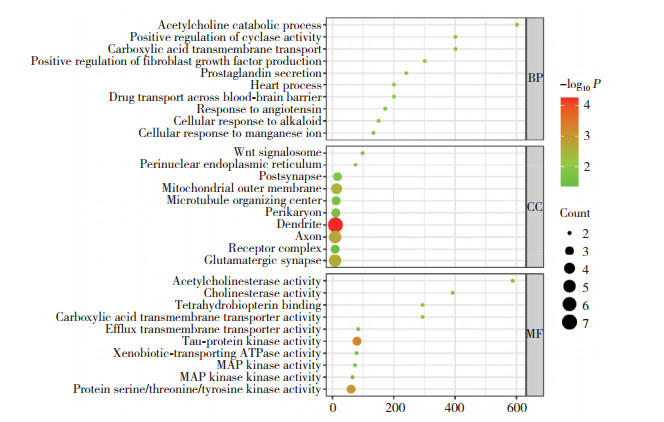
|
| BP, biological process; CC, cellular component; MF, molecular function. 图 3 GO富集分析 Fig.3 GO enrichment analysis |
|
| 图 4 KEGG富集分析 Fig.4 KEGG enrichment analysis |
2.6 小鼠肝脏HE染色
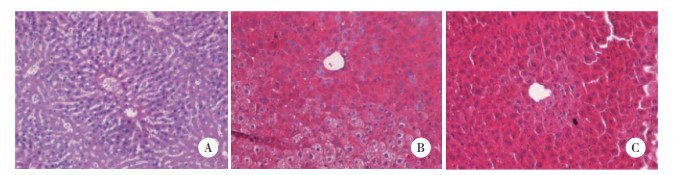
HE染色观察小鼠肝脏的病理改变(图 5)。A组细胞排列整齐,结构完整,走形清晰。B组肝细胞水肿坏死,伴有明显的炎症浸润。C组与B组相比,肝脏病理改变减轻,水肿减轻,炎症浸润减少。
|
| A, group A; B, group B; C, group C. 图 5 小鼠肝脏HE染色 ×200 Fig.5 HE staining of the mouse liver ×200 |
2.7 小鼠血清TNF-α、ALT、AST水平
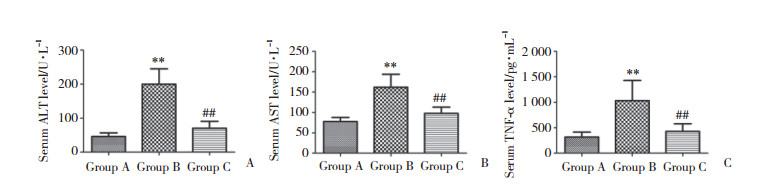
与A组相比,B组TNF-α、ALT、AST水平明显升高(P < 0.05),说明百草枯中毒导致炎症反应和肝功能损害。C组与B组相比,TNF-α、ALT、AST水平明显降低(P < 0.05),说明黄连治疗会减轻百草枯中毒后肝脏的炎症反应和肝功能损害。见图 6。
|
| A, ALT; B, AST; C, TNF-α. ** P < 0.01 vs group A; ## P < 0.01 vs group B. 图 6 小鼠血清中ALT、AST、TNF-α水平的变化 Fig.6 Changes in serum ALT, AST, and TNF-α levels |
2.8 小鼠肝脏AKT1和p-AKT1水平
选取PPI网络中最重要的AKT蛋白进行实验验证,采用Western blotting检测小鼠肝脏中AKT1和p-AKT1的蛋白表达水平。结果发现,B组p-AKT1与AKT1的比值增加,p-AKT1表达水平高于A组(P < 0.05)。C组与B组相比,p-AKT1与AKT1的比值下降,p-AKT1表达水平降低(P < 0.05)。见图 7。

|
| * P < 0.05 vs group A; # P < 0.05 vs group B. 图 7 Western blotting检测p-AKT1和AKT1的蛋白表达 Fig.7 Expression levels of p-AKT1 and AKT1 proteins detected by Western blotting |
3 讨论
本研究采用腹腔注射百草枯(30 mg/kg)的方法建立小鼠百草枯中毒模型。本课题组的前期研究[7]发现,腹腔注射10和20 mg/kg百草枯后,小鼠中毒率较低,腹腔注射40和50 mg/kg百草枯时,小鼠死亡率较高,腹腔注射30 mg/kg百草枯时,可以获得满意模型,故最终选定30 mg/kg百草枯为本研究的中毒剂量。
本研究通过网络药理学方法,分析了黄连与百草枯中毒导致的急性肝损伤的可能作用靶点,并预测了黄连在治疗百草枯中毒导致的急性肝损伤的可能分子作用机制。黄连的主要活性成分复杂,最多的是檗碱复合物,包括小檗碱、氢化小檗碱、表小檗碱、氧化小檗碱等,其中小檗碱又叫黄连素。既往研究[9]发现,黄连素可减轻肝损伤小鼠的炎症程度并明显改善病理损伤。
通过PPI网络分析发现,黄连与百草枯中毒导致的急性肝损伤的共同靶点蛋白包括AKT1、TOP1、ErbB2、TLR4、PTGS2、MPO。AKT1是一种丝氨酸/苏氨酸激酶,在细胞中广泛表达,是AKT家族的一员。AKT1参与细胞增殖、细胞生长、代谢、氧化应激[10]、炎症[11]等方面相关的信号通路,其发挥的作用又与KEGG分析中的富集通路作用相符,证明该蛋白可能是黄连治疗百草枯导致的急性肝损伤的研究焦点。TOP1不仅影响DNA的结构和功能,还能参与调节基因表达和信号转导。研究[12]表明,可以通过抑制TOP1的表达达到减轻肝损伤的治疗作用。ErbB2最初被定义为癌症基因,但是越来越多的研究发现,ErbB2的表达位置可能是新的诊断标志物,如核ErbB2表达是中毒性损伤的诊断标志,膜ErbB2阳性则提示胆汁淤积性肝病[13]。研究[14]发现,TLR4参与了对乙酰氨基酚导致的急性肝损伤的氧化、炎症、凋亡的调控机制。对PTGS2进行干扰,可以减轻缺血再灌注造成的肝损伤[15]。MPO可以参与炎症反应,介导炎症、氧化应激、组织细胞损伤的恶行循环。研究[16]表明,MPO参与了大鼠急性肝衰竭的炎症、氧化应激反应。
GO分析发现,黄连主要参与乙酰胆碱代谢、激酶代谢、羧酸跨膜转运以及多种代谢。KEGG分析结果表明,黄连可能通过抗凋亡、抗氧化应激、抗炎等通路发挥对肝脏的治疗作用。综合考虑共同靶点以及通路富集情况,选取AKT1和p-AKT1进行动物实验验证。动物实验结果显示,经过黄连治疗后,百草枯中毒小鼠的肝脏病理损伤减轻,炎症指标TNF-α降低,转氨酶水平降低,p-AKT1蛋白表达水平降低。AKT1是一种重要的信号传递蛋白质,AKT信号通路的激活在细胞应激反应和炎症过程中有重要作用。抑制AKT磷酸化可以减少炎症过程中产生的细胞因子和化学物质的生成,从而减轻组织损伤和炎症反应[17]。本研究证明,百草枯中毒后p-AKT1蛋白增加,ATK信号通路被激活,可能与细胞的应激状态、炎症反应有关。黄连治疗后,AKT磷酸化水平降低,说明AKT的磷酸化状态被药物抑制,从而降低炎症、应激反应,发挥其治疗作用。
综上所述,黄连可能通过降低AKT1蛋白的磷酸化水平,从而减轻百草枯中毒导致的急性肝损伤和炎症反应。本研究为黄连治疗百草枯导致的急性肝损伤奠定了一定的研究基础,但仍需细胞实验进行进一步验证。
| [1] |
GHESHLAGHI F, HAGHIRZAVAREH J, WONG A, et al. Prediction of mortality and morbidity following paraquat poisoning based on trend of liver and kidney injury[J]. BMC Pharmacol Toxicol, 2022, 23(1): 67. DOI:10.1186/s40360-022-00609-y |
| [2] |
沈海涛, 吴娜, 赵宏宇, 等. 茶多酚对百草枯中毒大鼠肾脏氧化应激及炎症反应的影响[J]. 中国医科大学学报, 2017, 46(3): 210-213. DOI:10.12007/j.issn.0258-4646.2017.03.005 |
| [3] |
AMIN F, MEMARZIA A, KAZEMI RAD H, et al. Systemic inflammation and oxidative stress induced by inhaled paraquat in rat improved by carvacrol, possible role of PPARγ receptors[J]. Biofactors, 2021, 47(5): 778-787. DOI:10.1002/biof.1761 |
| [4] |
WANG SJ, XU Z, CAI BC, et al. Berberine as a potential multi-target agent for metabolic diseases: a review of investigations for Berberine[J]. Endocr Metab Immune Disord Drug Targets, 2021, 21(6): 971-979. DOI:10.2174/1871530320666200910105612 |
| [5] |
ZHANG XB, GAO R, ZHOU Z, et al. Uncovering the mechanism of Huanglian-Wuzhuyu herb pair in treating nonalcoholic steatohepatitis based on network pharmacology and experimental validation[J]. J Ethnopharmacol, 2022, 296: 115405. DOI:10.1016/j.jep.2022.115405 |
| [6] |
韩春杨, 孙桃桃, 徐婧, 等. 黄连对脂多糖诱导大鼠肝细胞损伤的保护作用[J]. 中国药学杂志, 2018, 53(11): 869-875. DOI:10.11669/cpj.2018.11.004 |
| [7] |
WANG N, WANG XF, LI YH, et al. The STING-IRF3 pathway contributes to paraquat-induced acute lung injury[J]. Toxicol Mech Methods, 2022, 32(2): 145-157. DOI:10.1080/15376516.2021.1974133 |
| [8] |
张力文, 胡娜, 袁琳, 等. 黄连对高脂饮食诱导肥胖小鼠胰岛保护作用的实验研究[J]. 中国中医药科技, 2021, 28(3): 367-370. |
| [9] |
陈岩勤, 范婷婷, 杨盛刚, 等. 黄连素对四氯化碳诱导的小鼠肝损伤的治疗作用研究[J]. 黑龙江畜牧兽医, 2022(8): 109-113. DOI:10.13881/j.cnki.hljxmsy.2021.05.0193 |
| [10] |
SHIAU JP, CHUANG YT, CHENG YB, et al. Impacts of oxidative stress and PI3K/AKT/mTOR on metabolism and the future direction of investigating fucoidan-modulated metabolism[J]. Antioxidants (Basel), 2022, 11(5): 911. DOI:10.3390/antiox11050911 |
| [11] |
PEKGÖZ S, ASCI H, ERZURUMLU Y, et al. Nebivolol alleviates liver damage caused by methotrexate via AKT1/Hif1α/eNOS signaling[J]. Drug Chem Toxicol, 2022, 45(5): 2153-2159. DOI:10.1080/01480545.2021.1908759 |
| [12] |
SUN CC, LI Y, ZHANG YT, et al. Subacute oral toxicology and toxicokinetics of pterostilbene, a novel Top1/Tdp1 inhibiting anti-tumor reagent[J]. Drug Chem Toxicol, 2023, 46(2): 392-399. DOI:10.1080/01480545.2022.2042014 |
| [13] |
DÖRING P, CALVISI DF, DOMBROWSKI F. Nuclear ErbB2 expression in hepatocytes in liver disease[J]. Virchows Arch, 2021, 478(2): 309-318. DOI:10.1007/s00428-020-02871-z |
| [14] |
YAO C, WANG Y, GONG D, YAO CX, et al. Anti-TLR4 IgG2 prevents acetaminophen-induced acute liver injury through the Toll-like receptor 4/MAPKs signaling pathway in mice[J]. Curr Mol Med, 2023, 23(5): 453-469. DOI:10.2174/1566524022666220516141728 |
| [15] |
KHAN H, SHARMA K, KUMAR A, et al. Therapeutic implications of cyclooxygenase (COX) inhibitors in ischemic injury[J]. Inflamm Res, 2022, 71(3): 277-292. DOI:10.1007/s00011-022-01546-6 |
| [16] |
王柯尹, 魏大海, 邹卓林, 等. D-GalN/LPS诱导大鼠急性肝衰竭中髓过氧化物酶和Nrf2/HO-1信号通路的变化[J]. 中国急救医学, 2022, 42(8): 717-722. DOI:10.3969/j.issn.1002-1949.2022.08.012 |
| [17] |
LI Y, LU L, LUO N, et al. Inhibition of PI3K/AKt/mTOR signaling pathway protects against d-galactosamine/lipopolysaccharide-induced acute liver failure by chaperone-mediated autophagy in rats[J]. Biomed Pharmacother, 2017, 92: 544-553. DOI:10.1016/j.biopha.2017.05.037 |
 2023, Vol. 52
2023, Vol. 52