文章信息
- 彭标, 杨相辉, 蒋莎莉, 肖盼, 彭诚蓉, 刘达
- PENG Biao, YANG Xianghui, JIANG Shali, XIAO Pan, PENG Chengrong, LIU Da
- SMARCA4缺陷型非小细胞肺癌的临床特征、治疗和预后分析
- Clinical features, treatment, and prognosis of SMARCA4-deficient non-small cell lung cancer
- 中国医科大学学报, 2023, 52(7): 662-666
- Journal of China Medical University, 2023, 52(7): 662-666
-
文章历史
- 收稿日期:2022-11-23
- 网络出版时间:2023-07-06 17:37:09
2. 南华大学附属长沙中心医院肿瘤科,长沙 410000;
3. 南华大学附属长沙中心医院病理科,长沙 410000;
4. 南华大学附属长沙中心医院结核重症监护室,长沙 410000
SMARCA4缺陷型非小细胞肺癌(SMARCA4-deficient non-small cell lung cancer,SMARCA4-dNSCLC) 是一种罕见的肺部肿瘤,具有局部或远处转移较早、预后不良和放化疗效果不佳的特点,目前尚缺乏明确的治疗方案[1]。SMARCA4缺失突变可见于7.0%的非小细胞肺癌中,约50%的肿瘤存在与吸烟相关的典型共突变基因,包括TP53、KRAS和STK11等[2]。SMARCA4-dNSCLC的主要特征为SMARCA4基因缺失和未分化的横纹肌样表型。早期症状并不典型,可表现为呼吸困难、疼痛、咳嗽、咯血和上腔静脉综合征等;由于其高度的侵袭性,局部或远处转移较早,通常多以远处转移为首发症状[3-4]。目前,国内外暂无有效的治疗方案,且对此类疾病报道较少,本文收集我院确诊的4例SMARCA4-dNSCLC患者的病例资料,复习相关文献,分析并讨论其临床表现、免疫组织化学、病理学、影像学特征、治疗和预后特点。
1 材料与方法 1.1 病例资料通过电子病例系统收集整理本院2019年3月至2022年9月收治的4例SMARCA4-dNSCLC患者的临床资料,通过电话咨询获得随访信息。随访结束时间为2022年8月1日。生存时间为确诊日期到死亡日期或随访截止日期。本研究所有患者知情同意,并获得南华大学附属长沙中心医院伦理委员会批准。
1.2 方法 1.2.1 免疫组织化学法EnVision试剂盒、抗体均购自于丹麦丹科股份有限公司,使用EnVision两步法。脱蜡、水化组织切片,预处理组织切片,蒸馏水漂洗,置于TBS中阻断内源性过氧化物酶,再次用蒸馏水漂洗,置于TBS 10 min,一抗孵育10~30 min,TBS漂洗10 min,EnVisionTM孵育10~30 min,然后再用TBS漂洗10 min,色源底物溶液孵育10 min,蒸馏水漂洗,复染、封片。
1.2.2 实时PCR采用天根生化(北京) 有限公司的试剂盒,按照试剂盒说明书进行操作。切取4张5 μm厚石蜡包埋组织样品,置于1.5 mL离心管中,加入1.0 mL二甲苯脱蜡,1 mL无水乙醇,待乙醇充分挥发后,加入200 μL缓冲液GA和20 μL蛋白酶K混匀,于90 ℃孵育1 h。用RNase-Free吸附柱CR2提取基因DNA,并将其移至离心管中,-20 ℃保存。
2 结果 2.1 临床特征4例患者均为男性,平均年龄59岁,均有多年吸烟史。2例患者出现胸闷、气促、咳嗽、咳痰等呼吸系统症状,1例患者以右肩部疼痛为首发症状,1例患者无症状,于体检时发现;肿瘤最大径范围为18~62 mm,平均34 mm。确诊时肿瘤分期为2例ⅢB期,2例ⅣB期(分别为脑、骨转移和左侧胸膜转移)。影像学检查结果显示,肿瘤原发部位右下、右上、左下、左上肺各1例;4例均表现为肺部肿块,2例边缘模糊,1例边缘欠规整,1例边缘清晰;4例均伴有斑片状、结节状高密度影,3例有胸腔积液形成,1例有胸膜增厚征象。确诊方法为1例经支气管镜黏膜活检,3例CT引导下经皮穿刺肺活检。病理类型为1例大细胞肺癌,3例腺癌。见表 1。
| 临床特征 | 病例1 | 病例2 | 病例3 | 病例4 |
| 性别 | 男 | 男 | 男 | 男 |
| 年龄(岁) | 56 | 63 | 62 | 56 |
| 吸烟史 | 有 | 有 | 有 | 有 |
| 饮酒史 | 有 | 有 | 有 | 有 |
| 肿瘤大小(mm2) | 62×55 | 30×22 | 20×19 | 24×18 |
| 肿瘤原发部位 | 左下肺 | 右上肺 | 左上肺 | 右下肺 |
| 病理类型 | 腺癌 | 腺癌 | 腺癌 | 大细胞肺癌 |
| 肿瘤分期 | T3N3M1 (ⅣB期) | T3N2M0 (ⅢB期) | T3N2M1 (ⅣB期) | T3N2M0 (ⅢB期) |
| 肿块 | 有(边缘模糊) | 有(边缘不规整) | 有(边缘模糊) | 有(边缘清晰) |
| 结节 | 有 | 无 | 有 | 有 |
| 分叶征 | 无 | 有 | 无 | 有 |
| 毛刺征 | 无 | 有 | 无 | 无 |
| 胸水 | 有 | 有 | 无 | 有 |
| 肺气肿 | 有 | 有 | 有 | 有 |
| 阻塞性肺炎 | 有 | 有 | 无 | 有 |
| 纤维条索影 | 有 | 有 | 无 | 无 |
| 纵隔淋巴结肿大 | 有 | 有 | 有 | 有 |
2.2 组织学特征(图 1)
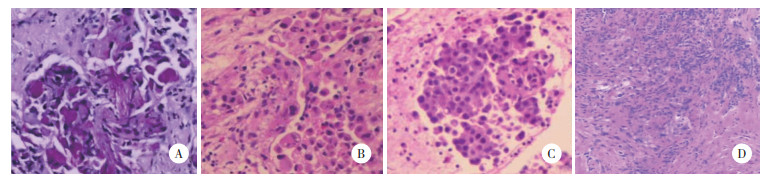
|
| A,病例1;B,病例2;C,病例3;D,病例4. A-C,×400;D,×100. 图 1 光学显微镜下病理组织切片 |
2.2.1 病例1
胞质丰富,呈嗜酸性,部分胞质内可见黏液,细胞核中度异型性,核分裂象易见,可见肿瘤细胞围绕神经周围间隙侵犯。
2.2.2 病例2胞质丰富,呈嗜酸性,部分胞质内可见黏液,可见核分裂象、病理性核分裂象以及坏死。
2.2.3 病例3瘤细胞呈上皮样弥漫分布,失黏附,胞质丰富,呈嗜酸性,部分胞质内可见黏液,部分细胞核偏位,核仁明显。
2.2.4 病例4瘤细胞呈上皮样,胞质丰富,呈嗜酸性,核仁明显。
2.3 免疫组织化学及病理学特点3例SMARCA4表达缺失,3例CK7均阳性表达,提示肿瘤细胞向上皮细胞分化趋势;3例Ki-67指数均 > 30%,最高达80%,提示肿瘤细胞增殖活跃。4例P40、SALL4、NapsinA均表现阴性,P63阳性1例,阴性3例;TTF-1阳性1例,阴性2例,不详1例;Heppar-1阳性2例,不详2例;Vimentin阳性1例,阴性2例,不详1例。见表 2。
| 免疫组化及病理特征 | 病例1 | 病例2 | 病例3 | 病例4 |
| Brg-1 | - | - | - | * |
| P40/P63 | -/- | -/- | -/- | -/+ |
| NapsinA/Heppar-1 | -/+ | -/+ | -/* | -/* |
| CK7/TTF-1 | +/- | +/- | +/+ | -/* |
| Ki-67 | +,80% | +,30% | +,60% | * |
| Vimentin/SALL-4 | +/- | -/- | -/- | */* |
| 基因检测 | KRAS基因点突变,c38G > A p G13D 50.19%;PD-L1 22C3 TPS=0 |
* | * | TPS阳性,高表达(≥50%),约为90% |
| 瘤细胞特征 | - | - | 瘤细胞呈上皮样弥漫分布,失黏附 | 瘤细胞呈上皮样 |
| 细胞质 | 胞质丰富,呈嗜酸性,部分胞质内可见黏液 | 胞质丰富,呈嗜酸性,部分胞质内可见黏液 | 胞质丰富,呈嗜酸性,部分胞质内可见黏液 | 胞质丰富,呈嗜酸性 |
| 细胞核 | 中度异型性 易见核分裂象 |
可见核分裂象 部分偏位,核仁明显 |
病理性核分裂象 | 核仁明显 |
| 坏死征象 | 无 | 有 | 无 | 无 |
| 其他 | 肿瘤细胞围绕神经周围间隙侵犯 | 无 | 无 | 无 |
| *,未查此项. | ||||
2.4 实时PCR
实时PCR检测结果显示,1例呈现KRAS基因点突变,c38G > ApG13D50.19%,1例TPS阳性(高表达,约为90%),其余2例患者未行此项检测。
2.5 治疗及预后病例1、2、4行系统治疗,病例3仅行对症支持治疗。截至随访终止日期,病例1出院后4个月内死亡;病例2带瘤生存8个月,卡氏功能状态(karnofsky performance status,KPS) 评分90分;病例3带瘤生存10月,KPS评分70分;病例4带瘤生存29月,KPS评分90分。见表 3。
| 治疗及预后 | 病例1 | 病例2 | 病例3 | 病例4 |
| 化疗 | 有(顺铂+培美曲塞) | 有(洛铂+培美曲塞) | 无 | 有(顺铂+依托泊苷) |
| 放疗 | 无 | 有 | 无 | 有 |
| 免疫抑制剂 | 有(替雷利珠) | 有(替雷利珠) | 无 | 有(替雷利珠) |
| 抗血管生成治疗 | 无 | 无 | 无 | 有(贝伐珠单抗) |
| 对症支持治疗 | 有 | 有 | 有 | 有 |
| 预后 | 出院后4个月内死亡 | 带瘤生存8个月 | 带瘤生存10个月 | 带瘤生存29个月 |
| KPS评分(分) | 0 | 90 | 70 | 90 |
3 讨论
SMARCA4-dNSCLC是一种高度恶性的肺部肿瘤,主要表现为SMARCA4基因缺陷和未分化横纹肌样表型,在组织学、免疫表型、病理学等方面具有独特的特征。SMARCA4-dNSCLC早期症状通常以压迫或浸润相关症状和体征的形式出现,如呼吸困难、疼痛、咳嗽、咯血和上腔静脉综合征,当肿瘤出现骨转移时也可表现出与转移相关的症状。此外,以胸膜为基础的肿块还可表现为复发性胸腔积液或脓胸[3-5]。在病理学上,SMARCA4-dNSCLC细胞角蛋白表达可变,并且大部分可见腺体,少数表现为鳞状细胞的特点[6]。在基因组学方面,SMARCA4-dNSCLC通常与STK11、KEAP1和KRAS发生共突变,少见EGFR、ROS1和ALK等常见驱动基因突变[4]。美国DANA-FARBER癌症研究所发现[7],KRAS是SMARCA4-dNSCLC最常见的共突变基因,约占11%~35%,该类共突变患者预后差,相比SMARCA4/KRAS野生型患者,中位无进展生存期(median progression-free survival,mPFS) (4.1个月vs 1.4个月) 和中位总生存期(median overall survival,mOS)(15.1个月vs 3.0个月) 均缩短。在免疫组化上,SMARCA4-dNSCLC常表现为TTF-1阴性,CK7、Heppar-1阳性。SMARCA4-dNSCLC中罕见TTF-1阳性表达,TTF-1阳性的患者一般在组织病理学表现为高分化,光镜下表现为组织形态紧凑,核质比较高,然而,TTF-1阴性的患者表现为低分化,光镜下表现为组织形态疏松,胞质丰富,间质富含炎症细胞,并可见中性粒细胞浸润,与SMARCA4-dNSCLC TTF-1阴性的患者相比,TTF-1阳性预后更好[8]。
在治疗及预后方面,SMARCA4-dNSCLC通常少伴有EGFR、ALK和ROS1等常见驱动基因突变,对PD-1等免疫抑制剂缺乏反应性,目前暂无特效的靶向药及免疫抑制剂。VELUT等[9]认为可能是该类肿瘤免疫微环境中存在大量浸润FOXP3+ Treg和中性粒细胞导致了SMARCA4-dNSCLC对免疫抑制剂不敏感。但是也有文献[10]报道PD-1抑制剂(纳武鲁单抗) 成功治疗SMARCA4-dNSCLC伴高肿瘤突变负荷的病例。产生这种不同的原因可能是样本量有限、治疗方案不同和发生共突变,如STK11/KEAP1,KEAP1、PBRM1、SMARCA4和STK11被认为可能与免疫治疗的疗效降低有关[11]。此外,研究[12]发现,SMARCA4突变会导致肿瘤细胞对顺铂的敏感性增强。然而,在SMARCA4缺陷型小细胞肺癌患者中,铂类药物的治疗效果不理想[13-14]。DAGOGO-JACK等[15]发现在KRAS共突变的SMARCA4-dNSCLC患者中,与接受非培美曲塞的铂类双联疗法(57/138) 的相比,铂类+培美曲塞治疗(81/138) 的客观缓解率(objective response rate,ORR) 显著降低(30.9% vs 47.4%),疾病控制率(disease control rate,DCR) (51.8% vs 71.9%),mPFS (4.1个月vs 7.1个月) 和mOS均明显缩短(OS 9.7个月vs 26.9个月)。在本研究中,病例1检测到KRAS和SMARCA4共突变,并且在治疗上使用了铂类+培美曲塞联合治疗的方案,疾病在4个月内快速进展最终死亡,铂类+培美曲塞联合治疗方案并不能使患者受益,这与上述研究结果一致,可能提示在KRAS共突变的SMARCA4-dNSCLC患者中,铂类+培美曲塞加速了疾病的进展。此外,使用铂类+依托泊苷联合治疗方案的病例4中,肿瘤出现复发,KPS评分为90分,低于铂类+培美曲塞联合治疗的患者,这提示在单纯性SMARCA4-dNSCLC铂类+培美曲塞似乎更优于铂类+依托泊苷的治疗方案。但是,由于目前对于不同共突变类型的SMARCA4-dNSCLC化疗方案的疗效缺乏临床报道,以上结论还需要大量的循证医学证据来证实。
| [1] |
陈沁阳, 张杰, 谢晓慧, 等. SMARCA4/BRG1缺陷型非小细胞肺癌的临床病理特点和治疗策略[J]. 中国肿瘤临床, 2022, 49(3): 155-158. DOI:10.12354/j.issn.1000-8179.2022.20210970 |
| [2] |
NAMBIRAJAN A, SINGH VA, BHARDWAJ N, et al. SMARCA4/BRG1-deficient non-small cell lung carcinomas: a case series and review of the literature[J]. Arch Pathol Lab Med, 2021, 145(1): 90-98. |
| [3] |
NAMBIRAJAN A, JAIN D. Recent updates in thoracic SMARCA4-deficient undifferentiated tumor[J]. Semin Diagn Pathol, 2021, 38(5): 83-89. DOI:10.1053/j.semdp.2021.06.001 |
| [4] |
KUNIMASA K, NAKAMURA H, SAKAI K. Patients with SMARCA4-deficient thoracic sarcoma and severe skeletal-related events[J]. Lung Cancer, 2019, 132: 59-64. DOI:10.1016/j.lungcan.2019.03.029 |
| [5] |
NAMBIRAJAN A, PARSHAD R, GOYAL A, et al. Innocuous clinical presentation of a SMARCA4-deficient thoracic sarcoma arising in a patient with chronic empyema thoracis[J]. Pathology, 2019, 51(6): 657-659. DOI:10.1016/j.pathol.2019.05.011 |
| [6] |
SUN T, GILANI SM, PODANY P, et al. Cytomorphologic features of SMARCA4-deficient non-small cell lung carcinoma and correlation with immunohistochemical and molecular features[J]. Cancer Cytopathol, 2022, 130(8): 620-629. DOI:10.1002/cncy.22581 |
| [7] |
ALESSI JV, RICCIUTI B, SPURR LF, et al. SMARCA4 and other SWItch/sucrose NonFermentable family genomic alterations in NSCLC: clinicopathologic characteristics and outcomes to immune checkpoint inhibition[J]. J Thorac Oncol, 2021, 16(7): 1176-1187. DOI:10.1016/j.jtho.2021.03.024 |
| [8] |
MEHTA A, DIWAN H, BANSAL D, et al. TTF1-positive SMARCA4/BRG1 deficient lung adenocarcinoma[J]. J Pathol Transl Med, 2022, 56(1): 53-56. DOI:10.4132/jptm.2021.09.16 |
| [9] |
VELUT Y, DECROIX E, BLONS H, et al. SMARCA4-deficient lung carcinoma is an aggressive tumor highly infiltrated by FOXP3+ cells and neutrophils[J]. Lung Cancer, 2022, 169. |
| [10] |
MARINELLI D, MAZZOTTA M, SCALERA S, et al. KEAP1-driven co-mutations in lung adenocarcinoma unresponsive to immunotherapy despite high tumor mutational burden[J]. Ann Oncol, 2020, 31(12): 1746-1754. DOI:10.1016/j.annonc.2020.08.2105 |
| [11] |
NAITO T, UMEMURA S, NAKAMURA H, et al. Successful treatment with nivolumab for SMARCA4-deficient non-small cell lung carcinoma with a high tumor mutation burden: a case report[J]. Thorac Cancer, 2019, 10(5): 1285-1288. DOI:10.1111/1759-7714.13070 |
| [12] |
BELL EH, CHAKRABORTY AR, MO XK, et al. SMARCA4/BRG1 is a novel prognostic biomarker predictive of cisplatin-based chemotherapy outcomes in resected non-small cell lung cancer[J]. Clin Cancer Res, 2016, 22(10): 2396-2404. DOI:10.1158/1078-0432.ccr-15-1468 |
| [13] |
AGAIMY A, FUCHS F, MOSKALEV EA, et al. SMARCA4-deficient pulmonary adenocarcinoma: clinicopathological, immunohistochemical, and molecular characteristics of a novel aggressive neoplasm with a consistent TTF1neg/CK7pos/HepPar-1pos immunophenotype[J]. Virchows Arch, 2017, 471(5): 599-609. DOI:10.1007/s00428-017-2148-5 |
| [14] |
RICCIUTI B, BRAMBILLA M, CORTELLINI A, et al. Clinical outcomes to pemetrexed-based versus non-pemetrexed-based platinum doublets in patients with KRAS-mutant advanced non-squamous non-small cell lung cancer[J]. Clin Transl Oncol, 2020, 22(5): 708-716. DOI:10.1007/s12094-019-02175-y |
| [15] |
DAGOGO-JACK I, SCHROCK AB, KEM M, et al. Clinicopathologic characteristics of BRG1-deficient NSCLC[J]. J Thorac Oncol, 2020, 15(5): 766-776. DOI:10.1016/j.jtho.2020.01.002 |
 2023, Vol. 52
2023, Vol. 52