文章信息
- 李保银, 于浩, 张聪, 祝岩
- LI Baoyin, YU Hao, ZHANG Cong, ZHU Yan
- 左心室质量指数对重度主动脉瓣病变患者的评估作用
- Echocardiographic assessment of left ventricular mass index in the evaluation of patients with severe aortic valve disease
- 中国医科大学学报, 2023, 52(6): 553-556
- Journal of China Medical University, 2023, 52(6): 553-556
-
文章历史
- 收稿日期:2022-07-16
- 网络出版时间:2023-05-25 15:34:43
退行性主动脉瓣病变发病率逐年升高,其中主动脉瓣狭窄(aortic stenosis,AS) 是由于左心室压力超负荷引起左心室向心性肥厚,主动脉瓣关闭不全(aortic insufficiency,AI) 因左心室容量和压力超负荷导致左心室离心性心肌肥厚,舒张期心室壁张力持续增加,左心室容积显著增大、心室壁增厚[1]。病理生理机制的不同导致2种瓣膜疾病手术适应证及治疗方案存在差异,既往对AS的研究比较全面[2],但针对重度AI患者远期并发症的病因学研究亟待完善。
外科手术的风险和预后主要取决于术前心肌肥厚程度、左心室收缩和舒张功能[3],AI患者术后预后相对较差。左心室质量指数(left ventricular mass index,LVMI) 是主动脉瓣置换(aortic valve replacement,AVR) 患者术后康复情况的重要预测因子,在左心室肥厚程度评估中起重要作用[4]。国外相关研究表明LVMI与AVR术后患者远期生存率密切相关[5],其中心肌肥厚严重患者远期不良事件发生率较高[6]。因心肌肥厚受诸多因素影响,本研究排除高血压、糖尿病、左心室收缩障碍以及其他合并症,筛选出左心室功能正常或轻度减低的患者资料,探讨LVMI对重度主动脉瓣病变患者的评估作用。
1 材料与方法 1.1 一般资料回顾性分析2020年9月至2022年3月因重度慢性主动脉瓣病变于我科行单纯AVR的115例患者住院期间的基线资料与心脏彩超数据。纳入标准:(1) 于我院行单纯AVR;(2) 术前心脏彩超明确患者存在单纯退行性重度AS或重度AI,诊断标准参照2017《AHA/ACC瓣膜性心脏病患者管理指南:美国心脏病学会/美国心脏协会临床实践指南工作组的报告》 [7];(3) 左心室射血分数(left ventricular ejection fraction,LVEF) > 0.4;AS患者跨主动脉瓣压差 > 30 mmHg;(4) 无肾动脉狭窄、嗜铬细胞瘤、原发性醛固酮增多等继发性高血压疾病;(5) 既往无心脏手术或介入治疗病史;(6) 对本研究知情并签署相关的知情同意书;(7) 入院前在心血管内科或外科门诊行规范药物治疗。排除标准:(1) 高血压、2型糖尿病、冠状动脉粥样硬化性心脏病等疾病;(2) 心房颤动、房室传导阻滞、预激综合症、长Q-T间期等心律失常;(3) 抑郁症、无自主认知等精神类疾病;(4) 主动脉瓣中度关闭不全或者狭窄;(5) 急性主动脉瓣瓣叶脱垂或感染性心内膜炎;(6) 急性左心力衰竭及术前机械通气;(7) 既往心肌病。本研究获得北部战区总医院医学伦理会批准。根据瓣膜病变类型将患者分为A、B 2组。其中A组为单纯慢性重度AS患者(n = 37),B组为单纯慢性重度AI患者(n = 55)。A组男15例,女22例,年龄(58.83±1.95) 岁;B组男25例,女30例,年龄(54.44±1.84) 岁。
1.2 研究方法心脏超声检查采用飞利浦IE33型彩色多普勒超声诊断仪。入院时记录患者性别、年龄、LVEF值、身高、体质量、发现主动脉瓣膜损害致重度到手术治疗间隔时间(简称术前间隔时间)、体质量指数、体表面积(body surface area,BSA)、左心室后壁厚度(left ventricular posterior wall thickness,LVPWT)、术前左心室舒张末内径(left ventricular end-diastolic diameter,LVDd)、术前室间隔厚度(interventricular septal thickness,IVST)、心功能NYHA分级及术前LVEF。心脏彩超指标测量结果采用3次心脏彩超检查的平均值。左心室重量(left ventricular mass,LVM) (g) =0.8×1.04× [(IVST+LVPWT+LVDd)3-LVDd3]+0.6,LVMI (g/m2) =LVM/BSA。
1.3 统计学分析采用SPSS 26.0软件进行统计分析,组间基线数据比较采用χ2检验,计量资料以x±s表示。采用独立样本t检验分析2组LVMI差异,采用线性回归分析研究B组术前间隔时间和LVMI的关系。P < 0.05为差异有统计学意义。
2 结果 2.1 2组一般资料比较2组患者年龄、性别、LVEF等一般资料比较,差异无统计学意义(均P > 0.05)。见表 1。
| 指标 | A组(n = 37) | B组(n = 55) | P |
| 年龄(岁) | 58.83±1.95 | 54.44±1.84 | 0.273 |
| 性别[n (%)] | 20 (54) | 36 (65) | 0.286 |
| 心率(次/min) | 72.62±9.84 | 74.84±11.07 | 0.328 |
| 术前间隔时间(年) | 1.54±0.18 | 1.39±0.17 | 0.365 |
| BSA (m2) | 1.75±0.18 | 1.78±0.19 | 0.445 |
| LVEF | 0.57±0.06 | 0.56±0.05 | 0.611 |
| 左心房内径(mm) | 36.95±4.85 | 38.76±5.92 | 0.125 |
2.2 2组患者术前LVMI及LVM比较
AVR手术前,A组LVMI [(124.11±5.31) g/m2)]低于B组LVMI [(148.33±6.47) g/m2)],差异有统计学意义(P = 0.005)。A组LVM [(217.38±10.18) g]低于B组LVM [(266.27±13.40) g],差异有统计学意义(P = 0.009),表明AI患者术前左心室肥厚更严重。见表 2。
| 指标 | A组(n = 37) | B组(n = 55) | P |
| 术前间隔时间(年) | 1.54±0.18 | 1.78±0.19 | 0.365 |
| LVMI (g/m2) | 124.11±5.31 | 148.33±6.47 | 0.005 |
| LVM (g) | 217.38±10.18 | 266.27±13.40 | 0.009 |
| LVPWT (mm) | 12.38±1.59 | 11.07±1.41 | < 0.001 |
| LVDd (mm) | 45.24±5.89 | 56.31±8.73 | < 0.001 |
| IVST (mm) | 12.07±2.34 | 11.24±2.18 | 0.003 |
2.3 B组术前间隔时间和LVMI的关系
线性回归分析结果(图 1)显示,术前间隔时间和LVMI呈现较好的线性关系,模型拟合度良好(r2=0.78,P < 0.05),术前等待时间越长,AI患者LVMI越高。以AS患者的LVMI指标均值作为y值,得到对应的术前间隔时间。提示发现重度AI患者半年内应尽早手术。
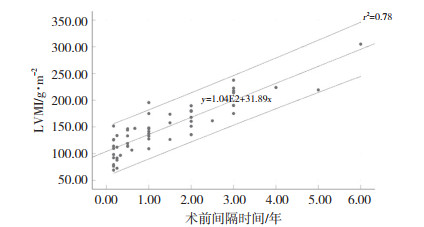
|
| 图 1 术前间隔时间对LVMI的影响 |
3 讨论
本研究结果显示,慢性重度AI患者LVMI [(148.33±6.47) g/m2)]明显高于慢性AS患者[(124.11±5.31) g/m2)],提示离心性肥厚为主的AI患者心肌肥大更明显。AI患者行心脏手术时,LVMI及LVM指标明显高于AS患者,AI患者远期预后不如AS患者,左心功能正常的AS患者行AVR后远期寿命可以达到正常人平均寿命[8]。如果AI患者在心肌肥厚发展到重度AS患者水平时尽早手术,远期术后恢复情况会得到改善。心肌肥厚发生的机制不同,AS导致的左心室压力超负荷诱发的向心性肥厚,在细胞水平通过心肌细胞肌小节并列性增加而增加心肌细胞宽度,左心室质量及厚度增加,无心室扩张;AI导致的左心室容量及压力超负荷通过肌小节并列性及串联性增加而增加细胞的宽度和长度,左心室半径和整体质量明显增加[9]。左心室心肌肥厚是心脏疾病死亡率的独立危险因素。本研究发现主动脉瓣膜损害至重度到手术治疗间隔时间上2组无明显差异,从一定程度说明单纯AI的离心性肥厚LVMI指标发展速度更快,并且术前等待间隔时间越长,LVMI越高(r2=0.78,P < 0.05)。
LVMI对于AVR患者远期预后有重大预测价值[10]。重度AI患者术前LVMI明显升高,但是重度AS患者术前LVMI接近正常人水平,这与国外研究[11]结论一致。重度AI患者为了避免左心室肥厚加重导致术后远期不良事件的发生,半年内应尽早手术[12]。目前按照瓣膜外科相关指南意见,主动脉瓣中度关闭不全不需外科治疗,可以口服药物,主动脉瓣出现重度关闭不全时才需外科干预,但是临床中患者常因自行加大利尿药剂量掩盖症状而延误手术时机[13]。目前,心血管门诊医生普遍缺乏对LVMI指标的认识,导致对患者的相关宣教不足,没有明确告知患者虽然口服药物治疗后外在的胸闷气短等症状缓解,但是内在的心肌肥厚进展持续恶化,对AI患者远期恢复不利。AS患者药物治疗效果往往不佳[14],患者一般会早期选择外科治疗[15],因此AS患者远期临床疗效更好。本研究结果显示,应该更积极的从疾病发生早期评估AI患者LVMI指标[16],甚至在AI患者从中度到重度的进展期,通过连续检测LVMI选择更早的手术干预时机,获得更好的远期疗效。在临床实际工作中,对于多次检查发现术前LVMI明显升高的重度AI患者,虽然早期药物控制有效,仍然要尽快手术。希望更多的心脏中心建立长期随访机制,发现以LVMI指标为依据的手术适应证,提高AVR术后患者远期生存率。
本研究有一定的局限性,需要进一步随访组内患者远期生存率和LVMI指数变化趋势。国外相关的前瞻性研究也存在争议。跟踪研究对象,获得长期患者转归病例资料,能更好地认识此类问题。本研究是单中心的回顾性研究,研究资料受限,如果有多个不同地域心脏中心参与将更有代表意义。
| [1] |
LUND O, EMMERTSEN K, DØRUP I, et al. Regression of left ventricular hypertrophy during 10 years after valve replacement for aortic stenosis is related to the preoperative risk profile[J]. Eur Heart J, 2003, 24(15): 1437-1446. DOI:10.1016/s0195-668x(03)00316-6 |
| [2] |
TANIGUCHI K, TAKAHASHI T, TODA K, et al. Left ventricular mass: impact on left ventricular contractile function and its reversibility in patients undergoing aortic valve replacement[J]. Eur J Cardiothorac Surg, 2007, 32(4): 588-595. DOI:10.1016/j.ejcts.2007.07.003 |
| [3] |
TOYA T, FUKUSHIMA S, SHIMAHARA Y, et al. Reverse left ventricular remodelling after aortic valve replacement for severe aortic insufficiency[J]. Interact CardioVasc Thorac Surg, 2021, 32(6): 846-854. DOI:10.1093/icvts/ivab020 |
| [4] |
VOLLEMA EM, SINGH GK, PRIHADI EA, et al. Time course of left ventricular remodelling and mechanics after aortic valve surgery: aortic stenosis vs. aortic regurgitation[J]. Eur Heart J Cardiovasc Ima-ging, 2019, 20(10): 1105-1111. DOI:10.1093/ehjci/jez049 |
| [5] |
FUSTER RG, ARGUDO JA, ALBAROVA OG, et al. Left ventricular mass index in aortic valve surgery: a new index for early valve replacement?[J]. Eur J Cardiothorac Surg, 2003, 23(5): 696-702. DOI:10.1016/s1010-7940(03)00092-7 |
| [6] |
CHEN JS, HUANG JH, CHIU KM, et al. Extent of left ventricular mass regression and impact of global left ventricular afterload on cardiac events and mortality after aortic valve replacement[J]. J Clin Med, 2022, 11(24): 7482. DOI:10.3390/jcm11247482 |
| [7] |
NISHIMURA RA, OTTO CM, BONOW RO, et al. 2017 AHA/ACC focused update of the 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American college of cardiology/American heart association task force on clinical practice guidelines[J]. Circulation, 2017, 135(25): e1159-e1195. DOI:10.1161/cir.0000000000000503 |
| [8] |
XU Y, J IN, MD P, et al. Medium-term determinants of left ventricular mass index after stentless aortic valve replacement[J]. Ann Thorac Surg, 1999, 67(2): 411-416. DOI:10.1016/S0003-4975(98)01134-5 |
| [9] |
ORSINELL DA, AURIGEMMA GP, BATTISTA S, et al. Left ventricular hypertrophy and mortality after aortic valve replacement for aortic stenosis[J]. J Am Coll Cardiol, 1993, 22(6): 1679-1683. DOI:10.1016/0735-1097(93)90595-r |
| [10] |
HILDO J, LAMB, PHD, et al. Left ventricular remodeling early after aortic valve replacement: differential effects on diastolic function in aortic valve stenosis and aortic regurgitation[J]. J Am Coll Cardiol, 2002, 40(12): 2182-2188. DOI:10.1016/S0735-1097(02)02604-9 |
| [11] |
SAISHO H, ARINAGA K, KIKUSAKI S, et al. Long term results and predictors of left ventricular function recovery after aortic valve replacement for chronic aortic regurgitation[J]. Ann Thorac Cardiovasc Surg, 2015, 21(4): 388-395. DOI:10.5761/atcs.oa.14-00295 |
| [12] |
NATSUAKI M, ITOH T, OKAZAKI Y, et al. Evaluation of postope-rative cardiac function and long-term results in patients after aortic valve replacement for aortic valve disease with increased left ventricular mass[J]. Jpn J Thorac Caridovasc Surg, 2000, 48(1): 30-38. DOI:10.1007/BF03218082 |
| [13] |
LINARES VICENTE JA, LACAMBRA BLASCO I, PORTERO PEREZ P, et al. Sustained benefit of left ventricular remodelling after valve replacement for aortic stenosis[J]. Cardiol J, 2009, 16(1): 68-72. |
| [14] |
GAUDINO M, ALESSANDRINI F, GLIECA F, et al. Survival after aortic valve replacement for aortic stenosis: does left ventricular mass regression have a clinical correlate?[J]. Eur Heart J, 2005, 26(1): 51-57. DOI:10.1093/eurheartj/ehi012 |
| [15] |
LUND O, ERLANDSEN M, DØRUP I, et al. Predictable changes in left ventricular mass and function during ten years after valve replacement for aortic stenosis[J]. J Heart Valve Dis, 2004, 13(3): 357-368. |
| [16] |
MEHTA RH, BRUCKMAN D, DAS S, et al. Implications of increased left ventricular mass index on in-hospital outcomes in patients undergoing aortic valve surgery[J]. J Thorac Cardiovasc Surg, 2001, 122(5): 919-928. DOI:10.1067/mtc.2001.116558 |
 2023, Vol. 52
2023, Vol. 52