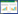文章信息
- 凌永嫦, 李妹燕, 仇雯丽, 廖陆生, 董明右, 王俊利
- LING Yongchang, LI Meiyan, QIU Wenli, LIAO Lusheng, DONG Mingyou, WANG Junli
- 丝氨酸/苏氨酸蛋白激酶11在泛癌的发生和预后中的作用及免疫分析
- Role and immunoassay of serine/threonine kinase 11 in the pathogenesis and prognosis of pan-cancer
- 中国医科大学学报, 2023, 52(6): 512-519
- Journal of China Medical University, 2023, 52(6): 512-519
-
文章历史
- 收稿日期:2021-12-30
- 网络出版时间:2023-05-25 17:20:52
2. 右江民族医学院检验学院,广西 百色 533000
2. School of Laboratory Science, Youjiang Medical University for Nationalities, Baise 533000, China
世界卫生组织2018年报告全球新发肿瘤约180万例,死亡约950万例,目前对于绝大部分肿瘤没有特效的治疗方法,肿瘤严重影响着人们的生活[1]。肿瘤免疫在肿瘤的发生发展和预后中起着关键作用。近年来免疫疗法在肿瘤治疗中逐渐开展,尤其是免疫检查点阻断疗法[2]。
丝氨酸/苏氨酸蛋白激酶11 (serine-threonine kinase 11,STK11) 也称为肝激酶B1 (liver kinase B1,LKB1),位于人类染色体19p13.3区域,在调节细胞生长、存活和代谢中起重要作用[3]。STK11缺失与结直肠癌患者的不良预后密切相关[4]。树突状细胞中STK11缺失可通过诱导肿瘤中调节性T细胞增加,促进肿瘤的生长[5]。STK11在肝癌中过表达且与不良预后显著相关[6],可影响大多数恶性肿瘤患者的预后。
迄今为止,有关STK11在肿瘤中的研究仅限于特定类型的肿瘤。尚无关于STK11与各种肿瘤之间关联的泛癌研究。随着公共数据库的不断发展和完善,可对基因进行泛癌表达分析并评估其与临床预后及免疫的相关性[7]。因此,本研究利用数据库分析STK11表达与各种肿瘤发生、预后及免疫的关系。
1 材料与方法 1.1 信息获取各种肿瘤和正常组织的基因表达水平和临床信息数据来自GTEx数据库(https://gtexportal.org/) 和TCGA数据库(https://portal.gdc.cancer.gov/)。其中,31种癌症纳入GTEx基因表达分析,27种癌症纳入GTEx整合分析。每个肿瘤细胞系的表达数据取自CCLE数据库(https://portals.broadinstitute.org/)。本研究采用ESTIMATE算法计算每个肿瘤样品的免疫评分、基质评分和综合评分。TIMER数据库下载33种癌症的6种免疫浸润细胞的得分数据。
1.2 STK11在泛癌中的表达通过R软件包“edge”分析正常组织和肿瘤组织中STK11表达水平的差异。Kruskal Wallis检验用于分析STK11在不同正常组织和不同肿瘤细胞系中的表达水平。采用R软件包“ggplot”绘图。
1.3 STK11表达与肿瘤患者预后之间的关系采用单变量生存分析方法分析STK11表达与患者生存率的相关性,Kaplan-Meier方法和对数秩检验方法用于比较不同STK11表达水平的存活率。采用二分法将STK11在肿瘤及邻近非癌组织中的表达水平分为STK11高表达组和低表达组。通过R软件包“ survival”和“ survminer”进行单变量Cox回归分析,并绘制生存曲线。
1.4 STK11表达与免疫评分、基质评分和综合评分及免疫浸润的关系采用ESTIMATE算法计算每个肿瘤样品的免疫评分、基质评分和综合评分,并使用R软件包“estimate”和“ limma”根据免疫浸润程度评估STK11表达与以上3种评分之间的关系。此外,本研究从TIMER数据库下载了33种肿瘤的6种免疫浸润细胞的得分数据,采用R软件包评估STK11表达与每种免疫细胞浸润水平之间的相关性。
1.5 统计学分析采用R软件(版本4.0.2) 对数据进行统计分析,组间比较采用t检验,生存分析采用Kaplan-Meier法、log-rank检验和Cox比例风险回归模型,2个变量之间的相关性分析采用Spearman检验或Pearson检验,P < 0.05为差异有统计学意义。
2 结果 2.1 STK11在正常组织和肿瘤之间的差异表达GTEx数据库分析结果显示,STK11基因在大多数正常组织中过表达,其中睾丸组织中的表达水平最高(图 1A)。CCLE数据库中21种不同正常组织的分析结果显示,STK11在大多数正常细胞中高表达(P < 0.001) (图 1B),与GTEx数据的分析结果一致。各种肿瘤组织与邻近非癌组织中STK11差异表达分析结果显示,STK11在绝大多数肿瘤中表达上调,其中在胆管癌(cholangiocarcinoma,CHOL) 和肝细胞癌(liver hepatocellular carcinoma,LIHC) 的表达为极显著上调(P < 0.001);但在肺腺癌(lung adenocarcinoma,LUAD)、肾嫌色细胞癌(kidney chromophobe,KICH)、肾透明细胞癌(kidney renal clear cell carcinoma,KIRC)、胰腺癌(pancreatic adenocarcinoma,PAAD) 和子宫内膜癌(uterine corpus endometrial carcinoma,UCEC) 中表达呈下调(P < 0.01),见图 1C。考虑到TCGA中部分肿瘤样品缺失癌旁样品,本研究整合GTEx数据库中正常组织的数据和TCGA肿瘤组织的数据,进行了STK11在27个肿瘤中的表达差异分析;结果显示,在22种类型的肿瘤和正常组织之间检测到STK11的显著差异表达,STK11在CHOL、头颈部鳞状细胞癌(headand neck squamous cell carcinoma,HNSC)、KICH、肺鳞状细胞癌(lung squamous cell carcinoma,LUSC)、PAAD和直肠腺癌(rectum adenocarcinoma,READ) 中的表达显著上调,而在宫颈癌(cervical and endocervical cancer,CESC)、子宫肉瘤(uterine carcinosarcoma,UCS)、READ、食管癌(esophageal carcinoma,ESCA) 和肺腺癌(lung adenocarcinoma,LUAD) 等16种肿瘤中STK11表达明显低于正常组织,见图 1D。
|
| A, expression of STK11 in normal tissues; B, expression of STK11 in tumor cell lines; C, differential expression of STK11 in cancer and normal; D, differential expression of STK11 in cancer and normal samples (plus GTEx sample data). * P < 0.05, ** P < 0.01, *** P < 0.001. N, normal; T, tumor. 图 1 STK11在肿瘤组织和正常组织中的表达 Fig.1 Differential expression of STK11 |
2.2 STK11在各种肿瘤中的预后价值
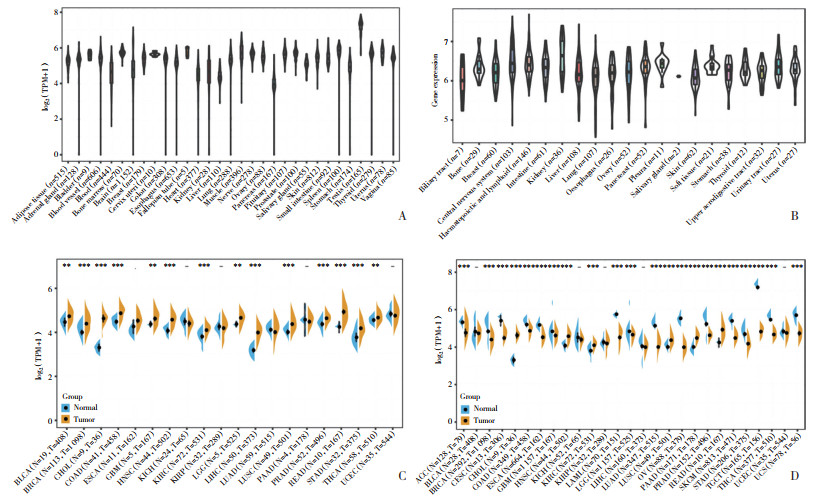
对33种肿瘤中STK11表达水平与预后结局进行关联分析。结果显示,STK11表达水平与肾上腺皮质瘤(adrenocortical carcinoma,ACC)、HNSC、急性粒细胞白血病(acute myeloid leukemia,LAML)、低级别脑胶质瘤(brain lower grade glioma,LGG)、LIHC、肉瘤(sarcoma,SARC) 和UCEC等7种肿瘤类型的总生存期(overall survival,OS) 相关(P < 0.05),见表 1。其中,STK11在ACC、LAML、LGG、LIHC和SARC中属于高风险基因(HR > 1),而在HNSC (HR=0.97) 和UCEC (HR=0.98) 中属于低风险基因。Kaplan-Meier生存分析结果显示,在HNSC和UCEC中STK11表达水平高的患者OS更长;而在ACC、LAML、LGG和LIHC患者中,STK11高表达患者OS更短,见图 2。
| Tumor | HR (95%CI) | P |
| ACC | 1.03(1.00-1.05) | 0.020 |
| BLCA | 0.99(0.97-1.00) | 0.078 |
| BRCA | 0.99(0.98-1.01) | 0.410 |
| CESC | 1.00(0.97-1.02) | 0.780 |
| CHOL | 0.98(0.92-1.03) | 0.400 |
| COAD | 1.01(0.99-1.02) | 0.460 |
| DLBC | 0.95(0.86-1.06) | 0.360 |
| ESCA | 0.97(0.94-1.00) | 0.074 |
| GBM | 1.00(0.98-1.02) | 0.870 |
| HNSC | 0.97(0.96-0.99) | 0.003 |
| KICH | 1.01(0.92-1.12) | 0.780 |
| KIRC | 1.00(0.97-1.04) | 0.810 |
| KIRP | 1.02(0.98-1.06) | 0.390 |
| LAML | 1.02(1.00-1.04) | 0.045 |
| LGG | 1.04(1.02-1.06) | < 0.001 |
| LIHC | 1.03(1.00-1.06) | 0.025 |
| LUAD | 1.01(0.99-1.02) | 0.400 |
| LUSC | 1.00(0.99-1.02) | 0.850 |
| MESO | 1.01(0.98-1.04) | 0.530 |
| OV | 1.01(0.99-1.04) | 0.210 |
| PAAD | 0.97(0.95-1.00) | 0.055 |
| PCPG | 1.05(0.95-1.17) | 0.380 |
| PRAD | 1.04(0.96-1.13) | 0.290 |
| READ | 0.97(0.94-1.01) | 0.180 |
| SARC | 1.01(1.00-1.01) | < 0.001 |
| SKCM | 1.00(0.98-1.01) | 0.690 |
| STAD | 0.99(0.97-1.01) | 0.210 |
| TGCT | 0.94(0.84-1.06) | 0.320 |
| THCA | 0.99(0.93-1.06) | 0.880 |
| THYM | 0.95(0.88-1.03) | 0.200 |
| UCEC | 0.98(0.96-1.00) | 0.022 |
| UCS | 1.00(0.95-1.04) | 0.870 |
| UVM | 1.01(0.95-1.07) | 0.840 |
|
| A, ACC; B, HNSC; C, LAML; D, LGG; E, LIHC; F, SARC; G, UCEC. 图 2 STK11表达与7种肿瘤OS的关系 Fig.2 Kaplan-Meier analysis of the association between STK11 expression and OS of 7 types of tumors |
2.3 STK11表达与免疫评分、基质评分和综合评分的关系
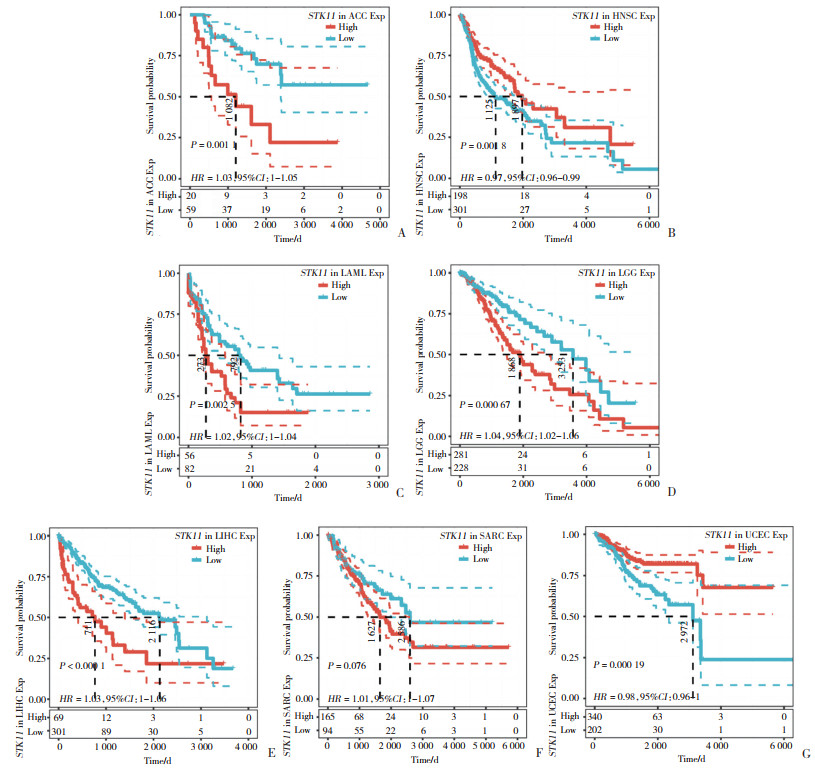
采用R包Estimate分析单个肿瘤样本的免疫评分、基质评分和综合评分,33种肿瘤中STK11表达与免疫评分相关性最显著的前3个肿瘤为多形胶质母细胞瘤(glioblastoma multiforme,GBM) (r = -0.358,P < 0.001)、LUSC (r = -0.208,P < 0.001) 和SARC (r = -0.261,P < 0.001),STK11表达与基质评分最显著相关的前3个肿瘤是ACC (r = -0.429,P < 0.001)、甲状腺癌(thyroid carcinoma,THCA) (r = -0.153,P < 0.001) 和GBM (r = -0.358,P < 0.001),STK11表达与综合评分最显著相关为ACC (r = -0.429,P < 0.001)、LUSC (r = -0.208,P < 0.001) 和GBM (r = -0.358,P < 0.001)。这些结果表明,6种肿瘤中STK11表达与这3种评分均呈显著负相关,见图 3。
|
| A, the three tumors with the highest correlation with STK11 expression; B, the three tumors with the highest correlation between STK11 expression and stromal score; C, the three tumors with the highest correlation between STK11 expression and ESTIMATE score. 图 3 STK11表达与免疫评分、基质评分和综合评分相关性最高的3种肿瘤 Fig.3 STK11 expression in the three tumors with the highest correlation between immune score, matrix score, and ESTIMATE score |
2.4 STK11表达水平与免疫浸润水平的关系
本研究分析33种肿瘤中STK11表达与6种免疫细胞得分的相关性,结果显示,STK11表达水平在7种肿瘤中与B细胞得分呈正相关,18种肿瘤中与CD4+T细胞得分呈正相关,4种肿瘤中与CD8+T细胞得分呈正相关,6种肿瘤中与中性粒细胞和巨噬细胞得分呈正相关,7种肿瘤中与树突状细胞得分呈正相关。此外,STK11表达水平在16种肿瘤中与CD8+T细胞得分呈负相关,6种肿瘤中与中性粒细胞得分呈负相关,11种肿瘤中与巨噬细胞得分呈负相关,3种肿瘤中与树突状细胞得分呈负相关(表 2)。在最显著相关的3种肿瘤中,LIHC和LUAD的STK11表达水平与B细胞、CD4+T细胞、中性粒细胞、树突状细胞和巨噬细胞得分均呈显著正相关;而在COAD患者中,STK11表达水平与B细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞得分均呈显著负相关,与CD4+T细胞呈正相关(图 4)。
| Tumor | B-cell (P/r) | CD4+T cell (P/r) | CD8+T cell (P/r) | Timer-neutrophil (P/r) | Timer-macrophage (P/r) | Dendritic (P/r) |
| ACC | 0.13 | -0.11 | -0.36** | -0.12 | -0.23* | -0.03 |
| BLCA | 0.14** | 0.03 | -0.12* | -0.03 | -0.07 | -0.06 |
| BRCA | -0.06 | 0.19*** | -0.19*** | -0.03 | -0.10** | < 0.001 |
| COAD | 0.13** | 0.11* | -0.40*** | -0.20*** | -0.25*** | -0.15** |
| CESC | 0.14* | 0.11** | -0.05 | -0.01 | 0.01 | 0.04 |
| HNSC | 0.09* | 0.10* | 0.10* | 0.10* | 0.07 | 0.06 |
| KICH | 0.01 | -0.09 | -0.29* | -0.07 | -0.28* | 0.01 |
| KIRC | 0.08 | 0.45*** | 0.13** | 0.24*** | 0.08 | 0.18*** |
| KIRP | 0.01 | 0.33*** | -0.01 | 0.28*** | -0.07 | 0.22*** |
| LGG | -0.06 | 0.12** | -0.33*** | -0.04 | 0.01 | 0.02 |
| LIHC | 0.20*** | 0.32*** | 0.05 | 0.19*** | 0.21*** | 0.18*** |
| LUAD | 0.06*** | 0.49*** | -0.10* | 0.17*** | 0.13** | 0.26*** |
| LUSC | -0.06 | 0.25*** | -0.25*** | -0.11* | -0.13** | -0.09 |
| MESO | -0.09 | 0.20 | -0.34** | -0.23* | -0.22* | 0.07 |
| OV | 0.07 | 0.16** | 0.01 | 0.12* | 0.15** | 0.17** |
| ESCA | -0.07 | -0.05 | -0.23** | -0.30*** | -0.17* | -0.03 |
| PAAD | -0.08 | 0.30*** | -0.25*** | -0.10 | -0.13 | -0.12 |
| PCPG | 0.16* | 0.18* | 0.07 | 0.07 | 0.26*** | 0.32*** |
| PRAD | -0.05 | 0.08 | -0.23*** | 0.01 | -0.06 | 0.10* |
| READ | -0.04 | 0.18* | 0.47*** | -0.39*** | -0.28*** | -0.11 |
| SARC | -0.12 | -0.04 | -0.27*** | -0.06 | -0.19** | -0.23*** |
| SKCM | -0.09 | 0.16*** | -0.14*** | 0.03 | 0.11* | -0.09 |
| STAD | 0.06 | 0.17** | 0.11* | -0.14* | -0.13** | -0.08 |
| TGCT | 0.04 | 0.19* | -0.06 | -0.05 | 0.21** | 0.11 |
| THCA | 0.04 | 0.13** | -0.18*** | -0.07 | -0.11* | -0.10* |
| THYM | -0.13 | -0.09 | -0.21* | -0.02 | 0.03 | -0.07 |
| * P < 0.05,** P < 0.01,*** P < 0.001. | ||||||
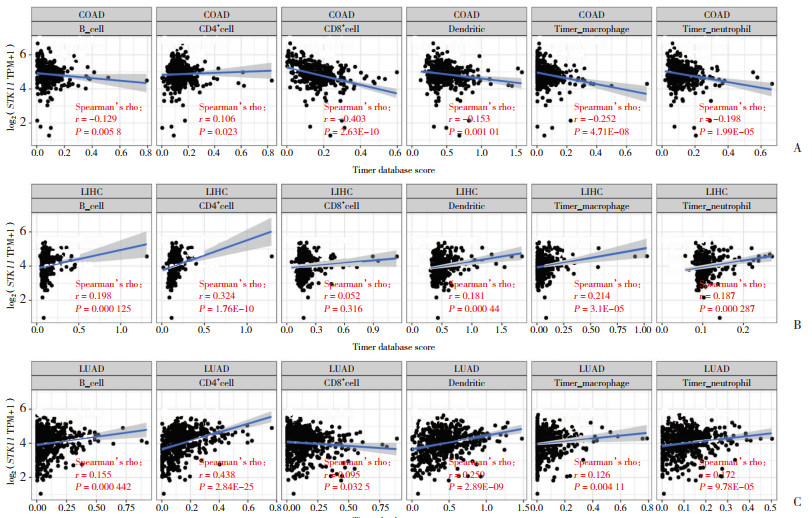
|
| A, correlation analysis between STK11 expression and tumor immune infiltration in COAD; B, correlation analysis between STK11 expression and tumor immune infiltration in LIHC; C, correlation analysis between STK11 expression and tumor immune infiltration in LUAD. 图 4 COAD、LIHC和LUAD中STK11表达与免疫细胞浸润的相关性 Fig.4 Correlation analysis between STK11 expression and tumor immune infiltration in COAD, LIHC, and LUAD |
3 讨论
通过TCGA数据库研究STK11在各种癌和癌旁组织中的表达情况,结果显示,STK11基因在胆管癌、肝癌等14种肿瘤中高表达。BARBIER-TORRES等[8]研究表明STK11在肝癌中过表达并致癌,预后较差的患者中STK11水平进一步升高。然而,HUANG等[9]发现肝癌患者中STK11表达下降。这与本研究结果不一致,可能与肿瘤类型、分级、分期或者不同的种族遗传背景有关,也可能是因为STK11虽然被确定为肿瘤抑制因子,但也可能表现出促癌功能[6]。此外,在转移性乳腺癌细胞系中,STK11蛋白水平降低,并促进了乳腺癌的转移和侵袭;STK11表达水平在乳腺癌的不同阶段之间差异很大,并且可能与肿瘤转移和患者预后相关[10]。本研究为STK11作为泛癌预后标志物的应用提供了见解,有助于未来机制研究的潜在发展。
Kaplan-Meier生存分析结果显示,STK11高表达与肾上腺皮质癌和脑低级别胶质瘤患者的不良预后有关。同样,STK11高表达与肝癌不良预后相关,提示STK11可能是肝癌潜在的预后生物标志物[9]。相反,在患有胰腺癌、胸腺癌和子宫内膜癌的患者中,STK11高表达与良好的预后相关。据报道[11],胰腺导管腺癌患者中STK11表达降低,且与患者的不良生存有关。总之,STK11可能作为多种肿瘤预后的生物标志物。
免疫微环境作为评估肿瘤细胞对免疫疗法反应的标志物,影响临床结果,STK11在肿瘤免疫中起着至关重要的作用[12-13]。浸润的肿瘤免疫细胞对肿瘤的发生和发展有重要影响,并且可以拮抗或促进肿瘤的发生和发展[14]。前期研究[15]已表明肿瘤抑制基因STK11的失活除了对细胞周期、代谢、分化、极性和其他细胞途径的影响外,还会导致肿瘤微环境的显著变化。肺癌患者中,STK11缺乏可以促进免疫抑制微环境,并可能参与抗pd-1/抗pd-L1的初级抗药[16]。同时,发生STK11突变的肺腺癌患者,免疫细胞浸润减少,接受免疫检查点抑制剂的患者预后更差[17]。本研究结果显示,在33种肿瘤中,有6种肿瘤的STK11表达水平与免疫评分、基质评分和细胞浸润评分均呈显著负相关。其中,在肝细胞癌与肺腺癌患者中,STK11表达水平与B细胞、CD4+T细胞、中性粒细胞、树突状细胞及巨噬细胞的正相关性极为显著。TIMER数据库结果显示STK11具有参与多种肿瘤,尤其是肝细胞癌和肺腺癌的免疫调节。
综上所述,本研究对STK11在各种恶性肿瘤的分析结果显示,STK11基因在肿瘤和正常组织之间存在差异表达,且STK11表达与肿瘤预后相关。此外,STK11可能作为许多肿瘤的预后生物标志物,对于不同的肿瘤,其表达水平的高低将带来不同的预后结果,需进一步研究STK11在每种肿瘤中的具体作用。此外,STK11表达与肿瘤微环境及免疫细胞浸润之间存在相关性。其对肿瘤免疫力的影响也随肿瘤类型而变化。这些发现可能有助于阐明STK11在肿瘤发生和发展中的作用,并可能为恶性肿瘤提供一些基于免疫的抗肿瘤治疗策略,从而实现更精确和个性化的免疫治疗。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA A Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
ROBERT C. A decade of immune-checkpoint inhibitors in cancer therapy[J]. Nat Commun, 2020, 11(1): 3801. DOI:10.1038/s41467-020-17670-y |
| [3] |
HEMMINKI A, MARKIE D, TOMLINSON I, et al. A serine/threonine kinase gene defective in Peutz-Jeghers syndrome[J]. Nature, 1998, 391(6663): 184-187. DOI:10.1038/34432 |
| [4] |
HE TY, TSAI LH, HUANG CC, et al. LKB1 loss at transcriptional level promotes tumor malignancy and poor patient outcomes in colorectal cancer[J]. Ann Surg Oncol, 2014, 21(4): 703-710. DOI:10.1245/s10434-014-3824-1 |
| [5] |
WANG YY, DU XR, WEI J, et al. LKB1 orchestrates dendritic cell metabolic quiescence and anti-tumor immunity[J]. Cell Res, 2019, 29(5): 391-405. DOI:10.1038/s41422-019-0157-4 |
| [6] |
LEE SW, LI CF, JIN GX, et al. Skp2-dependent ubiquitination and activation of LKB1 is essential for cancer cell survival under energy stress[J]. Mol Cell, 2015, 57(6): 1022-1033. DOI:10.1016/j.molcel.2015.01.015 |
| [7] |
王印祥. 泛肿瘤研究和肿瘤免疫研究: 未来抗肿瘤药的发展趋势[J]. 中国药物化学杂志, 2015, 25(2): 149-152. DOI:10.14142/j.cnki.cn21-1313/r.2015.02.014 |
| [8] |
BARBIER-TORRES L, DELGADO TC, GARCÍA-RODRÍGUEZ JL, et al. Stabilization of LKB1 and Akt by neddylation regulates energy metabolism in liver cancer[J]. Oncotarget, 2015, 6(4): 2509-2523. DOI:10.18632/oncotarget.3191 |
| [9] |
HUANG YH, CHEN ZK, HUANG KT, et al. Decreased expression of LKB1 correlates with poor prognosis in hepatocellular carcinoma patients undergoing hepatectomy[J]. Asian Pac J Cancer Prev, 2013, 14(3): 1985-1988. DOI:10.7314/apjcp.2013.14.3.1985 |
| [10] |
LI J, LIU J, LI PP, et al. Loss of LKB1 disrupts breast epithelial cell polarity and promotes breast cancer metastasis and invasion[J]. J Exp Clin Cancer Res, 2014, 33(1): 70. DOI:10.1186/s13046-014-0070-0 |
| [11] |
YANG JY, JIANG SH, LIU DJ, et al. Decreased LKB1 predicts poor prognosis in pancreatic ductal adenocarcinoma[J]. Sci Rep, 2015, 5: 10575. DOI:10.1038/srep10575 |
| [12] |
BAGHBAN R, ROSHANGAR L, JAHANBAN-ESFAHLAN R, et al. Tumor microenvironment complexity and therapeutic implications at a glance[J]. Cell Commun Signal, 2020, 18(1): 59. DOI:10.1186/s12964-020-0530-4 |
| [13] |
WU T, DAI Y. Tumor microenvironment and therapeutic response[J]. Cancer Lett, 2017, 387: 61-68. DOI:10.1016/j.canlet.2016.01.043 |
| [14] |
LEI X, LEI Y, LI JY, et al. Immune cells within the tumor microenvironment: biological functions and roles in cancer immunotherapy[J]. Cancer Lett, 2020, 470: 126-133. DOI:10.1016/j.canlet.2019.11.009 |
| [15] |
SKOULIDIS F, BYERS LA, DIAO LX, et al. Co-occurring genomic alterations define major subsets of KRAS-mutant lung adenocarcinoma with distinct biology, immune profiles, and therapeutic vulnerabilities[J]. Cancer Discov, 2015, 5(8): 860-877. DOI:10.1158/2159-8290.CD-14-1236 |
| [16] |
BONANNO L, ZULATO E, PAVAN A, et al. LKB1 and tumor metabolism: the interplay of immune and angiogenic microenvironment in lung cancer[J]. Int J Mol Sci, 2019, 20(8): 1874. DOI:10.3390/ijms20081874 |
| [17] |
WANG HY, GUO J, SHANG XL, et al. Less immune cell infiltration and worse prognosis after immunotherapy for patients with lung adenocarcinoma who harbored STK11 mutation[J]. Int Immunopharmacol, 2020, 84: 106574. DOI:10.1016/j.intimp.2020.106574 |
 2023, Vol. 52
2023, Vol. 52