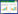文章信息
- 董奇, 路磊, 方斌
- 全椎板减压治疗伴炎性肉芽组织形成的长节段胸椎硬膜外脓肿1例报道
- Total laminar decompression for a long-segment thoracic epidural abscess with inflammatory granulation tissue formation: a case report
- 中国医科大学学报, 2023, 52(5): 473-477
- Journal of China Medical University, 2023, 52(5): 473-477
-
文章历史
- 收稿日期:2022-10-13
- 网络出版时间:2023-05-19 13:47:55
脊髓硬膜外脓肿(spinal epidural abscess,SEA) 是一种罕见的疾病,发病率为0.002%~0.02%[1]。SEA可由血行播散、局部感染蔓延和医源性损伤等引起[2]。约4%~22%的患者发生不可逆的截瘫,出现神经功能症状时,需要紧急手术治疗[3-4]。SEA容易被误诊为椎管内血肿、腰椎间盘突出症,因此早期诊断与及时治疗至关重要。当SEA中含有大量炎性肉芽组织时,炎性肉芽组织可黏附在脊髓硬脊膜表面并压迫脊髓,同时,炎性肉芽组织形成是SEA复发的高风险因素,需要彻底清除[5]。2014年我院收治了1例伴肉芽组织形成的长节段SEA病例,行多节段椎板(T1~L1) 切除术清除脓肿及炎性肉芽组织,成功解除脊髓压迫,术后随访6年,患者脊柱稳定性好。现报道如下:
1 临床资料患者,女,45岁,2014年11月8日因“腰痛加重、双下肢无力6 h”入院。入院时伴有恶心、呕吐。入院2 d前曾有腰部扭伤。查体:神志清,精神差,痛苦貌,腹软,左腹部压痛阳性,肠鸣音2次/min,下腰椎有压痛、叩击痛,双侧下肢Lasègue征阳性,感觉正常。双侧股四头肌肌力4/5级(左/右),双侧胫骨前肌肌力5/5级(左/右)。跟肌腱反射正常,ASIA评分等级为E。实验室检查:白细胞17.4×109/L,中性粒细胞15.3×109/L,中性粒细胞百分比88%,红细胞沉降率12 mm/h,C反应蛋白23 mg/L。急诊脊柱正侧位X线显示肠管部分积气。腰椎CT检查显示,L5/S1椎间盘轻度膨出。腰椎磁共振成像(magnetic resonance imaging,MRI) 未见明显异常(图 1A)。
|
| A,腰椎MRI未见明显异常;B,胸椎MRI显示T1~12胸椎节段有积液,矢状面T1和T2加权像周围有分隔状的增强信号(黄色箭头);C,T6和T10水平轴向显像显示脊髓被脓液压迫(红色箭头). 图 1 术前腰胸椎MRI |
入院第3天,患者出现低热(37.8 ℃),伴进行性神经功能障碍,查体:双侧胫骨前肌肌力1/4级(左/右),股四头肌肌力1/3级(左/右),双侧腹股沟感觉减退,Asia评分等级为C。胸椎MRI显示,T1~12椎体水平之间的硬膜外间隙内有大面积的液体聚集,其周围有分隔状的增强信号(图 1B、1C),诊断为椎管内脓肿或血肿形成。
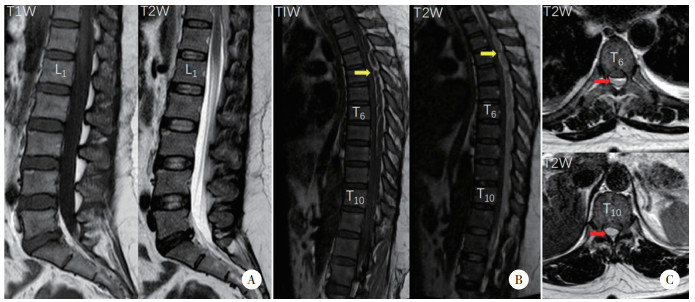
2014年11月11日急诊行T11~L1椎板切除术+椎管引流。术中见椎管内大量乳白色脓性液体(图 2A)。用注射器抽取脓性液体40 mL后,将最小直径的导尿管插入椎管,见胸椎内脓腔通畅,但脊髓未扩张,后发现硬脑膜表面有条带状炎性肉芽组织形成(图 2B),与硬脑膜粘连严重。因此,改行T1~L1椎板切除术,完全清除椎管后黏性脓液和炎性肉芽组织后,可见脊髓重新膨胀(图 2C)。放置负压闭式引流管,4 d后引流液 < 10 mL,拔管。术中脓液涂片显示革兰氏阳性菌感染,脓液细菌培养显示金黄色葡萄球菌感染。术后根据药物敏感试验结果(图 2D),给予静脉滴注头孢曲松(2 g/d) 和万古霉素(2g/d) 4周。
|
| A,T11椎板切除术后可见从椎管流出大量乳白色脓性液体(黄色箭头);B,在硬脑膜表面有厚而致密的炎性肉芽组织(黄色箭头);C,切除炎性肉芽组织后,脊髓重新膨胀;D,脓液药物敏感试验结果. 图 2 术中图像及药物敏感试验结果 |
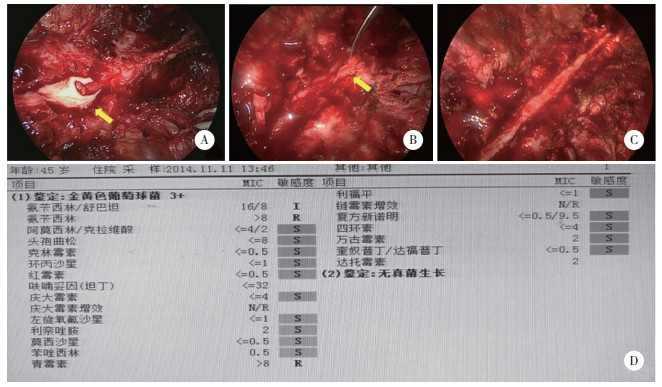
术后第1天,体格检查发现下肢感觉平面恢复到L1水平,左侧胫骨前肌、左侧股四头肌肌力为3/5级(左/右),ASIA评分等级为D。C反应蛋白和白细胞计数分别为130.5 mg/L和14.5×109/L。术后第2天,下肢肌力开始明显改善,C反应蛋白下降至84.2 mg/L,提示炎症减轻。术后第3天,胸椎MRI显示,椎管内脓肿完全清除,脊髓受压得到缓解(图 3)。
|
| A,T1W和T2W的矢状位(黄色箭头);B,T3/4和T9横断面(红色箭头). 图 3 术后胸椎MRI图像 |
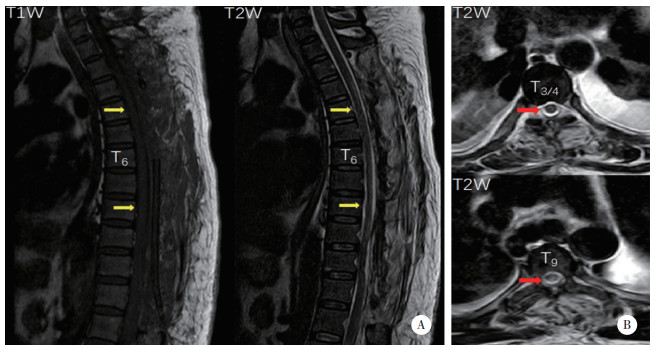
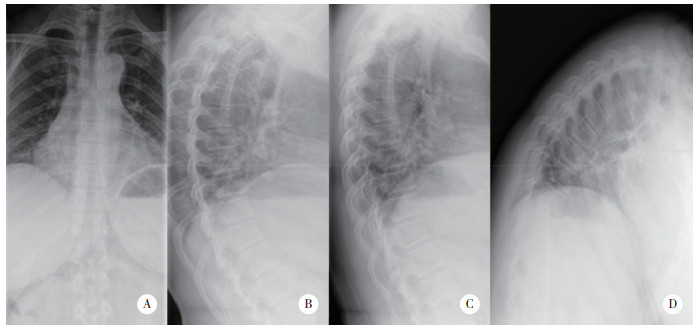
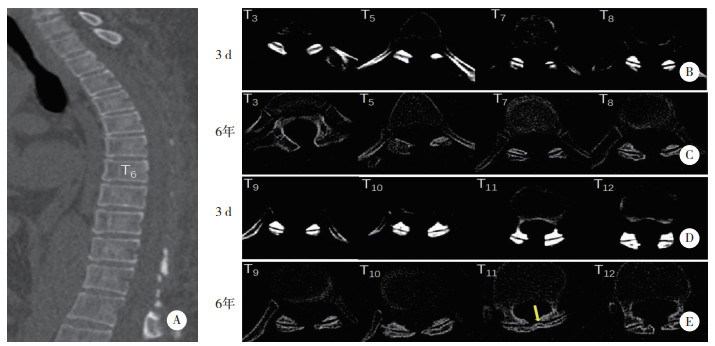
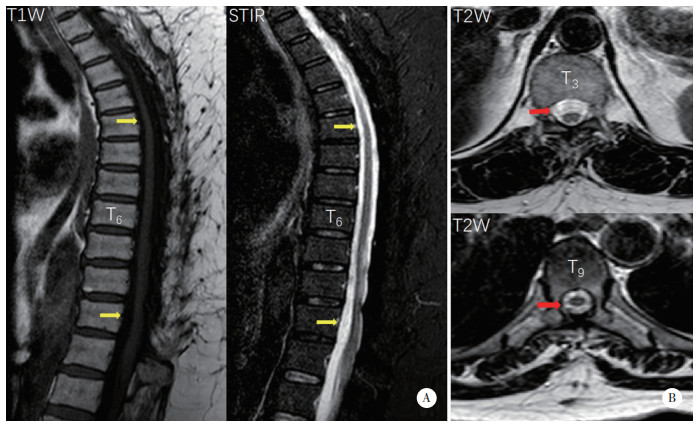
术后第12天,感觉平面恢复至L2水平,双下肢胫骨前肌、左侧股四头肌肌力为4/5级(左/右),双侧膝关节反射活跃,ASIA评分等级为D。术后第21天,患者肛周和会阴区域感觉恢复正常,可在家属的帮助下行走。术后6年复查,双侧下肢感觉无异常,左下肢肌力完全恢复,ASIA评分分级为E。胸椎X线未显示明显的胸椎后凸和不稳定(图 4)。胸椎CT显示,椎体序列正常,上胸椎小关节无明显增生,而下胸椎(T8~12) 小关节明显增生,但未导致椎管狭窄(图 5)。胸椎MRI显示脑脊液循环较6年前改善(图 6)。
|
| A,B,正侧位显示胸椎序列正常;C,D,过伸和屈曲图像未见胸椎不稳. 图 4 术后6年胸椎X线 |
|
| A,矢状面重建图像显示胸椎序列良好;B~E,胸椎横截面图像显示,与术后3 d CT比较,上胸椎(T1~7) 关节突关节无明显增生,下胸椎(T8~12) 关节突增生,尤其是T11 (箭头),但未见椎管狭窄. 图 5 术后6年胸椎三维CT重建图像 |
|
| A,T1W和T2W图像(黄色箭头);B,T3和T9横截面图像(红色箭头),显示脑脊液循环完全恢复. 图 6 术后6年MRI图像 |
2 讨论
SEA的危险在于脓肿压迫脊髓可导致神经功能永久丧失,术前及时准确的诊断非常重要[6]。SEA典型三联征为背痛、发热和神经功能缺损,因其症状特异性低,容易发生误诊[7]。SEA可分为无肉芽组织的脓肿和含肉芽组织的脓肿2种类型[8]。在SEA早期,有炎性肉芽组织伴微脓肿形成,其主要成分为中性粒细胞和纤维蛋白;晚期有少量的肉芽组织被脓液覆盖,其主要成分为细菌和坏死组织[9]。MRI-T2W影像可区分出硬膜外脓肿的各种成分:信号强度显著增强的区域对应脓肿的液体部分,信号强度略有增强的区域对应炎性肉芽组织。并非所有SEA都会形成大量的炎性肉芽组织,此时炎性肉芽组织与脓肿之间的区别也许只能在手术中见到[10]。MRI影像对炎性肉芽组织的鉴别有助于SEA的诊断,本病例MRI影像表现为典型的三联征,但是由于其起病时仅表现为双下肢症状,且发病前有扭伤病史,急诊处理时误认为是外伤后腰痛及应激反应,仅检查腰椎MRI,导致病情延误,直至神经症状进行性加重时,才急查胸椎MRI用于明确定位。MRI-T2W显示椎管内分隔状的增强信号,故最初怀疑为外伤后的椎管内硬膜外血肿形成,直至术中探查,才证实为局部炎性病变。因此,对于此类影像学表现,需高度怀疑被炎性肉芽组织分隔的脓肿形成。术后仔细回顾最初的腰椎MRI,可见T11椎体后缘存在异常占位(图 1A),再次提醒认真阅片对于临床诊治的重要性。
手术联合抗生素治疗仍是有神经症状的SEA的最佳治疗方法,目前多采用微创手术去除脓肿,从而减轻脊髓压迫[11]。如AHUJA等[12]采用间歇性胸椎椎板切除术治疗急性SEA,在T2和T10椎板切除后,将婴儿喂食管插入硬脊膜外抽吸脓液;LARA-REYNA等[13]通过椎板切除术将一种特制的解剖器插入腹侧的硬膜外间隙,成功救治了2例急性SEA (C5~6) 患者。上述手术方法虽然损伤较小,但手术空间有限,当广泛增厚以及粘连严重的固体肉芽组织占硬脊膜外脓肿的很大一部分时,难以通过灌洗而清除[8, 14]。有研究[5]报道,85.7%的再手术患者中,椎管内脓肿中含有肉芽组织,所以肉芽组织的彻底清除对于避免SEA复发至关重要。本病例术中吸取椎管内脓液后,黏附在硬脊膜表面的炎性肉芽组织仍对脊髓有压迫,唯有多椎板切除才能充分暴露并去除炎性肉芽组织。
值得注意的是,多节段胸椎板切除术可能会导致胸椎的稳定性和强度降低[15],因此,临床上通常对多段椎板切除术的患者使用内固定增加脊柱的稳定性,然而有研究[16-18]发现,单独T4~5或T8~9椎板切除术并不会降低上胸椎和下胸椎的稳定性,接受3个或3个以上水平椎板切除术和(或) 融合术的患者术后胸椎后凸率无显著差异,这可能是由于胸椎间盘、胸肋关节和小关节未受损,维持了胸椎的稳定性。本病例在术后6年随访中发现,有肋骨支撑的胸椎(T1~9) 和无肋骨支撑的胸腰椎(T10~L1) 均未出现后凸畸形(图 4~6),因此,完全保留脊柱小关节结构可能是确保椎板切除术后脊柱稳定性的关键。
总之,当MRI-T2W显示分隔状的增强信号时,临床医生应警惕大量炎性肉芽肿的形成。对于胸椎背侧伴有大量炎性肉芽肿的SEA,多节段椎板切除术是可行的选择,可能不需要融合以维持脊柱的稳定性。
| [1] |
WETHERINGTON B, KHAN TW. Epidural abscess during a spinal cord stimulator trial: a case report[J]. Pain Pract, 2019, 19(1): 57-60. DOI:10.1111/papr.12691 |
| [2] |
SCHWAB JH, SHAH AA. Spinal epidural abscess: diagnosis, management, and outcomes[J]. J Am Acad Orthop Surg, 2020, 28(21): e929-e938. DOI:10.5435/JAAOS-D-19-00685 |
| [3] |
AMEER MA, KNORR TL, MESFIN FB. Spinal epidural abscess[M]. Treasure Island (FL): StatPearls Publishing, 2022.
|
| [4] |
ROBERTI F. Tailored minimally invasive tubular laminectomies for the urgent treatment of rare holocord spinal epidural abscess: case report and review of technique[J]. J Spine Surg, 2020, 6(4): 729-735. DOI:10.21037/jss-20-603 |
| [5] |
LÖHR M, REITHMEIER T, ERNESTUS RI, et al. Spinal epidural abscess: prognostic factors and comparison of different surgical treatment strategies[J]. Acta Neurochir (Wien), 2005, 147(2): 159-166. DOI:10.1007/s00701-004-0414-1 |
| [6] |
JOHNSON KG. Spinal epidural abscess[J]. Crit Care Nurs Clin North Am, 2013, 25(3): 389-397. DOI:10.1016/j.ccell.2013.04.002 |
| [7] |
BHISE V, MEYER AND, SINGH H, et al. Errors in diagnosis of spinal epidural abscesses in the era of electronic health records[J]. Am J Med, 2017, 130(8): 975-981. DOI:10.1016/j.amjmed.2017.03.009 |
| [8] |
SUPPIAH S, MENG Y, FEHLINGS MG, et al. How best to manage the spinal epidural abscess? A current systematic review[J]. World Neurosurg, 2016, 93: 20-28. DOI:10.1016/j.wneu.2016.05.074 |
| [9] |
TETSUKA S, SUZUKI T, OGAWA T, et al. Spinal epidural abscess: a review highlighting early diagnosis and management[J]. JMA J, 2020, 3(1): 29-40. DOI:10.31662/jmaj.2019-0038 |
| [10] |
BOSTRÖM A, OERTEL M, RYANG Y, et al. Treatment strategies and outcome in patients with non-tuberculous spinal epidural abscess: a review of 46 cases[J]. Minim Invasive Neurosurg, 2008, 51(1): 36-42. DOI:10.1055/s-2007-1004547 |
| [11] |
KELLER LJ, ALENTADO VJ, TANENBAUM JE, et al. Assessment of postoperative outcomes in spinal epidural abscess following surgical decompression[J]. Spine J, 2019, 19(5): 888-895. DOI:10.1016/j.spinee.2018.12.006 |
| [12] |
AHUJA K, DAS L, JAIN A, et al. Spinal holocord epidural abscess evacuated with double thoracic interval laminectomy: a rare case report with literature review[J]. Spinal Cord Ser Cases, 2019, 5: 62. DOI:10.1038/s41394-019-0206-8 |
| [13] |
LARA-REYNA J, YAEGER KA, MARGETIS K. Transpedicular approach for ventral epidural abscess evacuation in the cervical spine[J]. World Neurosurg, 2021, 145: 127-133. DOI:10.1016/j.wneu.2020.09.062 |
| [14] |
KUNERT P, PROKOPIENKO M, NOWAK A, et al. Oblique corpectomy for treatment of cervical spine epidural abscesses: report on four cases[J]. Neurol Neurochir Pol, 2016, 50(6): 491-496. DOI:10.1016/j.pjnns.2016.08.001 |
| [15] |
TAI CL, HSIEH PH, CHEN WP, et al. Biomechanical comparison of lumbar spine instability between laminectomy and bilateral laminotomy for spinal stenosis syndrome - an experimental study in porcine model[J]. BMC Musculoskelet Disord, 2008, 9: 84. DOI:10.1186/1471-2474-9-84 |
| [16] |
HEALY AT, LUBELSKI D, MAGESWARAN P, et al. Biomechanical analysis of the upper thoracic spine after decompressive procedures[J]. Spine J, 2014, 14(6): 1010-1016. DOI:10.1016/j.spinee.2013.11.035 |
| [17] |
LUBELSKI D, HEALY AT, MAGESWARAN P, et al. Biomechanics of the lower thoracic spine after decompression and fusion: a cadaveric analysis[J]. Spine J, 2014, 14(9): 2216-2223. DOI:10.1016/j.spinee.2014.03.026 |
| [18] |
CHAKER AN, BHIMANI AD, ESFAHANI DR, et al. Epidural abscess: a propensity analysis of surgical treatment strategies[J]. Spine, 2018, 43(24): E1479-E1485. DOI:10.1097/BRS.0000000000002747 |
 2023, Vol. 52
2023, Vol. 52