文章信息
- 董晨, 王喆, 胡兆亮, 邢亚楠
- 胃癌Schnitzler转移至直肠1例报道并文献复习
- Schnitzler metastasis of gastric cancer to the rectum: a case report and literature review
- 中国医科大学学报, 2023, 52(5): 461-464
- Journal of China Medical University, 2023, 52(5): 461-464
-
文章历史
- 收稿日期:2023-01-14
- 网络出版时间:2023-05-19 13:26:39
2. 中国医科大学附属第一医院胃肠肿瘤外科,沈阳 110001
胃癌是目前全球癌症发病率和死亡率较高的恶性肿瘤[1]。原发性胃癌起源于胃黏膜,一般通过血行、淋巴系统或腹膜种植发生远处转移。近年来,胃低分化腺癌或印戒细胞癌的发病率不断升高[2-3],且具有侵袭性高、转移概率高、进展迅速、预后较差等特点[4-5]。胃低分化腺癌或印戒细胞癌确诊时发生远处转移的概率较高,但发生直肠转移的概率较低,临床症状隐匿难以发现,多为个案报道[6-8]。本文报道了1例以肠梗阻为首发表现的胃癌直肠转移患者,因结肠镜活检阴性,难以确定肿物性质,极易漏诊或误诊,影响治疗决策。同时,本文探讨了Schnitzler转移的影像学和病理学特点,以提高临床医生对以直肠梗阻为首发表现的胃癌远处转移这种少见情况的认识,为临床诊治提供思路。
1 临床资料患者,女,68岁,2020年9月以“停止排气、排便8 d”为主诉入我院。患者排便困难伴肛门坠胀感以及大便不成形1个月余,无便血。肠镜检查提示:直肠下段增厚、狭窄,镜身无法通过,病变表面黏膜粗糙,质地偏硬,易出血。病理结果提示:直肠黏膜炎症改变伴部分间质淋巴组织增生,免疫组织化学染色结果(图 1):Ki-67 (腺体约20%+,部分淋巴细胞聚集区域20%+~30%+),P53 (腺体约20%),CKpan (腺体+),CD3 (+),CD20 (+),Bcl-2 (+++)。全腹增强CT检查提示:直肠占位性病变,结肠多发扩张、积气,肠梗阻,腹膜后多发淋巴结。直肠MRI检查提示:直肠下段管壁增厚,增强扫描可见强化,浆膜面毛糙伴条索渗出影、液性渗出影,肠管扩张积液。查体:腹胀明显伴有压痛,无反跳痛。直肠指诊:患者胸膝位,入肛3 cm可触及近环周直肠肿物下缘,质硬,固定,肠腔狭窄无法触及肿物上缘,指套退出有血迹。实验室检查结果:糖类抗原199 (carbohydrate antigen 199,CA199) 240 U/mL,明显高于正常值(0.00~27.00),癌胚抗原、糖类抗原724 (carbohydrate antigen 724,CA724) 结果均正常。

|
| A,HE (×100);B,CD20 (×100);C,Bcl-2 (×100). 图 1 第1次肠镜活检病理结果 |
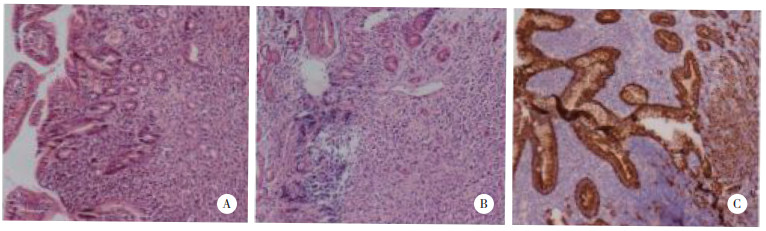
再次行肠镜活检,病理结果(图 2) 提示:间质水肿,较多炎症细胞浸润,可见淋巴滤泡形成,且间质内可见多灶少量可疑上皮细胞,仍未能证实恶性病变。由于肠镜病理难以确诊,多以炎症病变为主,结合CT和MRI (图 3) 影像学特征(同心圆样梗阻改变),怀疑存在其他原发病变,致直肠转移、腹壁多发转移。遂行胃镜活检,病理结果提示:胃低分化腺癌;免疫组化染色结果(图 4):Ki-67 (约50%+),CKpan (+)。第3次行肠镜活检,深度取材,病理结果提示:(直肠) 低分化腺癌;免疫组化染色结果(图 5):Ki-67 (约50%+),CDX2 (+)。

|
| A,HE (×100);B,HE (×400);C,CKpan (×200);C,p53 (×400). 图 2 第2次肠镜活检病理结果 |

|
| A,全腹增强CT示直肠病灶呈同心圆样梗阻;B,增强MRI示直肠呈同心圆样强化. 图 3 全腹增强CT和直肠增强MRI图像 |
|
| A,B,HE (×100);C,CKpan (×100). 图 4 胃镜活检病理结果 |

|
| A,HE (×100);B,CDX2 (×100);C,Ki-67 (×100). 图 5 第3次肠镜深度取材活检病理结果 |
患者肠梗阻症状进一步加重,不能进食伴呕吐,为缓解肠梗阻症状和解决饮食营养问题,行横结肠双腔造口术。考虑患者为疾病晚期,转入肿瘤内科进行化疗,给予奥沙利铂150 mg,卡培他滨1.5 g,2次/d,共14 d。
2 讨论Schnitzler转移到直肠是临床上比较罕见的现象,出现胃癌非典型表现的临床、内镜、病理以及放射学特征[8-9]。Schnitzler转移被认为是由于胃肠道黏膜下层低分化腺癌或印戒细胞腺癌中的肿瘤细胞,通过血行或淋巴管扩散而发生[10]。通常情况下,胃癌同时发生多种途径转移的概率较小,其中血源性转移最常见的转移部位是肝,其次是肺和胰腺[11],临床少见结直肠肠腔内的播散。
本例患者第1次和第2次肠镜活检病理结果表明,结直肠镜活检很难得到准确的结果,最终是在深度取材活检后才发现恶性细胞的证据,这与先前OLANO等[9]和RAUSEI等[12]关于Schnitzler转移的病例报道相似。因此,本例患者的临床表现高度怀疑Schnitzler转移。胃癌伴直肠Schnitzler转移结肠镜下活检的假阴性率高达50%以上,这可能与转移性胃低分化腺癌或印戒细胞癌的特殊生物学行为相关,如胃癌Schnitzler转移到直肠通常是黏膜下层受累而黏膜层得以保留,并且可能与肠壁内显著的纤维化反应和胃印戒细胞癌中肿瘤细胞的稀疏性有关[6]。受累的肠段形成大量的纤维组织和炎症细胞而引起管壁异常增厚,可能是癌细胞阻塞淋巴管引起的水肿而不是癌细胞浸润导致的[13]。另一种可能的原因是肿瘤细胞通过腹膜播散转移至直肠,由于子宫直肠隐窝或膀胱直肠隐窝位于腹膜腔的最低位置,癌细胞容易在此聚集,发生腹膜腔种植转移,肿瘤由肠壁外向内生长,因此直肠活检难以检测到肿瘤细胞,导致结果呈阴性。
目前,少有研究报道原发性胃癌相关的直肠Schnitzler转移。患者出现排便习惯突然变化(如便秘、腹泻交替) 和直肠狭窄,以及影像学显示直肠壁增厚和直肠活检难以检测出肿瘤细胞,应怀疑Schnitzler转移。应追问病史,及时进行相关检查,包括进一步的胃镜检查和深度取材活检,以确定病变性质[14]。确定肠道病变是否为转移性质,对于治疗方案的选择至关重要,贸然行手术切除可能会对患者的身体造成非必要的创伤。目前,预防和管理转移性结肠狭窄引起的肠梗阻,通常选择减压治疗,包括结肠造口术或结肠支架置入等。然而,无论就诊时疾病分期如何,所有患者均应接受化疗。
综上所述,以直肠梗阻为首发症状的胃癌Schnitzler转移罕见,因结肠镜病理很难寻找到癌细胞而不易确诊,从而延误治疗。胃癌Schnitzler转移至直肠具有独特的影像学表现,即肠道病灶呈同心圆样肠壁增厚,同时伴有内层显著增厚和强化。但肠道病灶的深度穿刺活检仍是诊断直肠转移的金标准。
| [1] |
SUNG H, FERLAY J, SIEGEL RL, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
PERNOT S, VORON T, PERKINS G, et al. Signet-ring cell carcinoma of the stomach: impact on prognosis and specific therapeutic cha-llenge[J]. World J Gastroenterol, 2015, 21(40): 11428-11438. |
| [3] |
MARIETTE C, CARNEIRO F, GRABSCH HI, et al. Consensus on the pathological definition and classification of poorly cohesive gastric carcinoma[J]. Gastric Cancer, 2019, 22(1): 1-9. DOI:10.1007/s10120-018-0868-0 |
| [4] |
PIESSEN G, MESSAGER M, ROBB WB, et al. Gastric signet ring cell carcinoma: how to investigate its impact on survival[J]. J Clin Oncol, 2013, 31(16): 2059-2060. DOI:10.1200/JCO.2012.47.4338 |
| [5] |
KWON KJ, SHIM KN, SONG EM, et al. Clinicopathological characteristics and prognosis of signet ring cell carcinoma of the stomach[J]. Gastric Cancer, 2014, 17(1): 43-53. DOI:10.1007/s10120-013-0234-1 |
| [6] |
KARADAG B, AYAN F, ISMAILOGLU Z, et al. An extraordinary cause of ischemic chest pain in a young man: congenital ostial atresia of the right coronary artery[J]. J Cardiol, 2009, 54(2): 335-338. DOI:10.1016/j.jjcc.2009.01.008 |
| [7] |
YU X, ZHANG J. Gastric cancer with large bowel obstruction as the first presentation: a case report[J]. Oncol Lett, 2013, 6(5): 1377-1379. DOI:10.3892/ol.2013.1540 |
| [8] |
UEMURA N, KURASHIGE J, KOSUMI K, et al. Early gastric cancer metastasizing to the rectum, possibly via a hematogenous route: a case report and review of literature[J]. Surg Case Rep, 2016, 2(1): 58. DOI:10.1186/s40792-016-0180-3 |
| [9] |
OLANO C, DE SIMONE F, GONZALEZ F, et al. Stomach cancer presenting with rectal stenosis: Schnitzler's metastasis[J]. Gastrointest Endosc, 2009, 70(4): 809-810. DOI:10.1016/j.gie.2009.01.031 |
| [10] |
PACE U, CONTINO G, CHIAPPA A, et al. Metachronous colon metastases from gastric adenocarcinoma: a case report[J]. Case Rep Oncol, 2009, 2(2): 92-96. DOI:10.1159/000215945 |
| [11] |
SALAS NR, PAZ CG, RIVERA T, et al. Colonic anastomosis and colonic polyp mucosal metastasis of signet ring cell gastric adenocarcinoma[J]. Clin Transl Oncol, 2010, 12(3): 238-239. DOI:10.1007/s12094-010-0496-6 |
| [12] |
RAUSEI S, FRATTINI F, DIONIGI G, et al. Unusual rectal stenosis[J]. J Surg Oncol, 2010, 102(6): 713. DOI:10.1002/jso.21632 |
| [13] |
马爱冬, 杨慧, 魏然, 等. 胃癌结直肠转移瘤的MSCT诊断[J]. 医学影像学杂志, 2016, 26(6): 1034-1037. |
| [14] |
LIM SW, HUH JW, KIM YJ, et al. Laparoscopic low anterior resection for hematogenous rectal metastasis from gastric adenocarcinoma: a case report[J]. World J Surg Oncol, 2011, 9: 148. DOI:10.1186/1477-7819-9-148 |
 2023, Vol. 52
2023, Vol. 52