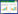文章信息
- 邱辉, 周佳任
- QIU Hui, ZHOU Jiaren
- 长链非编码RNA MALAT1靶向miR-218对卵巢癌细胞增殖、侵袭及凋亡的影响及其作用机制
- Effects of lncRNA MALAT1 targeting miR-218 on proliferation, invasion, and apoptosis of ovarian cancer cells and its mechanism
- 中国医科大学学报, 2023, 52(5): 447-452
- Journal of China Medical University, 2023, 52(5): 447-452
-
文章历史
- 收稿日期:2022-11-19
- 网络出版时间:2023-05-19 15:53:45
卵巢癌是女性生殖系统常见的恶性肿瘤之一,85%~90%的卵巢癌来源于上皮细胞。卵巢癌早期症状不明显,大部分患者确诊时已是晚期,且预后较差,5年生存率约为30%。卵巢癌致死率在女性生殖系统恶性肿瘤中高居首位[1]。因此,寻找卵巢癌新的生物标志物对明确临床诊断及卵巢癌发生发展的分子机制意义重大。
近年来研究[2-3]发现长链非编码RNA(long noncoding RNA,lncRNA)在卵巢癌的发生、发展中发挥重要作用。lncRNA MALAT1位于染色体11q13.1,与多种肿瘤的发生、发展及转移相关。肝癌、非小细胞肺癌、膀胱癌、宫颈癌以及结直肠癌等多种肿瘤组织中lncRNA MALAT1的表达均升高[4]。已有研究[5]显示,MALAT1在卵巢癌组织中高表达,与卵巢癌FIGO分期、淋巴结转移和组织分期及预后密切相关。
人微RNA 218(microRNA 218,miR-218)是肿瘤抑制因子,位于染色体4p15.31,在多种肿瘤中通过调控靶基因的表达,影响肿瘤增殖、凋亡和迁移等生物学行为[6-8]。临床研究[9]表明,miR-218在卵巢癌中低表达,与卵巢癌恶性程度、肿瘤分化程度以及肿瘤转移相关。同时,miR-218在卵巢癌干细胞中表达降低,转染miR-218模拟物后卵巢癌干细胞增殖减慢,肿瘤球形成能力下降[10]。已有研究[11]显示,lncRNA MALAT1能够通过与miR-218相互作用调节绒毛膜癌的生长。MALAT1在卵巢癌发生、发展中的作用机制尚未明确。本研究探讨lncRNA MALAT1靶向miR-218对卵巢癌细胞OVCAR3增殖、侵袭及凋亡的影响及其作用机制,旨在为寻找卵巢癌新的生物学标志物提供参考和依据。
1 材料与方法 1.1 细胞及试剂来源人卵巢癌癌细胞系OVCAR3和人正常卵巢上皮细胞系HOSE购自上海通派生物科技有限公司,RPMI 1640、胎牛血清、青链霉素、细胞凋亡检测试剂盒购自北京索莱宝公司,RNA提取试剂盒、反转录试剂盒和实时PCR试剂盒购自大连TaKaRa公司,MALAT1抑制物、荧光报告载体质粒、lncRNA MALAT1、miR-218检测引物购自上海生工生物工程股份有限公司,荧光素酶活性检测试剂盒购自北京Promega公司,GAPDH和Runx2抗体购自美国Santa公司。
1.2 细胞培养、转染及分组人正常卵巢上皮细胞系HOSE和人卵巢癌细胞系OVCAR3于37℃、5% CO2含10% 胎牛血清、1%青链霉素的RPMI 1640培养液中培养。细胞生长融合70%~80%时,更换为不含FBS的培养基,同步化12 h后按照lipofectamine3000说明书进行转染,细胞分为转染无意义序列阴性对照(si-NC)组、转染MALAT1干扰序列(si-MALAT1)组、si-MALAT1+miR-218抑制剂组,培养6 h,更换正常培养基继续培养48 h后收集细胞用于后续实验。
1.3 实时PCR检测应用TRIzol法提取各组细胞总RNA,反转录成cDNA,实时PCR试剂盒检测MALAT1、miR-218的表达。反应条件:95 ℃ 10 min,95 ℃ 20 s,60 ℃ 50 s,72 ℃ 30 s,30个循环,72 ℃,10 min。引物序列:MALAT1,正向5’-GGTAACGATGGTGTCGAGGTC-3’,反向5’-CCAGCATTACAGTTCTTGAACATG-3’;miR-218,正向5’-TTGTGCTTGATCTAACCATGT-3,反向5’-CAGTGCGTGTCGTGGAGT-3’;U6,正向5’-CTCGCTTCGGCAGCACA-3’,反向5’-AACGCTTCACGAATTTGCGT-3’;GAPDH,正向5’-CGCGGGCTCCAGAACATCAT-3’,反向5’-CCAGCCCCAGCGTCAAAGGTG-3’。实验重复3次,以U6和GAPDH作为内参,采用2-ΔΔCt法计算相对表达。
1.4 Western blotting检测收集各组细胞,在冰上用蛋白裂解液提取各组细胞的总蛋白,应用BCA试剂盒对提取的蛋白定量,进行SDS-PAGE凝胶电泳,转膜,室温条件5%脱脂奶粉液封闭2 h,一抗4 ℃孵育过夜,次日TBST洗膜2次,二抗室温孵育1 h,ECL化学发光显色,用Quantity One图像分析软件测量条带灰度值,以GAPDH为内参分析Runx2蛋白的相对表达。
1.5 MTT法检测细胞增殖情况各组细胞培养至24、48、72 h,每孔加入MTT溶液(20 µL),孵育4 h,弃去上清液,每孔加入DMSO 150 µL,振荡反应10 min使沉淀溶解,用酶标仪于波长490 nm处检测吸光度(optical density,OD)值,实验重复3次。
1.6 流式细胞术检测细胞凋亡率胰酶消化细胞,离心、收集细胞后采用4 ℃的PBS洗涤细胞,使用Annexin V/PI检测试剂盒避光孵育15 min,流式细胞术检测各组细胞凋亡情况,实验重复3次。
1.7 Transwell检测细胞侵袭情况取1×105个细胞加入预先铺好基质胶的Transwell小室的上室,将含10% FBS的RPMI 1640培养液加入下室,常规培养24 h,用棉签轻轻擦去未穿膜的细胞,多聚甲醛固定下室中的细胞,结晶紫染色,显微镜观察并拍照计数。
1.8 双荧光素酶报告基因实验采用双荧光素酶报告基因实验验证MALAT1与miR-218的靶向关系。将HEK-293细胞接种于24孔板中,培养24 h后用lipofectamine2000将含有野生型(WT)或突变型(MUT)MALAT1的pGL3质粒同miR-218模拟物或对照序列进行共转染48 h,双荧光素酶活性检测试剂盒测定荧光素酶活性。
1.9 统计学分析应用SPSS 20.0软件进行统计学分析,数据以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 卵巢癌细胞中MALAT1、miR-218的表达结果显示,与人正常卵巢上皮细胞系HOSE比较,卵巢癌OVCAR3细胞中MALAT1表达升高(P < 0.05),miR-218表达下降(P < 0.05),见图 1。
|
| *P < 0.05 compared with HOSE group. 图 1 MALAT1、miR-218在卵巢癌细胞中的表达 Fig.1 Expression of MALAT1 and miR-218 in ovarian cancer cells |
2.2 抑制lncRNA MALAT1对OVCAR3细胞增殖、侵袭及凋亡的影响
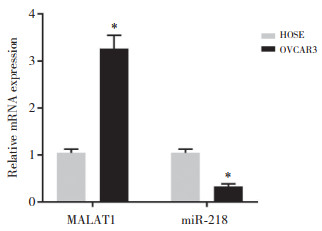
实时PCR检测转染效率结果显示,与si-NC组比较,si-MALAT1组细胞中MALAT1的表达明显下降(P < 0.05,图 2A),表明转染成功。
|
| A, the expression of MALAT1 after transfection by qRT-PCR; B, the proliferation of OVCAR3 cells by MTT; C, The invasion ability of OVCAR3 cells by Transwell assay (crystal violet staining×200);D, the apoptosis of OVCAR3 cells by flow cytometry. *P < 0.05 compared with si-NC group. 图 2 si-MALAT1对OVCAR3细胞增殖、侵袭以及凋亡的影响 Fig.2 Effects of si-MALAT1 on the proliferation, invasion, and apoptosis of OVCAR3 cells |
结果显示,与si-NC组比较,si-MALAT1组卵巢癌细胞的增殖能力显著抑制(P < 0.05,图 2B),侵袭能力显著下降(P < 0.05,图 2C),凋亡率显著升高(P < 0.05,图 2D),说明沉默MALAT1可以抑制OVCAR3细胞的增殖和侵袭,促进细胞的凋亡。
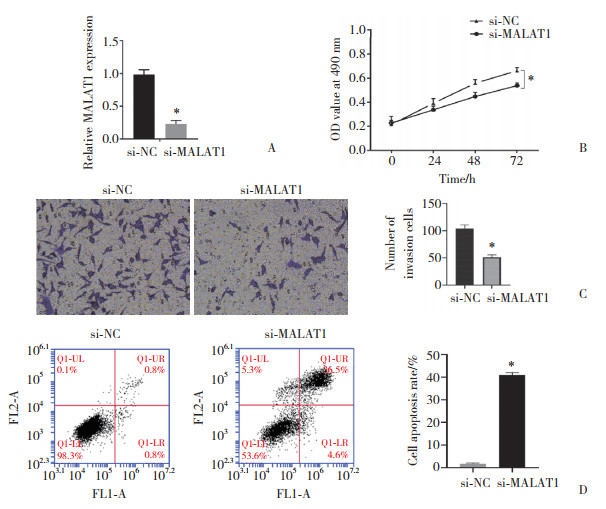
2.3 lncRNA MALAT1靶向调控miR-218表达的验证使用生物信息学软件miRanda预测MALAT1与miR-218的靶向关系,结果显示miR-218可以靶向结合MALAT1,见图 3A。实时PCR检测结果显示,干扰MALAT1表达后卵巢癌OVCAR3细胞中miR-218的表达增加(P < 0.05,图 3B)。双荧光素酶报告基因实验结果显示,与MALAT1-WT/miR-NC组比较,MALAT1-WT/miR-218 mimics组细胞荧光素酶活性明显降低(P < 0.05,图 3C),提示MALAT可负调控miR-218的表达。
|
| A, binding sites of lncRNA MALAT1 and miR-218;B, effect of silence with MALAT1 expression on miR-218 expression; C, dual luciferase reporter gene experiment verified the relationship between lncRNA MALAT1 and miR-218. *P < 0.05 compared with si-NC or miR-NC group. 图 3 lncRNA MALAT1靶向调控miR-218的表达 Fig.3 lncRNA MALAT1 regulates the expression of miR-218 |
2.4 抑制miR-218的表达逆转了抑制MALAT1表达对OVCAR3细胞增殖、侵袭及凋亡的作用
结果显示,与si-MALAT1组比较,si-MALAT1+miR-218抑制剂组OVCAR3细胞中miR-218的表达水平降低(P < 0.05,图 4A);细胞增殖和侵袭能力升高,凋亡率降低(均P < 0.05,图 4B~4D)。提示抑制miR-218的表达逆转了抑制MALAT1表达对OVCAR3细胞增殖、侵袭及凋亡的作用。
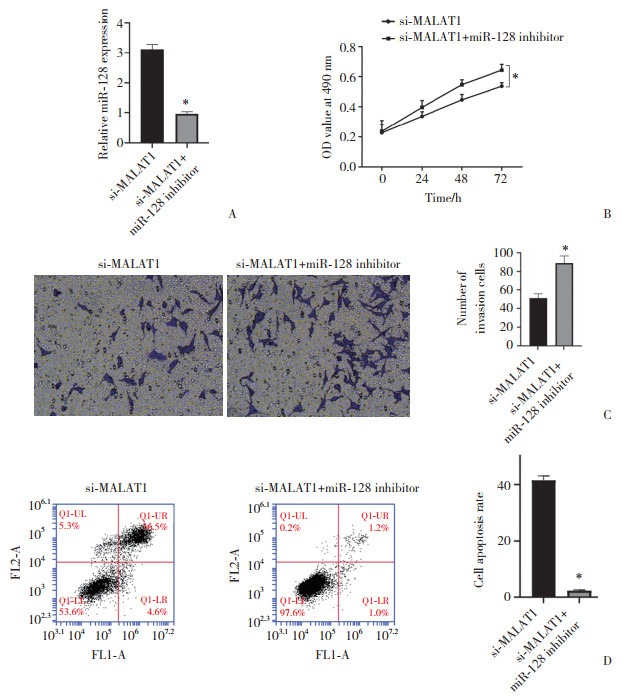
|
| A, miR-218 expression by qRT-PCR; B, cell viability was detected by MTT; C, the invasion of OVCAR3 cells by Transwell (crystal violet staining×200);D, the apoptosis of OVCAR3 cells by flow cytometry. *P < 0.05 vs si-MALAT1 group. 图 4 抑制miR-218的表达逆转了抑制MALAT1表达对OVCAR3细胞增殖、侵袭及凋亡的作用 Fig.4 Reversed inhibition of MALAT1 expression on the proliferation, invasion, and apoptosis of OVCAR3 cells owing to interference by miR-218 expression |
Western blotting检测结果显示,与si-NC组(1.00±0.00)比较,si-MALAT1组(0.15±0.02)细胞中Runx2蛋白表达降低;与si-MALAT1组比较,si-MALAT1+miR-218抑制剂组(0.67±0.06)细胞中Runx2蛋白的表达升高(P < 0.05,图 5)。

|
| 1, si-NC group; 2, si-MALAT1 group; 3, si-MALAT1+miR-218 inhibitor group. 图 5 应用Western blotting检测Runx2蛋白表达 Fig.5 Runx2 protein expression detected by Western blotting |
3 讨论
研究[12-13]显示,lncRNA在癌症发生中发挥调节作用,一些lncRNA可以作为卵巢癌的分子标志物和治疗靶点。lncRNA MALAT1可调节多种肿瘤的迁移和增殖[14-16]。有研究[17-18]显示,MALAT1在人卵巢恶性肿瘤组织和细胞中的表达分别高于正常卵巢组织和非肿瘤性人卵巢表面上皮细胞,其表达量与生存期密切相关,说明MALAT1发挥癌基因的作用,调节细胞增殖、迁移和凋亡。本研究应用实时PCR检测MALAT1和miR-218在人卵巢癌细胞系和正常人卵巢上皮细胞系中的表达,发现与人正常卵巢上皮细胞系比较,在卵巢癌OVCAR3细胞中MALAT1表达升高(P < 0.05),miR-218表达下降(P < 0.05),与以往研究结果一致,提示MALAT1在卵巢癌的发生、发展中可能起到重要作用。本研究将MALAT1干扰序列转染卵巢癌细胞,通过细胞增殖实验、流式细胞术和Transwell实验检测细胞增殖、凋亡和侵袭能力。结果显示,干扰MALAT1可以抑制卵巢癌OVCAR3细胞的增殖和侵袭,促进OVCAR3细胞凋亡。
研究[19-20]显示,MALAT1可以靶向海绵吸附众多目标微RNA,调控下游靶基因表达,从而影响卵巢癌的增殖和凋亡等生物学行为。卵巢癌中miR-218可以通过调节靶基因Runx2、Wnt2B抑制卵巢癌细胞的增殖、侵袭和转移[21-22],在卵巢癌细胞中过表达miR-218可以抑制细胞增殖并促进细胞凋亡[23]。Runx2是多瘤病毒增强子结合蛋白2/核心结合因子转录因子家族的成员之一,在成骨过程及众多肿瘤(乳腺癌、前列腺癌及甲状腺癌等)的发生发展过程中发挥重要作用。卵巢癌中Runx2表达升高,其高表达与肿瘤临床分级、患者生存期密切相关,抑制卵巢癌中Runx2的表达可以抑制卵巢癌的增殖、侵袭和迁徙,促进卵巢癌细胞凋亡[24-26]。
本研究将MALAT1干扰序列与miR-218抑制物和对照序列分别共转染卵巢癌细胞系OVCAR3,结果发现与转染MALAT1干扰序列细胞比较,同时转染miR-218干扰序列细胞的增殖和侵袭能力增强,细胞凋亡受到抑制,提示同时转染miR-218干扰序列可以逆转干扰MALAT1对卵巢癌细胞生物学行为的影响。进一步生物信息学网站分析及双荧光素酶报告基因实验研究结果显示,MALAT1和miR-218存在靶向关系。实时PCR和Western blotting检测结果表明MALAT1可以海绵吸附miR-218,转染si-MALAT1可以增加卵巢癌细胞中miR-218的表达,同时抑制Runx2的表达。
综上所述,lncRNA MALAT1在卵巢癌细胞中高表达,抑制MALAT1表达能够制卵巢癌OVCAR3细胞的增殖和侵袭,并促进OVCAR3细胞凋亡,其机制可能与通过miR-218调控Runx2蛋白表达有关。本研究为卵巢癌的研究提供了新的方向,但其他下游靶基因及相关通路以及裸鼠荷瘤动物实验尚未完成,因此须在未来研究中进一步论证。
| [1] |
SIEGEL RL, MILLER KD, JEMAL A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1): 7-30. DOI:10.3322/caac.21332 |
| [2] |
胡佩, 朱海斌. 长链非编码RNAs与卵巢癌关系的研究进展[J]. 浙江医学, 2020, 42(10): 1085-1091. DOI:10.12056/j.issn.1006-2785.2020.42.10.2019-1796 |
| [3] |
韦欣仪, 程晓东, 吕卫国. 长链非编码RNA在卵巢癌转移中的研究进展[J]. 现代妇产科进展, 2020, 29(12): 956-958, 960. DOI:10.13283/j.cnki.xdfckjz.2020.12.012 |
| [4] |
白茹梦, 王朝霞. 长链非编码RNA MALAT1在肿瘤研究中的新进展[J]. 临床肿瘤学杂志, 2016, 21(12): 1139-1145. DOI:10.3969/j.issn.1009-0460.2016.12.017 |
| [5] |
杨珠兰, 郑丽澜, 陈玉芬. 非编码RNA MALAT1和ANRIL在卵巢癌患者组织中的表达情况及与临床病理的关系[J]. 中国性科学, 2021, 30(6): 49-51. DOI:10.3969/j.issn.1672-1993.2021.06.016 |
| [6] |
LI H, AN XZ, FU QS. miR-218 affects the invasion and metastasis of cervical cancer cells by inhibiting the expression of SFMBT1 and DCUNIDI[J]. Cell Mol Biol (Noisy-le-grand), 2022, 68(2): 81-86. DOI:10.14715/cmb/2022.68.2.12 |
| [7] |
GU JS, GE XH, YOU AW, et al. miR-218-5p inhibits the malignant progression of glioma via targeting TCF12[J]. Tumori, 2022, 108(4): 338-346. DOI:10.1177/03008916211018263 |
| [8] |
LI XC, HAI JJ, TAN YJ, et al. miR-218 suppresses metastasis and invasion of endometrial cancer via negatively regulating ADD2[J]. Eur Rev Med Pharmacol Sci, 2019, 23(4): 1408-1417. DOI:10.26355/eurrev_201902_17097 |
| [9] |
赵立红, 石淑莉, 齐秀玲. miR-218和miR-152在浆液性卵巢癌的表达及临床意义[J]. 生殖医学杂志, 2015, 24(4): 293-296. DOI:10.3969/j.issn.1004-3845.2015.04.008 |
| [10] |
贺敏, 陈勇伟, 曾康康, 等. miRNA-218对PAG1的调控及其对卵巢癌干细胞的影响[J]. 临床与病理杂志, 2019, 39(4): 706-713. DOI:10.3978/j.issn.2095-6959.2019.04.003 |
| [11] |
SHI DZ, ZHANG Y, LU R. The long non-coding RNA MALAT1 interacted with miR-218 modulates choriocarcinoma growth by targeting Fbxw8[J]. Biomed Pharmacother, 2018, 97: 543-550. DOI:10.1016/j.biopha.2017.10.083 |
| [12] |
WANG JY, LU AQ, CHEN LJ. lncRNAs in ovarian cancer[J]. Clin Chim Acta, 2019, 490: 17-27. DOI:10.1016/j.cca.2018.12.013 |
| [13] |
BRAGA EA, FRIDMAN MV, MOSCOVTSEV AA, et al. lncRNAs in ovarian cancer progression, metastasis, and main pathways: cerna and alternative mechanisms[J]. Int J Mol Sci, 2020, 21(22): 8855. DOI:10.3390/ijms21228855 |
| [14] |
CERVENA K, VODENKOVA S, VYMETALKOVA V. MALAT1 in colorectal cancer: its implication as a diagnostic, prognostic, and predictive biomarker[J]. Gene, 2022, 843: 146791. DOI:10.1016/j.gene.2022.146791 |
| [15] |
QI JD, CHU YF, ZHANG GY, et al. Retraction: Down-regulated lncR-MALAT1 suppressed cell proliferation and migration by inactivating autophagy in bladder cancer[J]. RSC Adv, 2018, 18(54): 31019-31027. DOI:10.1039/c8ra04876b |
| [16] |
AN C, WANG I, LI X, et al. Long non-coding RNA in prostate cancer[J]. Am J Clin Exp Urol, 2022, 10(3): 170-179. |
| [17] |
WU LQ, WANG XY, GUO YN. Long non-coding RNA MALAT1 is upregulated and involved in cell proliferation, migration and apoptosis in ovarian cancer[J]. Exp Ther Med, 2017, 13(6): 3055-3060. DOI:10.3892/etm.2017.4304 |
| [18] |
LIN QB, GUAN WC, REN WM, et al. MALAT1 affects ovarian cancer cell behavior and patient survival[J]. Oncol Rep, 2018, 39(6): 2644-2652. DOI:10.3892/or.2018.6384 |
| [19] |
SUN Q, LI Q, XIE FF. lncRNA-MALAT1 regulates proliferation and apoptosis of ovarian cancer cells by targeting miR-503-5p[J]. Onco Targets Ther, 2019, 12: 6297-6307. DOI:10.2147/OTT.S214689 |
| [20] |
TAO FF, TIAN XX, RUAN SM, et al. miR-211 sponges lncRNA MALAT1 to suppress tumor growth and progression through inhibiting PHF19 in ovarian carcinoma[J]. FASEB J, 2018, 32(11): 6330-6343. DOI:10.1096/fj.201800495RR |
| [21] |
饶玉梅, 纪妹, 史惠蓉, 等. MiR-218靶向Wnt2B抑制卵巢癌细胞转移侵袭功能[J]. 华中科技大学学报(医学版), 2013, 42(6): 656-658, 664. DOI:10.3870/j.issn.1672-0741.2013.06.007 |
| [22] |
LI N, WANG LF, TAN GY, et al. MicroRNA-218 inhibits proliferation and invasion in ovarian cancer by targeting Runx2[J]. Oncotarget, 2017, 8(53): 91530-91541. DOI:10.18632/oncotarget.21069 |
| [23] |
HUANG Y, LIANG SH, XIANG LB, et al. miR-218 promoted the apoptosis of human ovarian carcinoma cells via suppression of the WNT/β-catenin signaling pathway[J]. Mol Biol, 2017, 51(4): 555-561. DOI:10.1134/S0026893317030062 |
| [24] |
LI WP, XU SJ, LIN S, et al. Overexpression of runt-related transcription factor-2 is associated with advanced tumor progression and poor prognosis in epithelial ovarian cancer[J]. J Biomed Biotechnol, 2012, 2012: 456534. DOI:10.1155/2012/456534 |
| [25] |
WANG ZQ, KEITA M, BACHVAROVA M, et al. Inhibition of RUNX2 transcriptional activity blocks the proliferation, migration and invasion of epithelial ovarian carcinoma cells[J]. PLoS One, 2013, 8(10): e74384. DOI:10.1371/journal.pone.0074384 |
| [26] |
WEN CY, LIU XJ, MA HX, et al. miR-338-3p suppresses tumor growth of ovarian epithelial carcinoma by targeting Runx2[J]. Int J Oncol, 2015, 46(5): 2277-2285. DOI:10.3892/ijo.2015.2929 |
 2023, Vol. 52
2023, Vol. 52