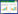文章信息
- 刘昊, 李依雯, 朱玉娇, 薛海波
- LIU Hao, LI Yiwen, ZHU Yujiao, XUE Haibo
- Notch1信号通路通过调控Th17细胞参与实验性自身免疫性甲状腺炎的发生和发展
- Notch1 signaling pathway participates in the occurrence and development of experimental autoimmune thyroiditis by regulating Th17 cells
- 中国医科大学学报, 2023, 52(5): 420-425
- Journal of China Medical University, 2023, 52(5): 420-425
-
文章历史
- 收稿日期:2022-07-22
- 网络出版时间:2023-05-19 14:26:58
自身免疫性甲状腺炎为最常见的甲状腺疾病之一,其典型的病理特征为甲状腺内淋巴细胞浸润,进而导致滤泡细胞萎缩、纤维化和上皮细胞破坏,同时伴有甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)、甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)等器官特异性自身免疫抗体滴度升高[1],有自然进展为甲状腺功能减退的趋势,但目前尚无特效防治措施。新近的甲状腺疾病与碘营养的流行病学调查研究[2]报道,中国成年人群中甲状腺自身免疫抗体总阳性率为14.19%,其中TPOAb阳性率为10.19%,TgAb阳性率为9.70%。因此,阐明自身免疫性甲状腺炎的发病机制对其有效防治具有重要的临床意义。
T细胞介导的自身免疫损伤为自身免疫性甲状腺炎主要发病机制之一,但确切机制尚未阐明。作为一类能够分泌白细胞介素(interleukin,IL)-17的CD4+ T细胞亚群,辅助性T细胞17(T helper 17 cell,Th17)在自身免疫性疾病和抗体防御反应中均发挥重要作用[3]。本课题组前期研究[4-5]发现,自身免疫性甲状腺炎患者外周血Th17细胞比例及其效应因子IL-17A的表达水平均明显升高,并与疾病的严重程度相关,提示Th17细胞可能参与了自身免疫性甲状腺炎的自身免疫损伤。Notch信号是进化上高度保守的信号通路,与细胞的分化、增殖、凋亡和上皮-间质转化等有关[6]。近年的研究[7]报道,Notch1信号通路可以作用于Th17细胞的特异性转录因子维甲酸相关孤儿受体γt(retinoid-related orphan receptor-γt,RORγt),并进一步调节Th17细胞分化,其在银屑病、类风湿性关节炎等多种免疫疾病中发挥作用。本研究通过建立实验性自身免疫性甲状腺炎(experimental autoimmune thyroiditis,EAT)小鼠模型,探讨Notch1信号通路在Th17细胞参与EAT小鼠甲状腺自身免疫损伤中的作用。
1 材料与方法 1.1 试剂与仪器猪甲状腺球蛋白、完全弗氏佐剂、不完全弗氏佐剂、γ分泌酶抑制剂(DAPT,美国Sigma公司);小鼠TgAb ELISA试剂盒、小鼠IL-17A ELISA试剂盒(上海酶联生物科技有限公司);小鼠脾脏单核细胞(spleen mononuclear cell,SMC)分离液试剂盒(天津灏洋生物制品科技有限公司);苏木素-伊红(hematoxylin-eosin staining,HE)染色试剂盒、BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司);APC-CD4单克隆抗体、PE-IL-17A单克隆抗体、重组IL-1β、重组转化生长因子(transforming growth factor,TGF)-β1、重组IL-6、重组IL-23(美国Biolegend公司);抗小鼠γ干扰素(interferon-γ,IFN-γ)抗体、抗小鼠IL-4抗体、抗小鼠CD3ε抗体、抗小鼠CD28抗体(美国Bioxcell公司);TRIzol RNA提取试剂(美国Invitrogen公司);Evo M-MLV反转录试剂盒(山东赛恩斯科技有限公司);AceQ qPCR SYBR Green Master Mix(南京诺唯赞生物科技股份有限公司);SDS-PAGE凝胶配制试剂盒(上海生工生物工程有限公司);兔抗鼠IL-17A抗体、兔抗鼠β-actin抗体、山羊抗兔IgG(美国Cell Signaling Technology公司)。
酶标分析仪、37 ℃恒温CO2培养箱(美国Thermo公司);FACS Calibur流式细胞仪(美国BD公司);化学发光成像仪(上海勤翔科学仪器有限公司)。
1.2 实验动物和分组24只6~8周龄雌性C57BL/6小鼠,体质量为15~18 g,由滨州医学院代谢与精神疾病研究所赠予,饲养于滨州医学院附属医院SPF级动物房。饲养条件:温度23 ℃、湿度55%、光照与黑暗各12 h循环,适应性喂养1周后开始实验。将24只小鼠随机分为对照组(NC组,n = 8)和EAT组,EAT组进一步分为EAT-A组(n = 8)和EAT-B组(n = 8)。所有动物的饲养和实验均根据动物指南并通过动物伦理委员会批准。
1.3 实验方法 1.3.1 3组小鼠处理方法将猪甲状腺球蛋白溶于磷酸盐缓冲液中配成母液(2 mg/mL),母液中加入完全弗氏佐剂配成初次免疫制剂(1 mg/mL),母液中加入不完全弗氏佐剂配成再次免疫制剂(1 mg/mL),现用现配。EAT-A组和EAT-B组小鼠第1周给予初次免疫制剂多点皮下注射100 μL,第2~8周分别给予再次免疫制剂多点皮下注射100 μL,1次/周。且EAT-B组小鼠于每次免疫制剂皮下注射前30 min给予DAPT(10 mg/kg)腹腔注射。NC组小鼠于相同时间、相同部位给予等量PBS皮下注射。各组小鼠均于实验第8周麻醉后处死。
1.3.2 甲状腺组织病理学检查分离小鼠颈部各层组织,暴露气管,剪取小鼠甲状腺,固定、包埋、切片,HE染色后于显微镜下观察。根据淋巴细胞浸润程度进行炎症严重程度评分[8]:0,正常;1,1%~≤10%;2,> 10%~30%;3,> 30%~50%;4,> 50%。
1.3.3 ELISA检测血清TgAb滴度小鼠心脏取血,室温静置30 min,离心后收集上层血清,按照小鼠TgAb ELISA试剂盒说明书进行检测,根据光密度值(450 nm)计算小鼠血清中TgAb滴度。
1.3.4 脾指数计算称量小鼠体质量和脾脏重量,计算脾指数,脾指数(mg/g)=脾脏重量/体质量。
1.3.5 SMC悬液制备分离小鼠脾脏,根据小鼠SMC分离液试剂盒说明书进行操作,最后一步以含胎牛血清、青链霉素双抗、巯基还原剂、非必需氨基酸的RPMI 1640培养液重悬细胞,计数并将细胞密度调至1×106/mL。
1.3.6 流式细胞仪检测SMC中Th17细胞比例取约105个细胞加入已包被抗小鼠CD3ε抗体、抗小鼠CD28抗体的12孔板,每孔加入重组IL-1β、重组TGF-β1、重组IL-6、重组IL-23、抗小鼠IFN-γ抗体、抗小鼠IL-4抗体刺激Th17细胞极化。37 ℃、5%CO2条件下培养72 h。12孔板每孔加入佛波酯、钙离子霉素,培养1 h后加入布雷非德菌素A,刺激培养3 h。取约105个细胞于流式管中,加入APC-CD4单克隆抗体,4 ℃避光30 min进行细胞膜标记,加入固定液,4 ℃避光20 min,洗涤并重悬细胞;加入破膜液、PE-IL-17A单克隆抗体,4 ℃避光30 min进行细胞内标记,应用流式细胞仪检测。
1.3.7 ELISA检测SMC培养上清IL-17A浓度取SMC培养上清,按照小鼠IL-17A ELISA试剂盒说明书进行检测,根据光密度值(450 nm)计算小鼠细胞培养上清中IL-17A浓度。
1.3.8 实时PCR(real-time PCR,RT-PCR)检测脾脏Notch1、Hes1、RORγt及IL-17A mRNA表达水平:用TRIzol RNA提取试剂提取小鼠脾细胞总RNA,Evo M-MLV反转录试剂盒合成cDNA,设计合成Notch1、Hes1、RORγt和IL-17A引物。Notch1引物序列:正向,5’-TGCCTTGAGTGTGCTGGAATG-3’,反向,5’-ATTCTGCCACAGGCGTATACTTGA-3’。Hes1引物序列:正向,5’-AAAGACGGCCTCTGAGCAC-3’,反向,5’-GGTGCTTCACAGTCATTTCCA-3’。RORγt引物序列:正向,5’-TCTGCAAGACTCATCGACAAGG-3’,反向,5’-CACATGTTGGCTGCACAGG-3’。IL-17A引物序列:正向,5’-GGAAAGCTGGACCACCACA-3’,反向,5’-CACACCCACCAGCATCTTCTC-3’。以β-actin为内参,β-actin引物序列:正向,5’-AGTTGGTTACACCCTTTCTTG-3’,反向,5’-TCACCTTCACCGTTCCAGTTT-3’。在RT-qPCR仪上进行检测。反应体系:95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火60 s,共扩增40个循环。
1.3.9 Western blotting检测脾脏IL-17A蛋白表达水平提取脾脏组织蛋白,BCA法测定蛋白浓度,电泳、转膜、封闭后孵育兔抗鼠IL-17A抗体和兔抗鼠β-actin抗体过夜,清洗并孵育山羊抗兔IgG,再次清洗后曝光,利用ImageJ软件量化IL-17A蛋白表达水平。
1.4 统计学分析采用SPSS 24.0和GraphPad Prism 8.0进行统计学分析。计量资料用x±s表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析、Welch方差分析,采用Pearson相关分析进行相关性分析。P < 0.05为差异有统计学意义。
2 结果 2.1 甲状腺炎症程度评估显微镜下,NC组小鼠甲状腺组织(图 1A)滤泡上皮细胞呈单层立方状,无明显淋巴细胞浸润;EAT-A组小鼠甲状腺组织(图 1B)可见滤泡萎缩、破坏,大量淋巴细胞浸润;EAT-B组小鼠甲状腺组织(图 1C)滤泡萎缩、破坏程度及淋巴细胞浸润程度较EAT-A组明显减轻。
|
| A, NC group; B, EAT-A group; C, EAT-B group. 图 1 甲状腺组织HE染色结果 ×200 Fig.1 HE staining results of thyroid tissues ×200 |
3组比较,小鼠血清TgAb滴度的差异有统计学意义(P < 0.01)。与NC组相比,EAT-A组和EAT-B组小鼠血清TgAb滴度显著升高(均P < 0.01);与EAT-A组相比,EAT-B组小鼠血清TgAb滴度显著降低(P < 0.01)。见表 1。
| Variable | NC group(n = 8) | EAT-A group(n = 8) | EAT-B group(n = 8) | F | P |
| TgAb titer(IU/mL) | 29.32±2.29 | 56.37±1.731) | 34.40±2.161),2) | 383.615 | < 0.01 |
| Spleen index | 2.93±0.22 | 4.98±0.581) | 4.02±0.691),2) | 29.108 | < 0.01 |
| Proportion of Th17 cells(%) | 3.59±1.47 | 29.60±3.951) | 7.78±1.691),2) | 227.342 | < 0.01 |
| IL-17A concentration(pg/mL) | 46.89±1.79 | 56.16±3.001) | 51.87±2.321),2) | 29.376 | < 0.01 |
| Notch1 mRNA expression level | 0.64±0.43 | 4.64±1.821) | 2.06±0.991),2) | 22.008 | < 0.01 |
| Hes1 mRNA expression level | 1.03±0.46 | 4.09±1.061) | 2.26±0.921),2) | 26.041 | < 0.01 |
| RORγt mRNA expression level | 0.90±0.30 | 3.23±1.161) | 1.81±0.591),2) | 18.518 | < 0.01 |
| IL-17A mRNA expression level | 0.79±0.22 | 3.29±0.561) | 1.41±0.351),2) | 83.959 | < 0.01 |
| IL-17A protein level | 1.00±0.15 | 1.87±0.151) | 1.38±0.362),3) | 21.676 | < 0.01 |
| 1)P < 0.01 vs NC group;2)P < 0.01 vs EAT-A group;3)P < 0.05 vs NC group. | |||||
2.2 脾指数
3组比较,脾指数的差异有统计学意义(P < 0.01)。与NC组相比,EAT-A组和EAT-B组脾指数显著升高(均P < 0.01);与EAT-A组相比,EAT-B组脾指数显著降低(P < 0.01)。见表 1。
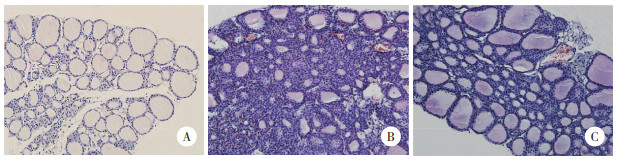
2.3 SMC中Th17细胞比例3组比较,SMC中Th17细胞比例的差异有统计学意义(P < 0.01)。与NC组相比,EAT-A组和EAT-B组SMC中Th17细胞比例显著升高(均P < 0.01);与EAT-A组相比,EAT-B组SMC中Th17细胞比例显著降低(P < 0.01)。见表 1、图 2。
|
| 图 2 SMC中Th17细胞代表性流式细胞术分析图 Fig.2 Representative results for flow cytometry of Th17 cells in SMCs |
2.4 SMC培养上清IL-17A浓度
3组比较,SMC培养上清IL-17A浓度的差异有统计学意义(P < 0.01)。与NC组相比,EAT-A组和EAT-B组SMC培养上清IL-17A浓度显著升高(均P < 0.01);与EAT-A组相比,EAT-B组SMC培养上清IL-17A浓度显著降低(P < 0.01)。见表 1。
2.5 脾细胞Notch1、Hes1、RORγt和IL-17A mRNA表达水平3组比较,脾细胞Notch1、Hes1、RORγt和IL-17A mRNA表达水平的差异有统计学意义(P < 0.01)。与NC组相比,EAT-A组和EAT-B组脾细胞Notch1、Hes1、RORγt和IL-17A mRNA表达水平显著升高(均P < 0.01);与EAT-A组相比,EAT-B组脾细胞Notch1、Hes1、RORγt及IL-17A mRNA表达水平显著降低(均P < 0.01)。见表 1。
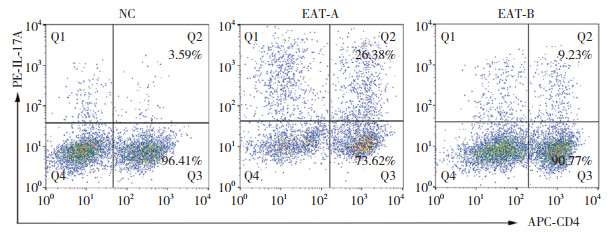
2.6 脾脏IL-17A蛋白表达水平3组比较,脾脏IL-17A蛋白表达水平的差异有统计学意义(P < 0.01)。与NC组相比,EAT-A组和EAT-B组脾脏IL-17A蛋白表达水平显著升高(P < 0.01或 < 0.05);与EAT-A组相比,EAT-B组脾脏IL-17A蛋白表达水平显著降低(P < 0.01)。见表 1、图 3。
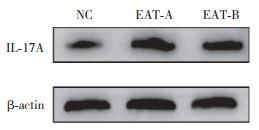
|
| 图 3 脾脏IL-17A蛋白表达水平 Fig.3 IL-17A protein level in spleen |
2.7 相关性分析
EAT-A组小鼠SMC中Th17细胞比例与血清TgAb滴度、SMC培养上清IL-17A浓度、脾细胞Notch1 mRNA表达水平及脾脏IL-17A蛋白表达水平均呈正相关(均P < 0.05)。见图 4。
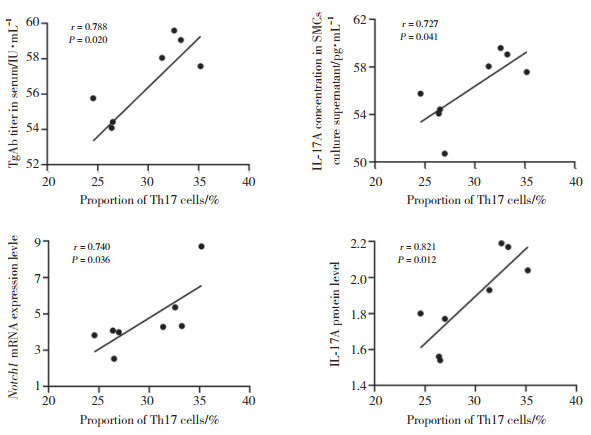
|
| 图 4 相关性分析 Fig.4 Correlation analyses |
3 讨论
CD4+ T淋巴细胞在免疫应答和炎症性疾病中发挥重要作用,幼稚的CD4+ T淋巴细胞被抗原提呈细胞和CD28等其他共刺激分子激活,在IL-6、IL-1β、IL-23和TGF-β的联合诱导下分化为Th17细胞[9],并通过分泌效应性细胞因子IL-17A作用于靶细胞,引起机体的免疫炎症反应。RORγt为Th17细胞分化的关键转录因子,对IL-17A的分泌起关键作用。已有研究[10]证实,Th17细胞及其效应因子IL-17A在银屑病、多发性硬化和类风湿性关节炎等自身免疫性疾病中表达均升高。本课题组前期研究[4-5, 11]证实,Th17细胞和IL-17A在桥本甲状腺炎患者中表达升高,且与甲状腺自身免疫损伤标志物TPOAb和TgAb的滴度呈正相关,表明Th17细胞可能与桥本甲状腺炎患者甲状腺特异性自身免疫损伤的发展有关。为进一步明确Th17细胞在自身免疫性甲状腺炎自身免疫损伤中的作用,本研究证实,EAT小鼠SMC中Th17细胞比例、SMC细胞培养上清中IL-17A浓度、脾脏IL-17A蛋白表达水平和RORγt、IL-17A mRNA表达水平均明显升高,并且Th17细胞比例与血清TgAb滴度、SMC培养上清中IL-17A浓度及脾脏IL-17A蛋白表达水平均呈正相关,说明Th17细胞可能参与EAT小鼠甲状腺自身免疫损伤的发生、发展,并通过分泌IL-17A增加其致炎作用。
Notch是一种在进化过程中高度保守的蛋白质,其中Notch1受体与2种膜结合的配体Jagged和Delta样配体(Delta-like ligand,DLL)结合后,可以激活相同的信号通路,使γ分泌酶在跨膜区对Notch进行蛋白水解,并形成Notch的活化形式即Notch细胞内结构域,进一步启动其下游转录因子Hes1发挥生物学效应[12]。γ分泌酶抑制剂DAPT作用于γ分泌酶的催化成分早老素片段,阻断Notch细胞内结构域的产生。本课题组前期研究[11]发现,桥本甲状腺炎患者外周血单核细胞中Notch1 mRNA高表达,并与TPOAb及TgAb滴度呈正相关。本研究进一步证实,EAT小鼠Notch1 mRNA及其靶基因Hes1 mRNA均高表达,给予DAPT体内注射抑制γ分泌酶后,其表达均下调,同时伴有小鼠甲状腺组织淋巴细胞浸润程度、滤泡萎缩、破坏程度明显减轻,提示Notch1/Hes1信号通路可能与甲状腺自身免疫损伤存在密切关系。
Notch1信号通路在早期T淋巴细胞的增殖、分化和成熟T淋巴细胞的功能调控方面发挥重要作用[13-14]。另外,Notch的配体Jagged1和DLL-4在抗原提呈细胞上的表达可以促进Th17细胞的分化,并且IL-17和RORγt是Th17细胞中Notch信号通路的直接转录靶点。在哮喘、自身免疫性脑脊髓膜炎、银屑病等炎症疾病模型中,应用DAPT阻断Notch1信号通路后,Th17细胞比例和IL-17A水平均下调,且疾病严重程度均有改善[7, 15]。如前所述,本研究证实,在促Th17细胞分化的细胞因子环境中,有Notch1信号分子的活化;体内阻断Notch1信号通路,可显著下调EAT小鼠Notch1信号分子及其靶基因Hes1、Th17细胞及其特异性转录因子RORγt、效应因子IL-17A的表达与分泌;EAT小鼠中Th17细胞比例与Notch1 mRNA表达水平呈正相关,说明Notch1信号通路与Th17细胞的变化趋势一致,提示Notch1信号通路可能通过调控Th17细胞分化参与EAT的发生和发展。
综上所述,通过动物实验,本研究发现在EAT小鼠模型中Notch1信号通路可能通过调控Th17细胞并增强其致炎作用,参与了甲状腺的自身免疫损伤,进一步深入探讨其确切机制,将为自身免疫性甲状腺炎的病因治疗提供新的策略与方向。
| [1] |
LI Y, TENG D, BA J, et al. Efficacy and safety of long-term universal salt iodization on thyroid disorders: epidemiological evidence from 31 provinces of mainland China[J]. Thyroid, 2020, 30(4): 568-579. DOI:10.1089/thy.2019.0067 |
| [2] |
WU Y, SHI X, TANG X, et al. The correlation between metabolic disorders and Tpoab/Tgab: a cross-sectional population-based study[J]. Endocr Pract, 2020, 26(8): 869-882. DOI:10.4158/EP-2020-0008 |
| [3] |
YASUDA K, TAKEUCHI Y, HIROTA K. The pathogenicity of Th17 cells in autoimmune diseases[J]. Semin Immunopathol, 2019, 41(3): 283-297. DOI:10.1007/s00281-019-00733-8 |
| [4] |
XUE H, YANG Y, ZHANG Y, et al. Macrophage migration inhibitory factor interacting with Th17 cells may be involved in the pathogenesis of autoimmune damage in Hashimoto's thyroiditis[J]. Mediators Inflamm, 2015, 2015: 621072. DOI:10.1155/2015/621072 |
| [5] |
XUE H, YU X, MA L, et al. The possible role of CD4+CD25(high) Foxp3+/CD4+IL-17A+ cell imbalance in the autoimmunity of patients with Hashimoto thyroiditis[J]. Endocrine, 2015, 50(3): 665-673. DOI:10.1007/s12020-015-0569-y |
| [6] |
TIAN T, FU X, LU J, et al. MicroRNA-760 inhibits doxorubicin resistance in hepatocellular carcinoma through regulating Notch1/Hes1-PTEN/Akt signaling pathway[J]. J Biochem Mol Toxicol, 2018, 32(8): e22167. DOI:10.1002/jbt.22167 |
| [7] |
MA L, XUE H, QI R, et al. Effect of γ-secretase inhibitor on Th17 cell differentiation and function of mouse psoriasis-like skin inflammation[J]. J Transl Med, 2018, 16(1): 59. DOI:10.1186/s12967-018-1442-6 |
| [8] |
ALLEN EM, APPEL MC, BRAVERMAN LE. The effect of iodide ingestion on the development of spontaneous lymphocytic thyroiditis in the diabetes-prone BB/W rat[J]. Endocrinology, 1986, 118(5): 1977-1981. DOI:10.1210/endo-118-5-1977 |
| [9] |
WU B, WAN S. Molecular control of pathogenic Th17 cells in autoimmune diseases[J]. Int Immunopharmacol, 2020, 80: 106187. DOI:10.1016/j.intimp.2020.106187 |
| [10] |
YANG P, QIAN FY, ZHANG MF, et al. Th17 cell pathogenicity and plasticity in rheumatoid arthritis[J]. J Leukoc Biol, 2019, 106(6): 1233-1240. DOI:10.1002/JLB.4RU0619-197R |
| [11] |
张悦, 宋守君, 薛海波, 等. Notch1-Dll4信号通路在桥本甲状腺炎自身免疫损伤中的作用[J]. 中华内分泌代谢杂志, 2018, 34(10): 852-855. DOI:10.3760/cma.j.issn.1000-6699.2018.10.009 |
| [12] |
WIELAND E, RODRIGUEZ-VITA J, LIEBLER SS, et al. Endothelial Notch1 activity facilitates metastasis[J]. Cancer Cell, 2017, 31(3): 355-367. DOI:10.1016/j.ccell.2017.01.007 |
| [13] |
VIJAYARAGHAVAN J, OSBORNE BA. Notch and T cell functiona complex tale[J]. Adv Exp Med Biol, 2018, 1066: 339-354. DOI:10.1007/978-3-319-89512-3_17 |
| [14] |
AMSEN D, HELBIG C, BACKER RA. Notch in T cell differentiation: all things considered[J]. Trends Immunol, 2015, 36(12): 802-814. DOI:10.1016/j.it.2015.10.007 |
| [15] |
YIN X, WEI H, WU S, et al. DAPT reverses the Th17/Treg imbalance in experimental autoimmune uveitis in vitro via inhibiting Notch signaling pathway[J]. Int Immunopharmacol, 2020, 79: 106107. DOI:10.1016/j.intimp.2019.106107 |
 2023, Vol. 52
2023, Vol. 52