文章信息
- 闫晗, 王昆鹏, 赵林, 刘妍, 王成龙, 宋涛
- YAN Han, WANG Kunpeng, ZHAO Lin, LIU Yan, WANG Chenglong, SONG Tao
- 短时程高颈段脊髓电刺激治疗三叉神经下颌支带状疱疹性神经痛疗效观察
- Clinical efficacy of short-term high cervical spinal cord stimulation for herpes zoster neuralgia in the mandibular branch of the trigeminal nerve
- 中国医科大学学报, 2023, 52(4): 361-365
- Journal of China Medical University, 2023, 52(4): 361-365
-
文章历史
- 收稿日期:2022-05-11
- 网络出版时间:2023-04-12 15:22:46
带状疱疹性神经痛是由初次感染人体后潜伏于神经节中的水痘-带状疱疹病毒再活化侵犯相应神经引起的神经病理性疼痛[1]。临床常将持续1个月以内的疼痛定义为急性带状疱疹性神经痛;疼痛持续1~3个月为亚急性带状疱疹性神经痛;带状疱疹发生或愈合后持续3个月以上的疼痛被定义为带状疱疹后神经痛(postherpetic neuralgia,PHN)[2]。三叉神经分布区带状疱疹的患者数约占患带状疱疹总人数的20%[3],疱疹位于三叉神经分布区和高龄是发生PHN的独立危险因素[4]。三叉神经分布区带状疱疹性神经痛的治疗难度较大,因此,探求有效的治疗方法以缓解疼痛,阻止其向后遗神经痛发展是临床治疗的主要目标。
前期研究[5]发现,半月神经节脉冲射频对亚急性期三叉神经带状疱疹性神经痛具有一定的缓解作用。短时程眶上神经电刺激治疗三叉神经眼支分布区急性和亚急性带状疱疹性神经痛,患者疼痛明显缓解,且疗效可持续至治疗后6个月[6]。2021年,本研究组报道了1例使用短时程眶下神经电刺激联合短时程高颈段脊髓电刺激(spinal cord stimulation,SCS)治疗三叉神经第2、3支PHN的病例[7],疼痛缓解超过90%,提示高颈段SCS可用于三叉神经下颌支PHN的临床治疗。但目前国内外尚无系统的研究报道。本研究对短时程高颈段SCS治疗三叉神经下颌支分布区急性、亚急性带状疱疹神经痛的疗效进行回顾性分析,进一步扩展丰富了短时程SCS的应用范围,为常规治疗难以控制的难治性头面部带状疱疹性神经痛治疗提供新思路和新方法。
1 材料与方法 1.1 临床资料回顾性分析中国医科大学附属第一医院疼痛科2018年1月至2020年12月收治的三叉神经下颌支分布区急性或亚急性带状疱疹性神经痛、并接受短时程高颈段SCS治疗患者的临床资料。纳入标准:符合三叉神经下颌支分布区带状疱疹性神经痛诊断;疼痛持续不超过3个月;曾接受规律药物治疗、物理治疗或其他微创介入治疗,但疼痛控制不理想[疼痛数字评分法(numeric rating scale,NRS)评分 > 4]或不良反应难以耐受者。排除标准:凝血障碍或应用抗凝剂,合并急性感染、穿刺部位炎症,并发严重的心肺、肾功能不全不能耐受手术者;颈椎核磁共振成像提示有骨质增生、畸形或占位性病变,影响电极置入者;妊娠期及哺乳期妇女;存在精神疾病及智能障碍无法完成自我评估问卷,不能配合随访者;失访超过180 d或因其他原因导致临床资料不完整者。本研究已获得中国医科大学附属第一医院伦理委员会审批(伦理号2021446),所有患者均已签署知情同意书。
1.2 治疗方法患者取俯卧位,X线引导下选择合适的椎间隙作为穿刺点,后外侧入路行硬膜外穿刺,针尖到达硬膜外腔后,置入电极(3189型神经刺激系统经皮电极套件,美国St. Jude Medical公司)。X线引导下将电极送至硬膜外腔顶端,影像学显示侧位像电极尖端位于C1、C2棘突之间(图 1A),正位像电极尖端位于寰椎侧块中线略外侧(图 1B)。然后连接程控仪进行电刺激测试,根据患者的反馈,调整电极位置及触点设置,使异常感觉覆盖原有疼痛区域。治疗期间如果患者自觉电流位置及强度发生变化,可调整刺激参数使异常感觉覆盖超过80%原有疼痛区域,电流强度以不引起患者不适为宜。治疗7~10 d后拔除电极,观察疗效。
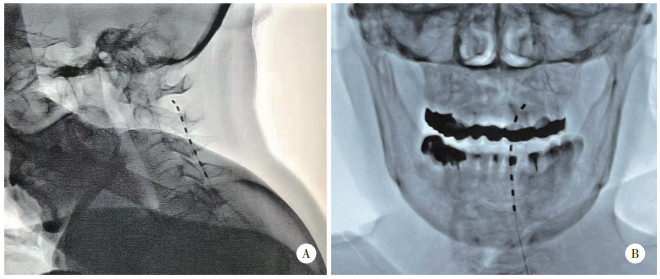
|
| 图 1 电极位于C1~2水平(A),寰椎侧块外侧(B) Fig.1 X-ray image of the electrode lead that reached the level of C1-2 (A), laterally to the lateral mass of atlas (B) |
1.3 观察指标 1.3.1 NRS评分
评价患者的疼痛缓解情况。分别记录治疗前及治疗后1、4、12和24周NRS评分。
1.3.2 普瑞巴林用量分别记录治疗前和治疗后1、4、12和24周时患者普瑞巴林的平均日用量,比较治疗前与治疗后各随访时间点的药物用量。
1.3.3 匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)评价患者的睡眠质量。PSQI量表包含助眠药品、入睡时间、睡眠障碍、睡眠质量、睡眠时间、睡眠效率及日间功能共7个维度,总分为21分,得分越高说明受试者的睡眠质量越差。记录治疗前及治疗后各随访时间点的PSQI。
1.3.4 SF-12健康调查量表(12-item short form health survey)评价患者的生活质量。量表包括角色功能(role physical,RP)、躯体疼痛(bodily pain,BP)、生理功能(physical functioning,PF)、活力(vitality,VT)、总体健康(general health,GH)、社会功能(social functioning,SF)、情感职能(role emotion,RE)、心理健康(mental health,MH)共8个维度。其中,RP、BP、PF、VT、GH反映患者的生理情况,SF、RE、MH反映患者的心理情况,最终得出生理总得分(physical component scores,PCS)和心理总得分(mental component scores,MCS)。记录治疗前及治疗后各随访时间点的PCS及MCS。
1.3.5 不良反应记录出血、感染、神经损伤等不良反应的发生情况。
1.4 统计学分析采用SPSS 21.0软件进行统计学分析,用Graph Pad Prism 8.0软件进行统计学绘图。正态计量资料用x±s表示,偏态计量资料用M(P25~P75)表示,采用Wilcoxon符号秩检验比较。双侧检验,P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料根据纳入排除标准,共纳入11例患者。其中,男5例,女6例,平均年龄(70.64±9.18)岁,体质量(61.59±7.47)kg,病程(1.86±0.90)个月。
2.2 治疗前后NRS评分、普瑞巴林用量、PSQI及SF-12量表得分比较与治疗前比较,治疗后各随访时间点NRS评分均显著降低,普瑞巴林平均日用量均显著减少,PSQI均显著下降,SF-12量表得分均显著升高,差异均有统计学意义(均P < 0.01)。见表 1。
| Item | Before treatment | 1 week after treatment | 4 weeks after treatment | 12 weeks after treatment | 24 weeks after treatment |
| NRS(x±s) | 7.27±0.65 | 3.18±0.98 | 2.91±1.14 | 3.27±0.90 | 3.09±1.04 |
| P | - | < 0.01 | < 0.01 | < 0.01 | < 0.01 |
| Dosage of pregabalin [M(P25-P75),mg/d] | 300(225 -300) | 75(0 -150) | 75(0 -75) | 75(75 -150) | 0(0 -50) |
| P | - | < 0.01 | < 0.01 | < 0.01 | < 0.01 |
| PSQI(x±s) | 16.36±1.43 | 7.91±2.47 | 7.27±2.33 | 8.55±2.62 | 8.00±3.16 |
| P | - | < 0.01 | < 0.01 | < 0.01 | < 0.01 |
| PCS(x±s) | 36.62±1.41 | 45.05±3.79 | 45.88±4.64 | 45.41±4.46 | 45.65±4.59 |
| P | - | < 0.01 | < 0.01 | < 0.01 | < 0.01 |
| MCS(x±s) | 34.30±2.36 | 45.77±3.90 | 45.13±4.03 | 45.68±4.07 | 45.53±3.80 |
| P | - | < 0.01 | < 0.01 | < 0.01 | < 0.01 |
2.3 不良反应
治疗及随访过程中所有患者均未见出血、感染、神经损伤等不良反应发生。
3 讨论三叉神经带状疱疹性神经痛有以下几个特点:下颌支受累时,疱疹和疼痛可侵及颜面部、口腔内侧壁及舌部,严重影响患者进食、说话、洗脸等日常活动,严重影响生活质量;受累的初级神经元为位于颅内的半月神经节,解剖位置特殊,行注射及脉冲射频等治疗难度较大;三叉神经的3个主要分支发出诸多小分支支配颜面部感觉,末梢神经多且复杂;与胸腰段带状疱疹性神经痛相比,病变位于三叉神经分布区时患者的疼痛更加剧烈,对抗惊厥及抗抑郁药物反应差,且疼痛更易发展为PHN。因此,临床上治疗三叉神经分布区带状疱疹性神经痛的难度较大。
高颈段SCS治疗头面部神经病理性疼痛的主要机制为会聚学说[8-9]:三叉神经脊束核尾核(trigemi-nal nucleus caudalis,TNC)是脊髓颈段后角胶状质和后角固有核向上的延续,是三叉神经核的3个感觉亚核之一,在头面部的痛、温觉信号的传导和处理中起重要作用。动物实验研究[10-11]表明,TNC可延伸至大鼠、猫和猴子的C2~C3水平,揭示了高颈段SCS治疗头面部疼痛的解剖机制,高颈段SCS直接刺激TNC,在二级神经元水平调控三叉神经神经病理性疼痛。2018年,VELÁSQUEZ等[12]报道了使用高颈段SCS治疗三叉神经区域神经病理性疼痛,刺激电极头端位于C1~C2水平,共有12名受试者接受了永久植入,术后平均电流异感覆盖率达81%,疼痛缓解60%以上,证明了高颈段SCS治疗三叉神经神经病理性疼痛的可行性和有效性。三叉神经脊束核位于脊髓背柱外侧,故本研究中将电极尖端置于寰椎侧块中线偏外侧,以便于成功引发患者原有疱疹疼痛区域,即下颌神经分布区的电流异感,通过对电流参数进行调节,电流异感能够覆盖超过80%的疼痛区域,大部分患者能够获得较稳定的电流覆盖。结果显示,与治疗前相比,治疗后1、4、12、24周患者的NRS评分、PSQI显著下降,SF-12量表PCS和MCS增加,差异有统计学意义。表明在治疗后各随访时间点患者的疼痛程度、睡眠质量、生活质量及情绪心理情况均得到改善,与VELÁSQUEZ等[12]的研究结果一致,进一步证明了高颈段SCS疗法的有效性。
既往前期研究[13]显示,短时程SCS治疗带状疱疹性神经痛的远期疗效优于背根节注射及脉冲射频,但有关三叉神经支配区带状疱疹性神经痛的报道较少。本研究中,有4例患者在入组前曾接受过半月神经节注射或脉冲射频术,但疼痛缓解不佳(术后NRS评分 > 4)。这4例患者在接受短时程高颈段SCS治疗1周时疼痛缓解均超过40%,其中3例患者疼痛缓解超过50%,且疗效可持续至24周。提示高颈段SCS的临床效果可能优于半月神经节注射及脉冲射频,且对半月神经节注射和脉冲射频治疗失败的患者具有补救效果,为难治性三叉神经下颌支带状疱疹性神经痛治疗提供了新思路。
目前可用于下颌神经神经病理性疼痛治疗的神经电刺激疗法主要包括高颈段SCS、半月神经节电刺激、下颌神经电刺激以及下颌区域电刺激。半月神经节电刺激经Hartel前入路法穿刺将电极送至卵圆孔内,电流异感确切,但可能出现脑脊液漏、颅内感染、神经损伤等严重并发症,风险较大[14]。周围神经电刺激疗法,如眶上神经和眶下神经电刺激,已被用于面部神经病理性疼痛的治疗,但有文献[15]认为该技术可能不适用于下颌神经及其分支,因电极导线在组织中走行距离过短,且位于咬肌等面部肌肉内或肌肉间隙中,随着患者说话、咀嚼等动作,电极移位无法避免。短时程高颈段SCS治疗过程中也存在电极移位的可能,相比于胸腰段,颈部活动度更大,电极移位的发生率更高。如何更好地避免电极移位造成治疗失败,是临床实践中亟需解决的问题,本研究组主要采取以下措施:(1)根据患者的具体情况,选择合适的胸段椎间隙作为进针点,缩短电极导线在体内走行距离,减小脊柱活动对电极位置的影响,并有利于术中将电极送至高颈段;(2)术中将电极送至硬膜外腔顶端,并妥善固定电极导线的皮肤外露部分,制作减压环;(3)术后指导患者绝对卧床48 h并佩戴颈托,在治疗期间尽量减少颈部的旋转及屈伸动作,以减小头颈部活动对电极位置的影响。
本研究具有一定局限性。首先,本研究为回顾性研究,采用电话随访的方式,随访指标多为患者自测指标,难以避免患者主观因素对结果的影响,可能造成一定偏移;此外,作为治疗下颌神经带状疱疹性神经痛的新技术,短时程高颈段SCS尚未广泛应用于临床,本研究样本量较小,且仅随访至治疗后半年,未能观察到治疗的远期效果。未来需开展多中心、大样本、长期随访的随机对照实验,采用更加客观的评价方法验证短时程高颈段SCS对三叉神经下颌支带状疱疹性神经痛的远期疗效,以期进一步指导临床实践。
综上所述,短时程高颈段SCS可有效缓解三叉神经下颌支急性或亚急性期带状疱疹性神经痛,减少止痛药物的使用,改善患者的睡眠质量和生活质量,为常规治疗效果差的难治性头面部带状疱疹性神经痛治疗提供了新思路和新方法。
| [1] |
SAMPATHKUMAR P, DRAGE LA, MARTIN DP. Herpes zoster (shingles) and postherpetic neuralgia[J]. Mayo Clin Proc, 2009, 84(3): 274-280. DOI:10.1016/S0025-6196(11)61146-4 |
| [2] |
SCHOLZ J, FINNERUP NB, ATTAL N, et al. The IASP classification of chronic pain for ICD-11:chronic neuropathic pain[J]. Pain, 2019, 160(1): 53-59. DOI:10.1097/j.pain.0000000000001365 |
| [3] |
PELLONI LS, PELLONI R, BORRADORI L. Herpes zoster of the trigeminal nerve with multi-dermatomal involvement: a case report of an unusual presentation[J]. BMC Dermatol, 2020, 20(1): 12. DOI:10.1186/s12895-020-00110-1 |
| [4] |
WEI SJ, LI XT, WANG HP, et al. Analysis of the risk factors for postherpetic neuralgia[J]. Dermatology, 2019, 235(5): 426-433. DOI:10.1159/000500482 |
| [5] |
赵定亮, 万成福, 董道松, 等. 半月神经节手动脉冲射频治疗三叉神经带状疱疹后神经痛临床研究[J]. 中国疼痛医学杂志, 2018, 24(7): 508-511, 516. DOI:10.3969/j.issn.1006-9852.2018.07.006 |
| [6] |
WAN CF, SONG T. Short-term peripheral nerve stimulation relieve pain for elder Herpes zoster ophthalmicus patients: a retrospective study[J]. Neuromodulation, 2021, 24(6): 1121-1126. DOI:10.1111/ner.13288 |
| [7] |
ZHAO L, SONG T. Case report: short-term spinal cord stimulation and peripheral nerve stimulation for the treatment of trigeminal postherpetic neuralgia in elderly patients[J]. Front Neurol, 2021, 12: 713366. DOI:10.3389/fneur.2021.713366 |
| [8] |
DEER TR, MEKHAIL N, PETERSEN E, et al. The appropriate use of neurostimulation: stimulation of the intracranial and extracranial space and head for chronic pain.Neuromodulation Appropriateness Consensus Committee[J]. Neuromodulation, 2014, 17(6): 551-570. DOI:10.1111/ner.12215 |
| [9] |
TOMYCZ ND, DEIBERT CP, MOOSSY JJ. Cervicomedullary junction spinal cord stimulation for head and facial pain[J]. Headache, 2011, 51(3): 418-425. DOI:10.1111/j.1526-4610.2010.01829.x |
| [10] |
STRASSMAN AM, MINETA Y, VOS BP. Distribution of fos-like immunoreactivity in the medullary and upper cervical dorsal horn produced by stimulation of dural blood vessels in the rat[J]. J Neurosci, 1994, 14(6): 3725-3735. DOI:10.1523/JNEUROSCI.14-06-03725.1994 |
| [11] |
KAUBE H, KEAY KA, HOSKIN KL, et al. Expression of c-Fos-like immunoreactivity in the caudal medulla and upper cervical spinal cord following stimulation of the superior sagittal sinus in the cat[J]. Brain Res, 1993, 629(1): 95-102. DOI:10.1016/0006-8993(93)90486-7 |
| [12] |
VELÁSQUEZ C, TAMBIRAJOO K, FRANCESCHINI P, et al. Upper cervical spinal cord stimulation as an alternative treatment in trigeminal neuropathy[J]. World Neurosurg, 2018, 114: e641-e646. DOI:10.1016/j.wneu.2018.03.044 |
| [13] |
王成龙, 宋涛. 短时程脊髓电刺激与背根神经节双极脉冲射频治疗带状疱疹后神经痛的疗效比较[J]. 中国医科大学学报, 2020, 49(3): 280-283. DOI:10.12007/j.issn.0258-4646.2020.03.019 |
| [14] |
TAUB E, MUNZ M, TASKER RR. Chronic electrical stimulation of the gasserian ganglion for the relief of pain in a series of 34 patients[J]. J Neurosurg, 1997, 86(2): 197-202. DOI:10.3171/jns.1997.86.2.0197 |
| [15] |
SLAVIN KV, WESS C. Trigeminal branch stimulation for intractable neuropathic pain: technical note[J]. Neuromodulation, 2005, 8(1): 7-13. DOI:10.1111/j.1094-7159.2005.05215.x |
 2023, Vol. 52
2023, Vol. 52




