文章信息
- 于冬冬
- YU Dongdong
- 藁本内酯对骨肉瘤细胞凋亡的影响及其作用机制
- Effect of ligustilide on osteosarcoma cell apoptosis and its mechanism of action
- 中国医科大学学报, 2023, 52(4): 301-307
- Journal of China Medical University, 2023, 52(4): 301-307
-
文章历史
- 收稿日期:2022-06-23
- 网络出版时间:2023-04-12 14:00:24
骨肉瘤是常见的原发性骨恶性肿瘤,治疗方法主要是新辅助化疗[1]。顺铂是骨肉瘤化疗常用药物,研究[2]发现细胞能够通过自噬这种生物学行为对顺铂产生抗凋亡的作用,因此抑制自噬能够促进细胞凋亡,提高顺铂的化疗效果。藁本内酯属于苯酞类化合物,是从当归、川芎等伞形科草本植物中萃取出的一种生物活性成分,具有抗炎、抗肿瘤等作用[3]。目前,藁本内酯对骨肉瘤的生物学作用还不清楚。本研究探讨藁本内酯对骨肉瘤细胞凋亡的影响及其作用机制,旨在为骨肉瘤的治疗提供新的思路。
1 材料与方法 1.1 实验药品、试剂与仪器藁本内酯(成都植标化纯生物有限公司),顺铂(北京索莱宝科技有限公司),胎牛血清(康源绿洲生物有限公司),CCK8试剂(德国Sigma公司),细胞周期检测试剂盒(美国Santa Cruz Biotechnology公司),Bcl-2抗体和Bax抗体(Santa Cruz Biotechnology公司),细胞色素C(cytochrome C,Cyt-C)抗体、Beclin 1抗体(美国Proteintech公司),LC3B抗体、自噬蛋白(autophagy related protein,ATG)3抗体(美国Cell Signaling Technology公司),羊抗鼠二抗、羊抗兔二抗(北京中衫金桥生物技术有限公司),ULK1抗体(中国博士德生物公司),酶标仪(德国Sigma公司),流式细胞仪(美国BD公司)。
1.2 实验方法 1.2.1 细胞培养人骨肉瘤MG-63细胞购于中科院上海细胞库。骨肉瘤细胞使用含有10%胎牛血清,1%青链霉素双抗的培养基置于37 ℃恒温培养箱中培养。
1.2.2 细胞毒性实验将处于对数生长期的骨肉瘤细胞5×103/孔接种于96孔板,待细胞贴壁后用20、40、80、160、320、640 μmol/L藁本内酯处理细胞24、48 h,以1‰甲醇处理MG-63作为对照组,加入CCK8试剂采用酶标仪测定,绘制抑制率曲线。选取浓度80、160、320 μmol/L藁本内酯与顺铂(0、2、4、8、16 μg/mL)联合使用24 h,测定联合用药的最佳浓度。
1.2.3 细胞划痕实验将处于对数生长期的骨肉瘤细胞1×104/孔接种于6孔板,待细胞贴壁后用10 μL的枪头进行划痕,PBS清洗,实验组加入含有藁本内酯(160 μmol/L)的培养基(3 mL),以1‰甲醇处理对照组,放入恒温培养箱培养。培养0、24、48 h时取样并照相。
1.2.4 流式细胞周期实验骨肉瘤细胞MG-63清洗、消化、离心、重新混悬后以5×103/孔均匀铺在6孔板中,分别采用浓度0、40、80、160、320 μmol/L藁本内酯(3 mL)处理24 h,以1‰甲醇处理MG-63作为对照组。将各组细胞清洗、消化、离心,固定后加入细胞凋亡试剂盒中的PI/RNase混匀,4 ℃条件下孵育30 min后流式细胞仪进行检测。
1.2.5 Western blotting检测骨肉瘤MG-63细胞经过消化离心后以5×103/孔均匀铺在6孔板上。将细胞分为对照组(1‰甲醇处理MG-63)、顺铂(16 μg/mL,DDP)组、藁本内酯联合顺铂(16 μg/mL顺铂+160 μmol/L藁本内酯,DDP+LIG)组、顺铂+3-甲基腺嘌呤(3-methyladenine,3MA)(16 μg/mL顺铂+6 mmol/L 3MA,DDP+3MA)组。各组药物处理24 h后进行蛋白质提取、测定蛋白浓度、电泳、转膜、加入一抗、TBST清洗、加二抗、孵育,以GAPDH为内参,ECL显色成像获取蛋白条带,Image J软件分析蛋白条带灰度值。
1.2.6 免疫荧光实验将骨肉瘤MG-63细胞消化离心后以5×103/孔均匀铺在6孔板上,细胞贴壁后分别用顺铂(16 μg/mL)、顺铂(16 μg/mL)+藁本内酯(160 μmol/L)、顺铂(16 μg/mL)+3MA(6 mmol/L)处理细胞24 h,以1‰甲醇处理细胞作为对照组。冰PBS漂洗5 min,清洗3次,4%预冷处理的多聚甲醛固定MG-63细胞20 min,0.1%Triton X-100破膜10 min,加入0.75% H2O2-PBS孵育30 min,滴加适量PBS稀释一抗,然后放入4 ℃冰箱过夜,次日PBS适当稀释和二抗孵育30 min,加入适量PBS稀释免疫荧光试剂,封片,荧光显微镜采集图片。
1.3 统计学分析利用SPSS 25.0软件进行统计学分析。计量资料采用x±s表示,组间比较采用单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 细胞毒性实验结果不同浓度(20、40、80、160、320、640 μmol/L)藁本内酯处理骨肉瘤细胞24 h、48 h的结果显示,随着藁本内酯浓度升高,骨肉瘤细胞抑制率明显增加(P < 0.01),见表 1。不同浓度(0、2、4、8、16 μg/mL)顺铂联合藁本内酯(80、160、320 μmol/L)处理骨肉瘤细胞24 h的结果显示,随着顺铂和藁本内酯浓度增高,骨肉瘤细胞抑制率明显增高(P < 0.01),见表 2。16 μg/mL顺铂联合160 μmol/L藁本内酯干预骨肉瘤细胞24 h,细胞抑制率接近半数,因此选用此浓度联合用药用于后续实验。
| Group | Proliferation inhibit rate of osteosarcoma cells | |
| 24 h | 48 h | |
| 0 μmol/L ligustilide | 2±1 | 2±1 |
| 20 μmol/L ligustilide | 2±1 | 2±1 |
| 40 μmol/L ligustilide | 4±1 | 7±1 |
| 80 μmol/L ligustilide | 9±1 | 15±11) |
| 160 μmol/L ligustilide | 15±21) | 40±42) |
| 320 μmol/L ligustilide | 39±42) | 63±42) |
| 640 μmol/L ligustilide | 71±22) | 85±42) |
| 1)P < 0.05,2)P < 0.01 compared with 0 μmol/L ligustilide group. | ||
| Group | Proliferation inhibit rate of osteosarcoma cells | ||
| 80 μmol/L ligustilide | 160 μmol/L ligustilide | 320 μmol/L ligustilide | |
| 0 μg/mL cisplatin | 9±1 | 15±2 | 39±4 |
| 2 μg/mL cisplatin | 10±1 | 29±2 | 61±31) |
| 4 μg/mL cisplatin | 15±1 | 33±3 | 64±31) |
| 8 μg/mL cisplatin | 31±32) | 36±32) | 67±41) |
| 16 μg/mL cisplatin | 46±51) | 48±21) | 77±61) |
| 1)P < 0.01,2)P < 0.05 compared with 0 μg/mL cisplatin group in the same concentration ligustilide. | |||
2.2 细胞划痕实验结果
细胞划痕实验结果显示,与对照组比较,藁本内酯(160 μmol/L)作用24 h、48 h时骨肉瘤细胞迁移速率明显降低(P < 0.05),见图 1、表 3。
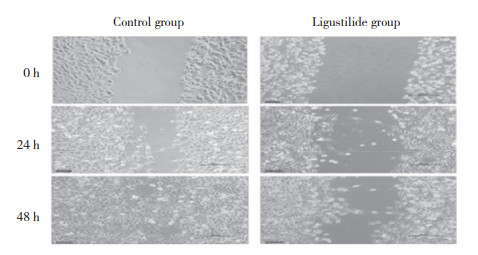
|
| 图 1 藁本内酯对骨肉瘤细胞迁移的影响×10 Fig.1 Effect of ligustilide on osteosarcoma cell migration ×10 |
| Group | Migration of osteosarcoma cells | ||
| 0 h | 24 h | 48 h | |
| Control | 0±0.00 | 63.70±6.53 | 97.30±0.82 |
| Ligustilide | 0±0.00 | 10.30±1.321) | 15.93±2.951) |
| 1)P < 0.05 compared with the control group at the same time. | |||
2.3 流式细胞仪检测结果
流式细胞仪检测结果显示,随着藁本内酯浓度增加,G2/M期骨肉瘤细胞比例显著增加(均P < 0.01),G0/G1期骨肉瘤细胞比例下降(均P < 0.01),说明藁本内酯将骨肉瘤细胞周期阻滞在了G2/M期,见图 2。
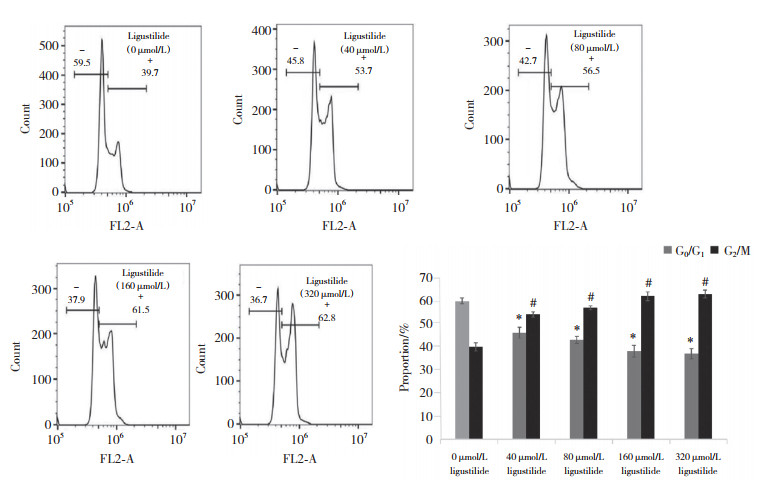
|
| *P < 0.01, #P < 0.05 vs 0 μmol/L ligustilide group. 图 2 流式细胞仪检测结果 Fig.2 Flow cytometry results |
2.4 Western blotting检测结果
结果显示,与对照组比较,DDP组Cyt-C表达增高(P < 0.01),促凋亡蛋白Bax表达增高(P < 0.05),抗凋亡蛋白Bcl-2表达降低(P < 0.01)。与DDP组比较,DDP+LIG组Bax表达增高(P < 0.01),Bcl-2表达降低(P < 0.01),Cyt-C表达增高(P < 0.01),说明DDP+LIG组骨肉瘤细胞凋亡更显著。与DDP组比较,DDP+3MA组抗凋亡蛋白Bcl-2表达降低(P < 0.01),促凋亡蛋白Bax表达增高(P < 0.05),见图 3。
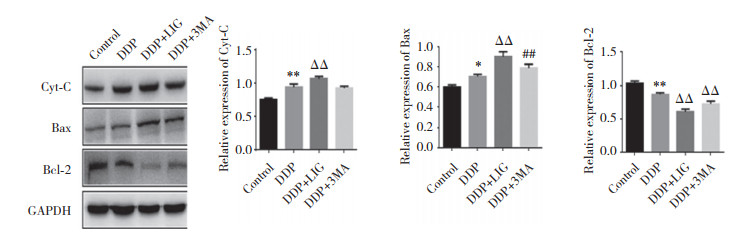
|
| ** P < 0.01 compared with the control group; ΔΔ P < 0.01, ## P < 0.05 compared with the DDP group. 图 3 藁本内酯联合顺铂对骨肉瘤细胞凋亡的影响 Fig.3 Effect of ligustilide combined with cisplatin on osteosarcoma cell apoptosis |
自噬蛋白检测结果如图 4所示,与对照组比较,DDP组自噬蛋白LC3B、Beclin 1表达增高(均P < 0.05),说明顺铂能够促进骨肉瘤细胞自噬。与DDP组比较,DDP+LIG组自噬蛋白LC3B、Beclin 1表达降低(均P < 0.05),说明藁本内酯起到了抑制骨肉瘤细胞自噬的作用。与对照组比较,DDP组ULK1、ATG3表达增加(均P < 0.01),说明该通路被激活。与DDP组比较,DDP+LIG组ULK1、ATG3表达均降低(均P < 0.05),说明藁本内酯有抑制ULK1、ATG3信号通路的作用。与DDP组比较,DDP+3MA组ULK1、ATG3表达均降低(均P < 0.05),说明藁本内酯抑制自噬的作用机制可能是通过ULK1、ATG3信号通路实现的。
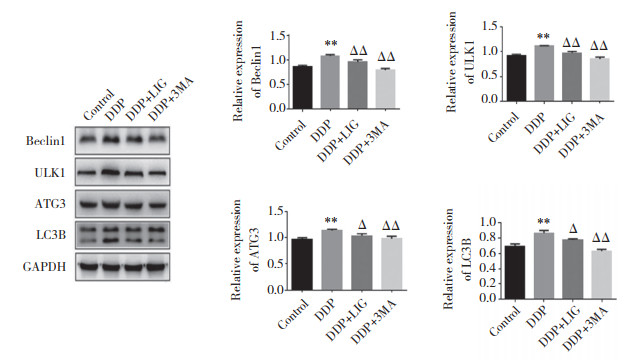
|
| ** P < 0.01 compared with the control group; ΔΔ P < 0.01, Δ P < 0.05 compared with the DDP group. 图 4 藁本内酯联合顺铂对骨肉瘤细胞自噬的影响 Fig.4 Effect of ligustilide combined with cisplatin on osteosarcoma cell autophagy |
2.5 免疫荧光实验结果
结果显示,DDP组发光自噬体(标记的LC3B)数量较对照组增多,说明DDP组诱导骨肉瘤细胞发生了自噬。DDP+LIG组发光自噬体数量少于DDP组,说明藁本内酯能够降低细胞自噬。DDP+3MA组与DDP+LIG组发光自噬体数量都较DDP组少,说明藁本内酯起到了与自噬抑制剂3MA相同的抑制自噬作用,见图 5。
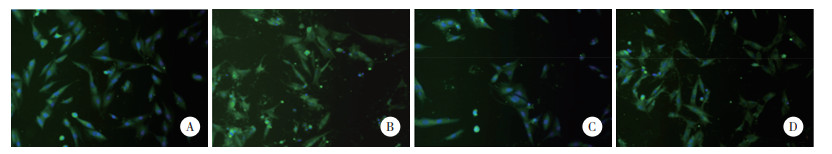
|
| A, control group; B, DDP group; C, DDP+LIG group; D, DDP+3M group. 图 5 各组免疫荧光实验LC3B表达的检测结果×200 Fig.5 LC3B expression in the four treatment groups detected by immunofluorescence assay ×200 |
3 讨论
顺铂是骨肉瘤常用化疗药物,但容易产生耐药性,这成为骨肉瘤治疗的障碍[4]。近年来,中药提取物与化疗药物结合的方式受到普遍关注。藁本内酯是从伞形科植物当归中提取出来的一种淡黄色油性物质。藁本内酯很不稳定,容易发生氧化、水解等异构化反应。研究[5-7]显示藁本内酯作用广泛,具有抗动脉粥样硬化、抗老年痴呆、改善脑部供血等多种药理学作用。研究[8]发现,骨肉瘤增殖过程中细胞周期进程加速,促进了骨肉瘤的增殖和转移。也有研究[9-10]发现骨肉瘤中miRNA-506-3p表达降低,导致CDK4表达增加,促进了骨肉瘤增殖;此外,细胞周期蛋白(cyclinD1)过度表达可缩短细胞G1期到S期的过程,促使细胞更快完成DNA复制[11]。因此,调控细胞周期蛋白也是治疗骨肉瘤的潜在靶点。本研究结果显示,藁本内酯能够抑制骨肉瘤细胞增殖、迁移,将骨肉瘤细胞周期阻滞在G2/M期,因此认为可能是通过阻滞细胞周期来抑制骨肉瘤的进展。
Bcl-2是内线粒体膜蛋白,可阻断程序性细胞死亡[12]。Bax是骨肉瘤中常见的促凋亡蛋白[13]。Cyt-C是线粒体损伤的标志物[14],释放到细胞质基质中会触发半胱天冬酶-9和半胱天冬酶-3裂解以诱导细胞凋亡[15]。本研究结果显示,与DDP组比较,DDP+LIG组Cyt-C和Bax表达增高,Bcl-2表达降低(均P < 0.05),骨肉瘤细胞凋亡更显著,说明藁本内酯能够协助顺铂发挥更大的促进骨肉瘤细胞凋亡的作用。
Beclin 1是自噬启动因子,Beclin 1激活能够诱导自噬发生[16]。LC3是自噬过程中第1个自噬小体膜蛋白,也是自噬过程中产生的典型标志物,LC3经过蛋白内切酶的剪切形成膜结合形式的LC3B,LC3B表达与自噬呈正相关[17-18]。与DDP组比较,DDP+LIG组自噬蛋白LC3B、Beclin 1表达降低,同时免疫荧光结果显示DDP+LIG组中被标记的LC3B荧光体数量也减少,说明藁本内酯起到了抑制骨肉瘤细胞自噬的作用。
ULK1是负责自噬启动部分的调控因子[19],与其他ATG101等相关自噬蛋白结合形成多数自噬必需的ULK复合体。以往研究[20]发现ULK1参与调控的自噬信号通路与乳腺癌、肝癌高度相关。ATG基因是形成自噬体的重要组成部分,ATG3是参与自噬的关键基因之一,其同源物在真核生物中常见。有研究[21]发现ATG3是自噬发挥抗肿瘤作用的重要信号通路。本研究结果显示,与DDP组比较,DDP+LIG组ULK1、ATG3表达降低(均P < 0.05),说明藁本内酯能够抑制此自噬通路,可能的机制是通过抑制ULK1/ATG3信号通路来完成的。
综上所述,藁本内酯能够抑制骨肉瘤细胞增殖、迁移,阻滞细胞周期,促进细胞凋亡。藁本内酯联合顺铂能够抑制自噬来促进细胞凋亡,其作用机制可能是通过抑制ULK1/ATG3信号通路实现的。本研究集中于藁本内酯对骨肉瘤细胞抑制增殖或促进凋亡方面,方向较为单一,且目前仅用单味中药治疗骨肉瘤很难取得明显疗效,未来还需进一步研究论证。
| [1] |
TANG HJ, LIU DH, LU JL, et al. Significance of the neutrophil-to-lymphocyte ratio in predicting the response to neoadjuvant chemotherapy in extremity osteosarcoma: a multicentre retrospective study[J]. BMC Cancer, 2022, 22(1): 33. DOI:10.1186/s12885-021-09130-7 |
| [2] |
PATEL N, XU J, SALEH T, et al. Influence of nonprotective autophagy and the autophagic switch on sensitivity to cisplatin in non-small cell lung cancer cells[J]. Biochem Pharmacol, 2020, 175: 113896. DOI:10.1016/j.bcp.2020.113896 |
| [3] |
CHAKRAVARTHI PS, KATTIMANI VS, PRASAD LK, et al. Juxtacortical osteosarcoma of the mandible: challenges in diagnosis and management[J]. Natl J Maxillofac Surg, 2015, 6(1): 127-131. DOI:10.4103/0975-5950.168232 |
| [4] |
WANG J, ZHANG ZJ, QIU C, et al. MicroRNA-519d-3p antagonizes osteosarcoma resistance against cisplatin by targeting PD-L1[J]. Mol Carcinog, 2022, 61(3): 322-333. DOI:10.1002/mc.23370 |
| [5] |
龚彦胜, 李晓宇, 孙蓉. 基于功效与药理作用川芎抗冠心病心绞痛的物质基础研究进展[J]. 中国药物警戒, 2011, 8(11): 675-678. DOI:10.3969/j.issn.1672-8629.2011.11.012 |
| [6] |
陈永红, 赵林霞, 范冰冰, 等. 藁本内酯抑制星形胶质细胞中NF-κB依赖的细胞因子的表达[J]. 临床麻醉学杂志, 2014, 30 (11): 1121-1124. DOI: CNKI:SUN:LCM.0.2014-11-027.
|
| [7] |
杨金颖, 李津津. 藁本内酯对缺血性脑损伤的保护作用[J]. 内蒙古中医药, 2015, 34(7): 147-148. DOI:10.16040/j.cnki.cn15-1101.2015.07.146 |
| [8] |
ROCH-LEFEVRE S, DAINO K, ALTMEYER-MOREL S, et al. Cytogenetic and molecular characterization of plutonium-induced rat osteosarcomas[J]. J Radiat Res, 2010, 51(3): 243-250. DOI:10.1269/jrr.09110 |
| [9] |
WANG JS, QIU C, ZHANG ZJ, et al. MicroRNA-506-3p inhibits osteosarcoma cell proliferation and metastasis by suppressing RAB3D expression[J]. Aging, 2018, 10(6): 1294-1305. DOI:10.18632/aging.101468 |
| [10] |
CHENG S, ZHANG X, HUANG N, et al. Down-regulation of S100A9 inhibits osteosarcoma cell growth through inactivating MAPK and NF-κB signaling pathways[J]. BMC Cancer, 2016, 16: 253. DOI:10.1186/s12885-016-2294-1 |
| [11] |
ZARE A, AHADI A, LARKI P, et al. The clinical significance of miR-335, miR-124, miR-218 and miR-484 downregulation in gastric cancer[J]. Mol Biol Rep, 2018, 45(6): 1587-1595. DOI:10.1007/s11033-018-4278-5 |
| [12] |
HOCKENBERY D, NUÑEZ G, MILLIMAN C, et al. Bcl-2 is an inner mitochondrial membrane protein that blocks programmed cell death[J]. Nature, 1990, 348(6299): 334-336. DOI:10.1038/348334a0 |
| [13] |
NING RD, CHEN G, FANG R, et al. Diosmetin inhibits cell proliferation and promotes apoptosis through STAT3/c-Myc signaling pathway in human osteosarcoma cells[J]. Biol Res, 2021, 54(1): 40. DOI:10.1186/s40659-021-00363-1 |
| [14] |
TUNG FI, CHEN LC, WANG YC, et al. Using a hybrid radioenhancer to discover tumor cell-targeted treatment for osteosarcoma: an in vi-tro study[J]. Curr Med Chem, 2021, 28(19): 3877-3889. DOI:10.2174/0929867327666201118155216 |
| [15] |
WANG GS, CHEN JY, CHEN WC, et al. Surfactin induces ER stress-mediated apoptosis via IRE1-ASK1-JNK signaling in human osteosarcoma[J]. Environ Toxicol, 2022, 37(3): 574-584. DOI:10.1002/tox.23423 |
| [16] |
ZHU MT, DENG GT, XING CS, et al. BECN2 (beclin 2) -mediated non-canonical autophagy in innate immune signaling and tumor development[J]. Autophagy, 2020, 16(12): 2310-2312. DOI:10.1080/15548627.2020.1839277 |
| [17] |
SHU-JYUAN, CHANG, B S, et al. Decreased expression of autophagy protein LC3 and stemness (CD44+/CD24-/low) indicate poor prognosis in triple-negative breast cancer[J]. Hum Pathol, 2016, 48: 48-55. DOI:10.1016/j.humpath.2015.09.034 |
| [18] |
YANG AM, PANTOOM S, WU YW. Elucidation of the anti-autophagy mechanism of the Legionella effector RavZ using semisynthetic LC3 proteins[J]. eLife, 2017, 6: e23905. DOI:10.7554/eLife.23905 |
| [19] |
KUROYANAGI H, YAN J, SEKI N, et al. Human ULK1, a novel serine/threonine kinase related to UNC-51 kinase ofCaenorhabditis elegans: cDNA cloning, expression, and chromosomal assignment[J]. Genomics, 1998, 51(1): 76-85. DOI:10.1006/geno.1998.5340 |
| [20] |
WEN X, WU JM, WANG FT, et al. Deconvoluting the role of rea-ctive oxygen species and autophagy in human diseases[J]. Free Radic Biol Med, 2013, 65: 402-410. DOI:10.1016/j.freeradbiomed.2013.07.013 |
| [21] |
FANG D, XIE H, HU T, et al. Binding features and functions of ATG3[J]. Front Cell Dev Biol, 2021, 9: 685625. DOI:10.3389/fcell.2021.685625 |
 2023, Vol. 52
2023, Vol. 52




