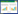文章信息
- 郑金丹, 于晓萌, 张逸文, 王莉
- ZHENG Jindan, YU Xiaomeng, ZHANG Yiwen, WANG Li
- Toll样受体4参与卵巢癌细胞增殖与凋亡的调控
- Toll-like receptor 4 regulates proliferation and apoptosis of ovarian cancer cells
- 中国医科大学学报, 2023, 52(3): 242-246
- Journal of China Medical University, 2023, 52(3): 242-246
-
文章历史
- 收稿日期:2020-03-04
- 网络出版时间:2023-03-15 16:41:22
2. 锦州市妇婴医院妇产科, 辽宁 锦州 121001
2. Department of Obstetrics and Gynecology, Jinzhou Women and Infants Hospital, Jinzhou 121001, China
卵巢癌是常见的女性生殖器官恶性肿瘤,发病率仅次于子宫颈癌和子宫内膜癌[1]。由于卵巢癌早期症状不典型,多数患者确诊时已为中晚期,而晚期患者5年生存率仅29%[2],死亡率居妇科肿瘤的首位。卵巢癌的治疗原则以手术为主,辅以化疗,部分患者还可使用靶向药物等。尽管早期治疗效果较明显,但大部分患者要面临2年后复发的风险,最终发生转移、死亡[3-4]。
近年来,研究[5-8]发现,Toll样受体4(Toll-like receptor 4,TLR4)与恶性肿瘤的发展有关,TLR4的异常表达参与了结直肠癌、肝癌、前列腺癌和胶质母细胞瘤等多种肿瘤的发生发展。目前,关于TLR4与卵巢癌关系的研究较少,因此,本研究拟探讨TLR4的异常表达对卵巢癌细胞增殖与凋亡的影响。
1 材料与方法 1.1 材料 1.1.1 标本来源收集2018年1月至2019年1月在锦州医科大学附属第一医院妇科行卵巢癌活检的卵巢癌及癌旁正常组织各20例。所有患者术前均未接受任何化疗或放疗。采集的组织标本立即置入-80 ℃液氮中冻存待用。本研究获得锦州医科大学附属第一医院医学伦理委员会批准。所有患者均知情同意。
1.1.2 细胞及试剂人卵巢癌细胞株SKOV3购自上海生物化学与细胞生物研究所。McCOY’s 5A培养基(中国普诺赛公司),胎牛血清(中国四季青公司),CCK-8、细胞凋亡检测试剂盒(中国万类生物公司),Lipofectamine 2000(美国Invitrogen公司),全蛋白提取试剂盒、SDS-PAGE凝胶快速制备试剂盒、β-actin抗体(中国wanleibio公司),TLR4抗体(中国ABclonal公司),TRIpure、Super M-MLV反转录酶(中国BioTeke公司)。
1.2 方法 1.2.1 免疫组化法检测卵巢癌组织中TLR4的表达10%甲醛固定组织标本,石蜡包埋,制4 µm厚切片。切片脱蜡至水,抗原修复,过氧化氢孵育,山羊血清封闭。加入相应的特异性TLR4一抗孵育过夜,加入辣根过氧化物酶标记的二抗,DAB染色细胞核。苏木精复染,脱水。显微镜下观察染色效果,400倍镜下拍照。
1.2.2 细胞转染SKOV3细胞生长至90%融合后传代处理。取对数生长期细胞,按照Lipofectamine 2000转染试剂盒说明书进行转染。实验组细胞转染TLR4 siRNA(siRNA1、siRNA2、siRNA3),阴性对照(NC)组转染不针对任何基因的siRNA,空白对照(Control)组不做任何处理。收集转染细胞,在饱和湿度条件下的细胞培养箱中培养,用于后续实验。转染siRNA序列见表 1。
| siRNA | Sequence(5’-3’) |
| NC TLR4 | GATCCCCTTCTCCGAACGTGTCACGTTTCAAGAGAACGTGACACGTTCGGAGAATTTTT |
| AGCTAAAAATTCTCCGAACGTGTCACGTTCTCTTGAAACGTGACACGTTCGGAGAAGGG | |
| TLR4 siRNA1 | AGGTCAAGTTTCTCAGCTC |
| AGGTCAAGTTTCTCAGCTC | |
| TLR4 siRNA2 | ACTTATAGACCAGAACTGC |
| ACTTATAGACCAGAACTGC | |
| TLR4 siRNA3 | ACTAGCTCATTCCTTACCC |
| ACTAGCTCATTCCTTACCC |
1.2.3 实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,qRT-PCR)检测TLR4 mRNA相对表达量
用TRIpure分离试剂从SKOV3细胞中提取总RNA,反转录cDNA。PCR反应体系:cDNA模板1 μL;上下游引物(10 μmol/L)各0.5 μL;SYBR GREEN mastermix 10 μL;用ddH2O补足至20 μL。反应条件:94 ℃5 min;94 ℃10 s,60 ℃20 s,72 ℃ 30 s,40个循环;72 ℃5 min。β-actin作为内参照。TLR4正向引物序列5’-GACCTGTCCCTGAACCCTA-3’,反向引物序列5’-TCTCCCAGAACCAAACGA-3’;β-actin正向引物序列5’-CTTAGTTGCGTTACACCCTTTCTTG-3’,反向引物序列5’-CTGTCACCTTCACCGTTCCAGTTT-3’。用2-ΔΔCt法计算mRNA相对表达量。
1.2.4 Western blotting检测TLR4蛋白表达水平裂解细胞并提取总蛋白,行SDS-PAGE电泳,转至PVDF膜,5%BSA封闭。加入TLR4一抗(1∶1 000稀释),4 ℃孵育过夜。TBST洗膜,加入二抗,室温下孵育1 h。ECL显影。用凝胶图像处理系统(Gel-Pro-Analyzer)分析目标条带的光密度值。
1.2.5 CCK-8法检测细胞增殖与凋亡分别培养细胞6 h、12 h、24 h,加入CCK-8,继续培养2 h。酶标仪测定450 nm处吸光度值。收集各组细胞,1 000 g离心5 min,PBS清洗2次,弃上清,加入500 μL Binding buffer轻轻重悬细胞。先后加入Annexin V-FITC 5 μL、Propidium Iodide 10 μL并摇匀。室温下避光孵育15 min,用流式细胞仪检测。
1.3 统计学分析采用SPSS 26.0软件进行统计学分析。计量资料用x±s表示,多组间均数比较采用单因素方差分析LSD检验,组间两两比较采用独立样本t检验。P < 0.05为差异有统计学意义。所有实验均行独立的重复实验。
2 结果 2.1 卵巢癌组织中TLR4表达水平升高免疫组化结果(图 1)显示,TLR4在卵巢癌及其周围正常组织中均有表达。Image J软件分析结果发现,卵巢癌组织中TLR4表达量明显高于癌旁正常组织,差异有统计学意义(P < 0.05)。
|
| A, paracancerous tissues; B, ovarian cancer tissues. 图 1 TLR4在卵巢癌组织中表达上调×400 Fig.1 Upregulated expression of TLR4 in ovarian cancer tissues ×400 |
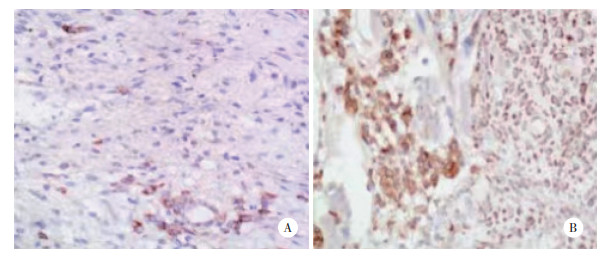
2.2 转染siRNA抑制SKOV3细胞TLR4 mRNA及蛋白表达
qRT-PCR及Western blotting结果(图 2)显示,卵巢癌SKOV3细胞转染相应siRNA 48 h后,细胞中TLR4 mRNA及蛋白的表达均明显受到抑制,差异有统计学意义(P < 0.05)。
|
| A, TLR4 mRNA expression detected by RT-PCR; B, TLR4 protein expression detected by Western blotting. *P < 0.05 vs NC TLR4. 图 2 各组细胞中TLR4 mRNA及蛋白表达情况 Fig.2 TLR4 mRNA and protein expression in cells of each groups |
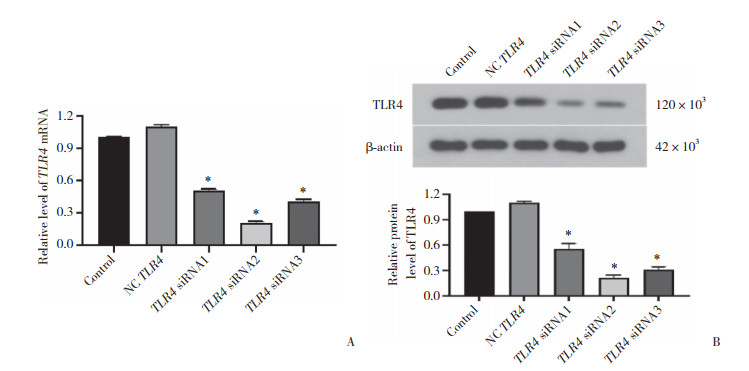
2.3 TLR4 siRNA对SKOV3细胞增殖和凋亡的影响
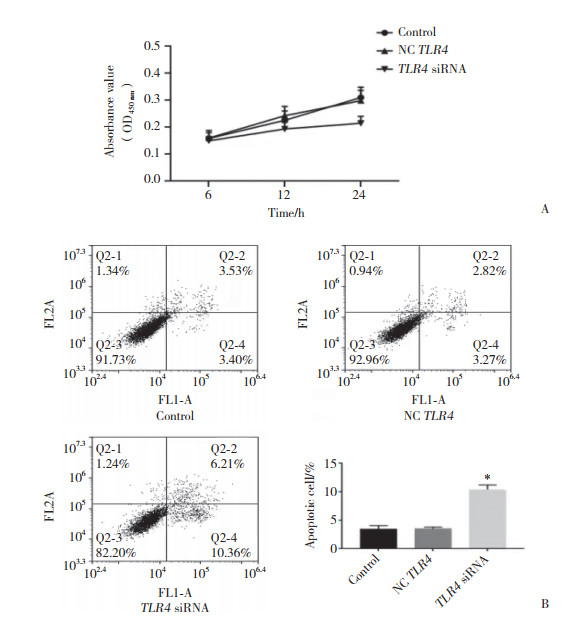
CCK-8法检测TLR4 siRNA转染SKOV3细胞6~24 h后细胞生长情况,流式细胞仪检测细胞转染24 h后凋亡情况。结果(图 3)显示,siRNA转染细胞24 h后,SKOV3细胞增殖活力下降,细胞凋亡率升高,差异有统计学意义(P < 0.05)。
|
| A, cell viability was evaluated utilizing CCK-8;B, cell apoptosis was detected by flow cytometry. *P < 0.05 vs NC TLR4. 图 3 TLR4 siRNA抑制SKOV3细胞增殖,促进细胞凋亡 Fig.3 TLR4 siRNA inhibited the proliferation and promoted apoptosis of SKOV3 cells |
3 讨论
卵巢癌早期症状不典型,且尚无可靠的筛查方法,导致大多数卵巢癌在发展至晚期后才被发现,并常伴有转移,预后极差。目前,卵巢癌初始治疗通常为手术治疗(细胞减灭术)辅以铂类为基础的化疗[9]。寻找卵巢癌发生发展的关键靶点,有助于探讨卵巢癌的发生机制,为卵巢癌的诊断与治疗提供新的思路。
Toll样受体(Toll-like receptors,TLRs)是一类跨膜模式识别受体发挥作用的非催化受体,在炎症和肿瘤发生中起重要作用[10-11]。目前在人类及哺乳动物中已发现11个TLRs家族成员,其中了解比较清楚的是TLR2、TLR4、TLR5和TLR9[12]。TLRs的激活可引发一系列的细胞内信号传导事件,通过诱导促炎性细胞因子及趋化因子等,刺激先天性免疫和适应性免疫的激活,最终促进炎症反应。研究发现,TLRs能够识别肿瘤发生发展过程中产生的相应内源性配体,从而发挥其免疫监视功能。其中,TLR4不但可识别外源的病原体,还可识别内源性物质及降解物。越来越多的证据表明,TLR4信号通路与多种癌症的进展有关,如皮肤黑色素瘤、肺腺癌、胰腺癌和乳腺癌[13-17]。因此,TLR4在卵巢癌细胞中的作用值得进一步深入研究。
本研究结果发现,TLR4在卵巢癌及癌周正常组织中均有表达,且卵巢癌组织中TLR4的表达量明显高于癌旁正常组织。提示TLR4的表达与卵巢癌有关。
为了进一步明确TLR4异常表达是否参与了卵巢癌细胞增殖与凋亡的调控,本研究通过构建并转染针对TLR4基因的siRNA至人卵巢癌细胞株SKOV3,采用qRT-PCR和Western blotting观察了细胞中TLR4 mRNA和蛋白的表达情况。结果显示,沉默TLR4的表达后,SKOV3细胞中TLR4的mRNA和蛋白表达水平均显著下降。本研究还采用CCK-8和流式细胞仪检测了转染后SKOV3细胞的增殖和凋亡情况,发现沉默TLR4表达可显著抑制SKOV3细胞的增殖,并诱导其凋亡。表明TLR4参与了卵巢癌SKOV3细胞的增殖与凋亡的调控。
综上所述,本研究发现卵巢癌组织中TLR4表达增高,沉默TLR4的表达可抑制卵巢癌细胞增殖,并诱发其凋亡。然而其具体作用机制尚不明确,因此,本研究组下一步将针对TLR4介导的下游信号通路进行研究,以明确其参与调控的可能的分子机制。
| [1] |
程亮亮, 刘哲, 于显凤. MSCT联合CEA、Ki-67及CA125检测对卵巢癌的诊断价值[J]. 中国CT和MRI杂志, 2021, 19(3): 104-106. DOI:10.3969/j.issn.1672-5131.2021.03.035 |
| [2] |
LHEUREUX S, GOURLEY C, VERGOTE I, et al. Epithelial ovarian cancer[J]. Lancet, 2019, 393(10177): 1240-1253. DOI:10.1016/S0140-6736(18)32552-2 |
| [3] |
张京顺, 徐影, 郑连文. 卵巢癌耐药机制的研究进展[J]. 中国妇幼保健, 2018, 33(2): 474-478. DOI:10.7620/zgfybj.j.issn.1001-4411.2018.02.80 |
| [4] |
王根生, 王悦. 卵巢癌微环境与化疗耐药发生相关的研究进展[J]. 肿瘤, 2020, 40(1): 68-75. DOI:10.3781/j.issn.1000-7431.2020.55.747 |
| [5] |
MAKKAR S, RIEHL TE, CHEN BS, et al. Hyaluronic acid binding to TLR4 promotes proliferation and blocks apoptosis in colon cancer[J]. Mol Cancer Ther, 2019, 18(12): 2446-2456. DOI:10.1158/1535-7163.MCT-18-1225 |
| [6] |
CHEN YY, PENG Y, YU JH, et al. Invasive Fusobacterium nucleatum activates beta-catenin signaling in colorectal cancer via a TLR4/P-PAK1 cascade[J]. Oncotarget, 2017, 8(19): 31802-31814. DOI:10.18632/oncotarget.15992 |
| [7] |
WANG W, WANG JY. Toll-like receptor 4 (TLR4)/cyclooxygenase-2 (COX-2) regulates prostate cancer cell proliferation, migration, and invasion by NF-κB activation[J]. Med Sci Monit, 2018, 24: 5588-5597. DOI:10.12659/MSM.906857 |
| [8] |
ALVARADO AG, THIAGARAJAN PS, MULKEARNS-HUBERT EE, et al. Glioblastoma cancer stem cells evade innate immune suppression of self-renewal through reduced TLR4 expression[J]. Cell Stem Cell, 2017, 20(4): 450-461. DOI:10.1016/j.stem.2016.12.001 |
| [9] |
GUO RW, XU Q, LIU LW, et al. Bioactive hexapeptide reduced the resistance of ovarian cancer cells to DDP by affecting HSF1/HSP70 signaling pathway[J]. J Cancer, 2021, 12(20): 6081-6093. DOI:10.7150/jca.62285 |
| [10] |
DWORZANSKA A, POLZ-DACEWICZ M. The role of Toll-like receptors (TLRs) in virus-related cancers: a mini review[J]. Curr Issues Pharm Med Sci, 2020, 33(4): 225-227. DOI:10.2478/cipms-2020-0038 |
| [11] |
李玉华. Toll样受体信号转导通路与急性肺损伤的研究进展[J]. 中国免疫学杂志, 2021, 37(1): 115-118, 123. DOI:10.3969/j.issn.1000-484X.2021.01.022 |
| [12] |
王雪海, 李钢, 罗青松, 等. 胸腺五肽对肺癌模型小鼠免疫功能及脾脏TLR4信号通路的作用[J]. 东南大学学报(医学版), 2019, 38(3): 466-470. DOI:10.3969/j.issn.1671-6264.2019.03.015 |
| [13] |
RATHORE M, GIRARD C, OHANNA M, et al. Cancer cell-derived long pentraxin 3 (PTX3) promotes melanoma migration through a toll-like receptor 4 (TLR4)/NF-κB signaling pathway[J]. Oncogene, 2019, 38(30): 5873-5889. DOI:10.1038/s41388-019-0848-9 |
| [14] |
GONG WJ, LIU JY, YIN JY, et al. Resistin facilitates metastasis of lung adenocarcinoma through the TLR4/Src/EGFR/PI3K/NF-κB pathway[J]. Cancer Sci, 2018, 109(8): 2391-2400. DOI:10.1111/cas.13704 |
| [15] |
XIE C, LIU DQ, CHEN QJ, et al. Soluble B7-H3 promotes the invasion and metastasis of pancreatic carcinoma cells through the TLR4/NF-κB pathway[J]. Sci Rep, 2016, 6: 27528. DOI:10.1038/srep27528 |
| [16] |
褚成龙, 唐朝辉, 徐露瑶, 等. Toll样受体4与胰腺癌的关系[J]. 临床肝胆病杂志, 2021, 37(2): 485-488. DOI:10.3969/j.issn.1001-5256.2021.02.050 |
| [17] |
KHADEMALHOSSEINI M, ARABABADI MK. Toll-like receptor 4 and breast cancer: an updated systematic review[J]. Breast Cancer, 2019, 26(3): 265-271. DOI:10.1007/s12282-018-00935-2 |
 2023, Vol. 52
2023, Vol. 52