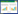文章信息
- 边欢欢, 程美嘉, 吴仪, 李彦怡, 邹丹
- BIAN Huanhuan, CHENG Meijia, WU Yi, LI Yanyi, ZOU Dan
- 酒精饮料对小鼠认知功能的影响及其机制
- Effect of alcoholic beverage on cognitive function of mice and its mechanism
- 中国医科大学学报, 2023, 52(3): 230-235
- Journal of China Medical University, 2023, 52(3): 230-235
-
文章历史
- 收稿日期:2022-06-12
- 网络出版时间:2023-03-16 08:51:08
2. 大阪大学大学院医学系研究科医学统计学教研室, 大阪 565-0871;
3. 沈阳医学院2018级临床医学专业, 沈阳 110034;
4. 沈阳医学院基础医学院免疫学教研室, 沈阳 110034
2. Department of Medical Statistics, Graduate School of Medicine, Osaka university, Osaka 565-0871, Japan;
3. Clinical Medicine of Grade 2018, Shenyang Medical College, Shenyang 110034, China;
4. Department of immunology, School of Basic Medicine, Shenyang Medical College, Shenyang 110034, China
长期过量饮酒可导致学习记忆障碍[1]。与啤酒和红酒相比,白酒引起认知障碍的风险更高[2]。海马作为参与学习记忆的关键脑区,应激时极易受损[3]。研究[1]发现,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)参与学习和记忆过程。激活的mTOR可活化下游效应因子真核起始因子4E结合蛋白1(eukaryotic initiation factor 4E-binding protein 1,4EBP1),调节细胞生长、自噬和增殖。海马神经元自噬的激活可缓解乙醇所致记忆障碍[4]。C-Jun N末端激酶(c-Jun N-terminal kinase,JNK)信号转导通路参与调控细胞的生长、增殖和凋亡,与自噬密切相关。研究[5]表明,咖啡酸通过激活JNK/bcl-2介导的体外自噬,保护帕金森病小鼠模型中的多巴胺能神经元,改善小鼠运动障碍和神经退行性变。与雄性小鼠相比,雌性小鼠大脑受乙醇的负面影响更大[6]。目前,酒精饮料损害神经系统的机制尚不清楚。本研究拟探讨含不同浓度乙醇的酒精饮料对雌性小鼠认知功能影响的差异,揭示其分子机制,为临床研究提供理论依据。
1 材料与方法 1.1 实验动物8周龄昆明种SPF级雌性小鼠40只,体质量(30±5)g,购自辽宁长生生物技术有限公司,动物生产许可证号SCXK(辽)2020-0001。饲养环境温度20~24 ℃,湿度50%~60%,12 h明/暗周期。自由饮食水。
1.2 试剂anti-mTOR(phospho S2448)抗体、anti-mTOR抗体、anti-JNK1+JNK2+JNK3(phospho T183+T183+T221)抗体、anti-Beclin1抗体,均购自英国Abcam公司;phospho-4EBP1抗体、4EBP1抗体、LC3抗体,均购自美国Cell signaling Technology公司;JNK-specific抗体购自上海Bio-Techne公司;β-actin购自武汉ABclonal公司;组织自发荧光淬灭剂、牛血清白蛋白均购自武汉Servicebio公司;FITC山羊抗兔IgG(H+L)购自美国Immunoway Biotechnology公司;山羊抗兔IgG(H+L)购自武汉伊莱瑞特生物科技股份有限公司。
1.3 动物分组及模型建立将40只小鼠随机分为对照组及不同浓度(2.5%vol、11%vol、52%vol)乙醇组,每组各10只。4组小鼠每天在固定时间灌胃,分别给予蒸馏水、2.5%vol乙醇、11%vol乙醇、52%vol乙醇0.01 L/kg,连续4周。灌胃结束后,每组取5只小鼠,乙醚麻醉后断头,冰上分离海马组织,-80 ℃保存,用于Western blotting实验。每组其余5只小鼠乙醚麻醉后,再给予1%戊巴比妥钠(50 mg/kg)麻醉,4%多聚甲醛心脏灌流内固定,取脑组织并置入4%多聚甲醛固定3 d,石蜡包埋后切片(厚度4 μm),用于苏木素-伊红(hematoxylin-eosin,HE)染色和免疫荧光(immunofluorescence,IF)实验。
1.4 Morris水迷宫(Morris water maze,MWM)测试自实验第24天始,采用MWM对小鼠进行连续5 d的定位航行实验及1 d的空间探索实验,评价其学习记忆能力,实验方法参照文献[1]。
1.5 HE染色染色方法参照文献[1]。将切片置于显微镜下,观察各组小鼠海马结构CA1区形态结构的差异,并采集图像。
1.6 Western blotting实验小鼠海马组织中加入裂解液并研磨,提取上清液,通过测定吸光度确定海马组织中的蛋白浓度。SDS-PAGE凝胶每孔蛋白上样量为30 μg。实验方法方法参照文献[1]。用全自动化学发光仪检测蛋白表达,并使用ImageJ软件量化蛋白条带。
1.7 IF实验石蜡切片经脱蜡水化后,柠檬酸抗原修复缓冲液中高压修复。用组织自发荧光淬灭剂A孵育切片50 min,3%牛血清白蛋白封闭30 min,加入初始抗体,4 ℃孵育过夜。次日,用FITC山羊抗兔IgG(H+L)4 ℃孵育50 min,DAPI复染10 min,加入淬灭组织自发荧光淬灭剂B孵育5 min,流水冲洗10 min后封片。显微镜下观察切片,并采集图像,用ImageJ软件分析海马CA1区的平均荧光强度。
1.8 统计学分析采用GraphPad Prism 9.0软件进行统计学分析。计量资料以x±s表示,多组间比较采用多因素方差分析,多重比较采用Tukey’s检验。P < 0.05为差异有统计学意义。
2 结果 2.1 不同浓度乙醇对雌性小鼠海马相关空间学习记忆的影响定位航行实验结果显示,随着训练时间的延长,各组小鼠的逃避潜伏期均不断缩短。第1~2天时,各组小鼠逃避潜伏期比较差异无统计学意义(P > 0.05)。第3~5天时,2.5%vol和52%vol乙醇组逃避潜伏期均显著高于对照组(P < 0.01)。与对照组相比,11%vol乙醇组逃避潜伏期仅在第3天有统计学差异(P < 0.01)。
空间探索实验结果显示,2.5%vol乙醇组和52%vol乙醇组小鼠穿越平台次数和目标象限游泳距离与总游泳距离的比值均显著低于对照组(P < 0.01)。11%vol乙醇组上述2个指标与对照组比较,差异无统计学意义(P > 0.05)。以上结果均得到了空间探索实验中具有代表性的行动轨迹图像的支持。见图 1。
|
| A, comparing the difference in escape latency between each ethanol group; B, comparing the difference in the time of crossing the platform between each ethanol group and the control group; C, comparing the difference in the target quadrant distance percentage between each ethanol group and the control group; D, representative path map in each group. *P < 0.05, **P < 0.01 vs control group. 图 1 不同浓度乙醇对小鼠学习记忆的影响(n = 10) Fig.1 Effects of ethanol in different concentrations on learning and memory in mice (n = 10) |
2.2 不同浓度乙醇对雌性小鼠海马CA1区锥体神经元的影响
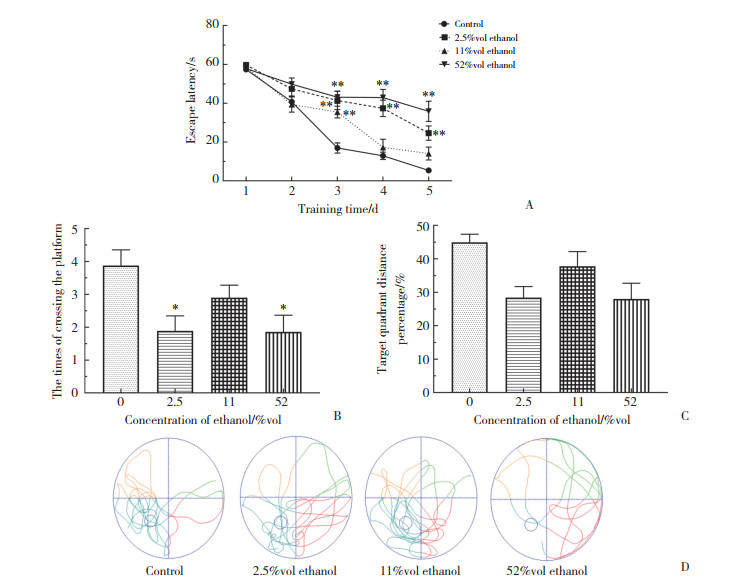
HE染色结果显示,52%vol乙醇组海马CA1区锥体神经元排列松散、不规则,神经元数量低于对照组。2.5%vol乙醇组和11%vol乙醇组海马CA1区神经元排列较为规律。然而,2.5%vol乙醇组海马区锥体神经元数量略低于对照组。见图 2。
|
| A, control group; B, 2.5%vol ethanol group; C, 11%vol ethanol group; D, 52%vol ethanol group. 图 2 海马CA1区锥体神经元的形态改变HE ×400 Fig.2 Morphological changes of pyramidal neurons in hippocampal CA1 area HE ×400 |
2.3 不同浓度乙醇对雌性小鼠海马组织中自噬和mTOR/JNK通路相关蛋白比值的影响
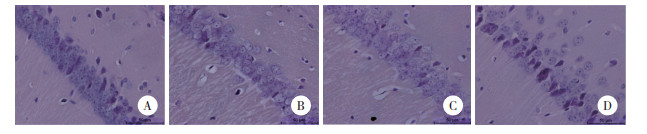
Western blotting结果显示,与对照组相比,2.5%vol和52%vol乙醇组小鼠海马组织中p-mTOR/mTOR和p-4EBP1/4EBP1比值上调(P < 0.05),而p-JNK/JNK、Beclin1/β-actin和LC3Ⅱ/Ⅰ比值显著降低(P < 0.05),52%vol乙醇组LC3Ⅱ/Ⅰ明显低于2.5%vol乙醇组(P < 0.01)。与对照组相比,11%vol乙醇组p-JNK/JNK比值显著下调(P < 0.01)。与52%vol乙醇组相比,11%vol乙醇组p-4EBP1/4EBP1比值下调(P < 0.05),p-JNK/JNK、Beclin1/β-actin、LC3Ⅱ/Ⅰ比值上调(P < 0.01)。与2.5%vol乙醇组相比,11%vol乙醇组p-JNK/JNK和Beclin1/β-actin比值上调(P < 0.01)。见图 3。
|
| *P < 0.05, **P < 0.01 vs control group; #P < 0.05, ##P < 0.01. 图 3 海马中自噬和mTOR/JNK通路相关蛋白的表达(n = 5) Fig.3 Expression of autophagy and mTOR/JNK pathway-related proteins in hippocampus (n = 5) |
2.4 不同浓度乙醇对雌性小鼠海马CA1区自噬和mTOR/JNK通路相关蛋白表达的影响
IF结果显示,与对照组相比,2.5%vol和52%vol乙醇组p-mTOR、p-4EBP1的表达水平显著升高(P < 0.05),且52%vol乙醇组p-mTOR、p-4EBP1显著高于2.5%vol和11%vol乙醇组(P < 0.01)。2.5%vol乙醇组p-4EBP1的表达水平显著高于11%vol乙醇组(P < 0.01)。与对照组比较,2.5%vol和52%vol乙醇组p-JNK、Beclin1和LC3蛋白表达水平显著降低(P < 0.01)。与对照组相比,11%vol乙醇组p-4EBP1蛋白水平上调(P < 0.01),p-JNK、Beclin1、LC3蛋白水平下调(P < 0.05)。此外,11%vol乙醇组p-4EBP1蛋白表达水平显著低于2.5%vol和52%vol乙醇组(P < 0.01),而p-JNK和Beclin1蛋白表达水平显著高于2.5%vol和52%vol乙醇组(P < 0.01)。与52%vol乙醇组比,11%vol乙醇组LC3表达显著升高(P < 0.01),而2.5%vol乙醇组Beclin1、LC3表达均显著升高(P < 0.01)。见图 4。
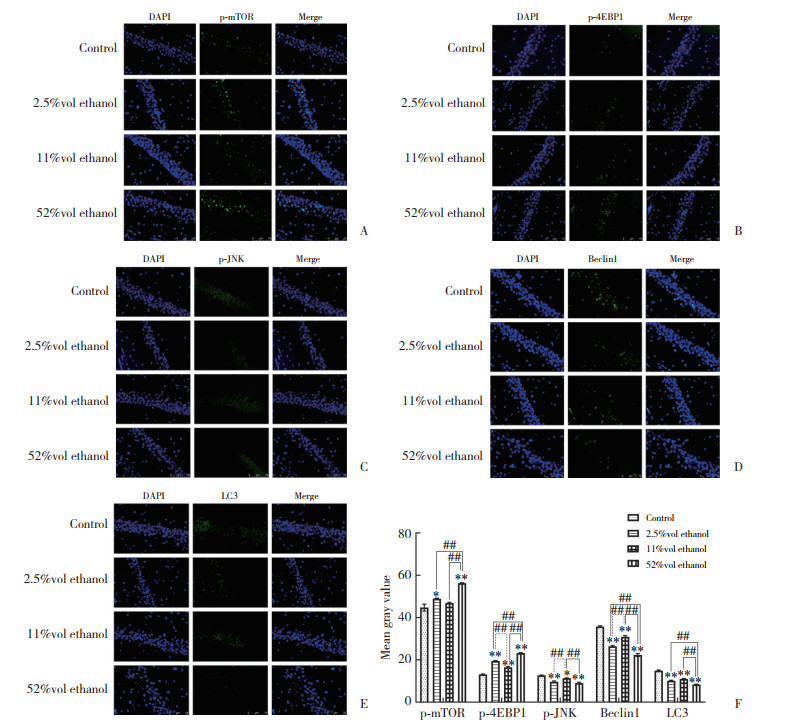
|
| A, p-mTOR (IF ×200);B, p-4EBP1 (IF ×200);C, p-JNK (IF ×200);D, Beclin 1 (IF ×200);E, LC3 (IF ×200);F, the histogram statistical analysis of IF results. * P < 0.05, ** P < 0.01 vs control group; ## P < 0.01. 图 4 小鼠海马中mTOR/JNK通路和自噬相关蛋白的表达(n = 5) Fig.4 Expression of the mTOR/JNK pathway and autophagy related proteins in the hippocampus of mice (n = 5) |
3 讨论
乙醇是一种神经毒性化合物,其滥用会诱发突触可塑性改变、神经损伤,甚至神经退行性病变[7]。酒精饮料是指乙醇含量在0.5%vol以上的饮料,其中,最常见的啤酒、红酒、白酒对应乙醇浓度分别为2.5%vol、11%vol和52%vol。因此,本研究选用2.5%vol、11%vol和52%vol浓度乙醇大量灌胃,探讨其对小鼠认知功能的影响。MWM实验结果表明,3组浓度乙醇均对小鼠认知功能产生不同程度的影响,其中,2.5%vol和52%vol乙醇对小鼠认知功能的损害较明显,且52%vol乙醇组小鼠海马CA1区锥体神经元排列松散、不规则,神经元数量明显减少。
自噬是一种通过溶酶体依赖的降解途径代谢细胞器和蛋白质的稳态细胞机制。LC3Ⅱ的积累通常被认为是自噬的标志[8]。mTOR信号通路是调节细胞能量和营养代谢的重要枢纽,对自噬活动起负调节作用[9]。PI3K/Akt信号通路可通过调节mTOR的磷酸化负性调节自噬[10]。4EBP1是翻译调节器,p-4EBP1可直接反映mTOR活性[11]。在小鼠心肌组织,雷帕霉素通过抑制mTOR-4EBP1信号通路,减少p-mTOR和p-4EBP1的表达[12]。然而,去磷酸化的4EBP1可抑制蛋白质的合成,引发自噬[13]。
乙醇可通过多种机制刺激自噬,包括氧化应激、mTOR和AMPK信号的调制等[14]。本研究中,Western blotting结果显示,与对照组相比,2.5%vol和52%vol乙醇可上调小鼠海马结构中p-mTOR/mTOR和p-4EBP1/4EBP1比值,且52%vol乙醇组p-4EBP1/4EBP1显著高于11%vol乙醇组,上述指标在11%vol乙醇组和对照组间无显著差异。IF结果显示,与对照组比,2.5%vol、52%vol乙醇组p-mTOR和p-4EBP1表达水平显著升高,且52%vol乙醇组p-mTOR和p-4EBP1的表达显著高于2.5%vol和11%vol乙醇组。此外,2.5%vol乙醇组p-4EBP1的表达显著高于11%vol乙醇组。
研究[15]表明,中度急性乙醇暴露可增强NS20Y细胞的自噬性。Beclin1、LC3是检测自噬的重要指标。本研究中,IF结果显示,3种浓度乙醇组小鼠海马结构内Beclin1和LC3蛋白表达水平均下调。2.5%vol、11%vol乙醇组Beclin1和LC3的表达显著高于52%vol乙醇组,且11%vol乙醇组Beclin1的表达水平显著高于2.5%vol乙醇组。因此推测2.5%vol、52%vol乙醇诱导的认知功能障碍可能与上调mTOR-4EBP1通路、降低小鼠自噬有关,52%vol乙醇对自噬的危害大于2.5%vol乙醇。本研究还发现,11%vol乙醇组海马结构中Beclin1和LC3Ⅱ/Ⅰ水平显著高于52%vol乙醇组,11%vol乙醇组Beclin1表达显著高于2.5%vol乙醇组。研究[16]发现,红酒的益处可能与高含量的多酚类化合物,如花青素、槲皮素和白藜芦醇等非乙醇成分密切相关。11%vol乙醇组与对照组认知行为测试结果无显著差异,这可能与11%vol乙醇引起的自噬激活增加了LC3 Ⅰ向LC3Ⅱ的转化有关。
JNK信号通路是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路的重要分支,参与对细胞生长、增殖和凋亡等的调节,并与细胞自噬密切相关。JNK信号通路主要通过Bcl-2家族蛋白的磷酸化及其与Beclin1的分离调节自噬[17]。研究[18]表明,姜黄素激活AMP激活蛋白激酶[adenosine 5’-monophosphate(AMP)-activated protein kinase,AMPK] -JNK信号通路,分别介导mTOR抑制和Bcl-2上调,增强自噬,并抑制细胞凋亡,从而改善认知。慢性应激可减少海马和前额皮质的p-JNK[19]。在急性酒精戒断期间,酒精依赖组大鼠海马背侧、背内侧前额叶皮质和扣带回内的p-JNK选择性减少[20]。本研究中,3个浓度乙醇组海马p-JNK/JNK比值均明显低于对照组,而11%vol乙醇组p-JNK/JNK显著高于2.5%vol、52%vol乙醇组,这与11%vol乙醇组的Beclin1表达水平显著高于2.5%vol、52%vol乙醇组对应。因此,推测上调p-JNK水平可通过增强自噬改善认知功能。
综上所述,长期过量饮用酒精饮料,尤其是啤酒或白酒,可引起认知功能障碍,并可能通过抑制海马内mTOR和JNK信号通路相关的自噬实现。
| [1] |
XING Y, ZOU D. Ethanol-induced cognitive dysfunction is associated with alterations in the mammalian target of rapamycin signalling pathway in the hippocampus of male mice[J]. Neuroreport, 2018, 29(14): 1230-1237. DOI:10.1097/wnr.0000000000001104 |
| [2] |
REHM J, HASAN OSM. Is burden of disease differentially linked to spirits? A systematic scoping review and implications for alcohol policy[J]. Alcohol, 2020, 82: 1-10. DOI:10.1016/j.alcohol.2019.06.005 |
| [3] |
OCAMPO AC, SQUIRE LR, CLARK RE. Hippocampal area CA1 and remote memory in rats[J]. Learn Mem, 2017, 24(11): 563-568. DOI:10.1101/lm.045781.117 |
| [4] |
LIU YY, ZHANG YP, PENG JL, et al. Autophagy alleviates ethanol-induced memory impairment in association with anti-apoptotic and anti-inflammatory pathways[J]. Brain Behav Immun, 2019, 82: 63-75. DOI:10.1016/j.bbi.2019.07.033 |
| [5] |
ZHANG Y, Wu QM, Zhang L, et al. Caffeic acid reduces A53T α-synuclein by activating JNK/Bcl-2-mediated autophagy in vitro and improves behaviour and protects dopaminergic neurons in a mouse model of Parkinson's disease[J]. Pharmacol Res, 2019, 150: 104538. DOI:10.1016/j.phrs.2019.104538 |
| [6] |
WEST RK, MAYNARD ME, LEASURE JL. Binge ethanol effects on prefrontal cortex neurons, spatial working memory and task-induced neuronal activation in male and female rats[J]. Physiol Behav, 2018, 188: 79-85. DOI:10.1016/j.physbeh.2018.01.027 |
| [7] |
LIU MJ, GUO SP, HUANG DC, et al. Chronic alcohol exposure alters gene expression and neurodegeneration pathways in the brain of adult mice[J]. J Alzheimers Dis, 2022, 86(1): 315-331. DOI:10.3233/JAD-215508 |
| [8] |
GLICK D, BARTH S, MACLEOD KF. Autophagy: cellular and molecular mechanisms[J]. J Pathol, 2010, 221(1): 3-12. DOI:10.1002/path.2697 |
| [9] |
RABANAL-RUIZ Y, OTTEN EG, KOROLCHUK VI. mTORC1 as the main gateway to autophagy[J]. Essays Biochem, 2017, 61(6): 565-584. DOI:10.1042/EBC20170027 |
| [10] |
WANG R, ZHANG Q, PENG X, et al. Stellettin B induces G1 arrest, apoptosis and autophagy in human non-small cell lung cancer A549 cells via blocking PI3K/Akt/mTOR pathway[J]. Sci Rep, 2016, 6: 27071. DOI:10.1038/srep27071 |
| [11] |
JIN J, HU K, YE MY, et al. Rapamycin reduces podocyte apoptosis and is involved in autophagy and mTOR/P70S6K/4EBP1 signaling[J]. Cell Physiol Biochem, 2018, 48(2): 765-772. DOI:10.1159/000491905 |
| [12] |
JIN B, SHI HM, ZHU J, et al. Up-regulating autophagy by targeting the mTOR-4EBP1 pathway: a possible mechanism for improving cardiac function in mice with experimental dilated cardiomyopathy[J]. BMC Cardiovasc Disord, 2020, 20(1): 56. DOI:10.1186/s12872-020-01365-9 |
| [13] |
CHEN QY, ZHOU Y, RICHARDS AM, et al. Up-regulation of mi-RNA-221 inhibits hypoxia/reoxygenation-induced autophagy through the DDIT4/mTORC1 and Tp53inp1/p62 pathways[J]. Biochem Biophys Res Commun, 2016, 474(1): 168-174. DOI:10.1016/j.bbrc.2016.04.090 |
| [14] |
LUO J. Autophagy and ethanol neurotoxicity[J]. Autophagy, 2014, 10(12): 2099-2108. DOI:10.4161/15548627.2014.981916 |
| [15] |
ZHOU RP, LENG TD, YANG T, et al. Acute ethanol exposure promotes autophagy-lysosome pathway-dependent ASIC1a protein degradation and protects against acidosis-induced neurotoxicity[J]. Mol Neurobiol, 2019, 56(5): 3326-3340. DOI:10.1007/s12035-018-1289-0 |
| [16] |
ZHOU Y, ZHENG J, LI S, et al. Alcoholic beverage consumption and chronic diseases[J]. Int J Environ Res Public Health, 2016, 13(6): 522. DOI:10.3390/ijerph13060522 |
| [17] |
ZHOU YY, LI Y, JIANG WQ, et al. MAPK/JNK signalling: a potential autophagy regulation pathway[J]. Biosci Rep, 2015, 35(3): e00199. DOI:10.1042/BSR20140141 |
| [18] |
YI LT, DONG SQ, WANG SS, et al. Curcumin attenuates cognitive impairment by enhancing autophagy in chemotherapy[J]. Neurobiol Dis, 2020, 136: 104715. DOI:10.1016/j.nbd.2019.104715 |
| [19] |
ADZIC M, DJORDJEVIC J, DJORDJEVIC A, et al. Acute or chronic stress induce cell compartment-specific phosphorylation of glucocorticoid receptor and alter its transcriptional activity in Wistar rat brain[J]. J Endocrinol, 2009, 202(1): 87-97. DOI:10.1677/JOE-08-0509 |
| [20] |
PAHNG AR, PAULSEN RI, MCGINN MA, et al. Dysregulation of c-Jun N-terminal kinase phosphorylation in alcohol dependence[J]. Alcohol, 2019, 75: 11-18. DOI:10.1016/j.alcohol.2018.04.006 |
 2023, Vol. 52
2023, Vol. 52