文章信息
- 颜菲, 范观止, 刘一平, 胡明, 郭迪森, 张榕
- YAN Fei, FAN Guanzhi, LIU Yiping, HU Ming, GUO Disen, ZHANG Rong
- 血清肿瘤标志物检测在结缔组织病相关间质性肺疾病患者中的临床意义
- Clinical significance of serum tumor markers in patients with connective tissue disease-associated interstitial lung disease
- 中国医科大学学报, 2023, 52(2): 153-159
- Journal of China Medical University, 2023, 52(2): 153-159
-
文章历史
- 收稿日期:2022-10-17
- 网络出版时间:2023-01-31 14:13:33
2. 中国医科大学附属盛京医院病理科, 沈阳 110004
2. Department of Pathology, Shengjing Hospital of China Medical University, Shenyang 110004, China
结缔组织病(connective tissue disease,CTD) 是免疫相关炎症反应介导的多脏器受累的系统性疾病。肺部富含血管和细胞外基质,在免疫、内分泌及代谢方面发挥着重要的作用[1],也是最常受累的器官之一。以肺泡炎症反应、肺间质纤维化为主要病理改变,肺功能进行性损害为主要临床特征的间质性肺疾病(interstitial lung disease,ILD) 是CTD肺受累的主要表现形式。肿瘤标志物作为肿瘤细胞或肿瘤组织刺激其他细胞合成和释放的具有多种免疫和炎症功能的生物物质,近年来研究[2-3]发现肿瘤标志物可能与CTD-ILD发病相关。本研究检测了健康对照组以及CTD患者血清中多种血清肿瘤标志物水平,并探讨健康对照组、CTD-ILD与CTD不合并间质性肺疾病(connective tissue disease-without interstitial lung disease,CTD-nILD) 组中肿瘤标志物的表达差异和不同病因CTD-ILD之间肿瘤标志物表达差异及其在CTD-ILD诊断中的价值。
1 材料与方法 1.1 研究对象收集2019年1月至2022年6月于中国医科大学附属第一医院风湿免疫科住院的CTD患者873例。其中女727例,年龄14~88岁,平均年龄(59.18±12.74) 岁;男146例,年龄28~84岁,平均年龄(61.46±10.86)岁。原发性干燥综合征(primary Sjogren’s syndrome,pSS) 203例(23.25%),皮肌炎(dermatomyositis,DM) 213例(24.4%),系统性硬化症(systemic sclerosis,SSc) 64例(7.33%),类风湿性关节炎(rheumatoid arthritis,RA) 348例(39.86%),混合性结缔组织病(mixed connective tissue disease,MCTD) 45例(5.16%);CTD-ILD患者495例,女407例,年龄22~88岁,平均年龄(59.88±11.94) 岁;男88例,年龄29~84岁,平均年龄(61.97±10.59) 岁。纳入标准:(1) 患者均符合相应的美国风湿病学院或国际公认的pSS、DM、SSc、RA及MCTD的分类标准;(2) ILD的诊断参照2000年美国胸科协会/欧洲呼吸协会(American Thoracic Association/European Respiratory Association,ATS/ERS) 提出的特发性肺纤维化(idiopathic pulmonary fibrosis,IPF) 的诊断标准。排除标准:其他肺部疾病,如各种肺、胸膜感染,肺水肿,肺出血、肿瘤等疾病及金制剂、甲氨蝶呤等药物所致肺间质纤维化。CTD-nILD患者378例,女320例,年龄14~88岁,平均年龄(58.79± 13.16) 岁;男58例,年龄28~84岁,平均年龄(61.45± 11.05) 岁。收集同期于中国医科大学附属第一医院体检中心体检的年龄性别匹配的健康对照组20例,其中女17例,年龄20~88岁,平均年龄(56.68±15.55) 岁;男3例,年龄24~86岁,平均年龄(59.78±16.24) 岁。本研究获得中国医科大学附属第一医院医学伦理委员会批准。
1.2 方法 1.2.1 肺高分辨率CT (high resolution CT,HRCT) 检查患者均行肺部HRCT检查,根据CT结果判断是否合并ILD,肺部HRCT由2位有经验的胸部放射诊断医生独立阅片,意见不一致时协商取得一致,同时参考2015年ATS/ERS对IIP不同临床-放射-病理类型的HRCT特征的描述判断CTD-ILD的影像学分型。
1.2.2 肿瘤标志物的检测采集清晨空腹静脉血2 mL,采用电化学发光法测定甲胎蛋白(alpha-fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原(carbohydrate antigen,CA) 125、CA153、CA199、神经原特异性烯醇化酶(neuron-specific enolase,NSE)、细胞角蛋白19片段(cytokeratin-19 fragment,CYFRA21-1) 和鳞状细胞癌相关抗原(squamous cancinoma-associated antigen,SCC)。
1.3 统计学分析采用SPSS 25.0统计软件进行统计分析,描述性统计以x±s表示,多组间比较符合正态且方差齐的采用one-way ANOVA检验,非正态分布的数据进行Mann-Whitney U和Kruskal-Wallis U检验。两变量相关性分析采用Spearman相关分析。采用受试者操作特征(receiver operating characteristic curve,ROC) 曲线分析各指标的诊断价值,通过约登(Youden) 指数确定最佳截断值。P < 0.05为差异有统计学意义。
2 结果 2.1 患者血清肿瘤标志物水平健康对照组的血清CEA、NSE、CA153、CA125、CA199、CYFRA21-1、AFP、CTD-nILD患者血清和CTD-ILD患者血清之间差异有统计学意义(P < 0.05)。其中健康对照组血清AFP水平高于CTD患者,因此认为AFP无明显临床价值。健康对照组血清CEA、NSE、CA125、CA199、CYFRA21-1水平低于CTD患者,CTD- nILD患者低于CTD-ILD组,其中CTD-nILD患者的CEA、NSE、CA125、CA199、CYFRA21-1水平高于临床正常值上限的比例分别为4.8%、15.3%、7.9%、9.5%、10.6%;CTD-ILD患者的CEA、NSE、CA125、CA199、CYFRA21-1水平高于临床正常值上限的比例分别为20.6%、33.5%、21.2%、14.3%、31.3%。虽然健康对照组的血清CA153水平高于CTD-nILD患者,但CTD-ILD患者的CA153水平高于健康对照组及CTD-nILD组,高于正常值上限的比例为25.9%。SCC在3组间比较无统计学差异,见表 1。
| Tumor marker | Healthy control (n = 20) | CTD-nILD (n = 378) | CTD-ILD (n = 495) | P |
| AFP (ng/mL) | 3.43±3.03 | 3.18±8.75 | 3.04±2.25 | 0.003 |
| CEA (ng/mL) | 2.22±1.71 | 2.82±19.77 | 3.52±4.57 | < 0.001 |
| NSE (ng/mL) | 7.68±7.42 | 13.43±5.56 | 16.08±7.08 | < 0.001 |
| CA153 (U/mL) | 12.36±12.13 | 10.45±6.16 | 20.87±16.10 | < 0.001 |
| CA125 (U/mL) | 16.28±14.65 | 16.68±15.76 | 33.12±56.04 | < 0.001 |
| CA199 (U/mL) | 12.87±12.36 | 13.56±19.25 | 23.80±72.84 | < 0.001 |
| CYFRA21-1 (ng/mL) | 1.65±1.13 | 2.28±2.02 | 3.43±2.57 | < 0.001 |
| SCC (μg/L) | 1.00±0.40 | 0.86±0.95 | 0.91±1.59 | 0.064 |
2.2 不同CTD的ILD患者血清肿瘤标志物水平
不同CTD的ILD患者血清CEA、NSE、CA153、CA125、CYFRA21-1和SCC水平存在统计学差异,DM-ILD患者血清CEA、NSE和CYFRA21-1水平升高最为明显,pSS-ILD患者血清CA153和SCC水平升高最明显,而RA-ILD患者血清CA125水平最高。AFP和CA199在不同CTD的ILD患者组间比较无统计学差异,见表 2。
| Tumor marker | pSS-ILD | DM-ILD | SSc-ILD | RA-ILD | MCTD-ILD | P |
| AFP (ng/mL) | 3.13±3.05 | 3.32±2.54 | 2.87±1.47 | 2.82±1.54 | 2.48±1.28 | 0.096 |
| CEA (ng/mL) | 2.64±2.57 | 4.68±6.44 | 2.71±2.30 | 3.16±3.25 | 2.77±3.57 | 0.008 |
| NSE (ng/mL) | 13.94±6.01 | 18.91±8.81 | 15.03±3.09 | 14.24±4.15 | 16.96±9.33 | < 0.001 |
| CA153 (U/mL) | 41.80±82.35 | 23.61±14.30 | 20.97±14.25 | 18.33±14.14 | 25.17±27.16 | < 0.001 |
| CA125 (U/mL) | 18.09±17.36 | 20.51±18.59 | 29.51±54.80 | 43.27±63.13 | 37.40±55.72 | 0.002 |
| CA199 (U/mL) | 28.74±107.03 | 23.28±78.00 | 23.91±73.49 | 21.30±37.41 | 23.57±34.87 | < 0.001 |
| CYFRA21-1 (ng/mL) | 2.71±1.42 | 4.43±3.41 | 2.90±1.67 | 3.01±2.04 | 3.11±2.09 | 0.318 |
| SCC (μg/L) | 1.06±1.94 | 0.97±2.05 | 0.60±0.31 | 0.92±1.10 | 0.66±0.48 | 0.002 |
2.3 不同CTD-ILD患者与CTD-nILD患者的血清肿瘤标志物水平
pSS-ILD患者血清CEA、NSE、CA153、CYFRA21-1均高于不合并ILD的pSS患者(P < 0.05),DM-ILD患者血清CEA、CA153、CYFRA21-1均高于不合并ILD的DM患者(P < 0.05),SSc-ILD患者血清CA153水平高于nILD患者(P < 0.05),MCTD-ILD患者血清CEA、CA153水平高于nILD患者(P < 0.05),而RA-ILD患者AFP、NSE、CA125、CA153、CA199、CYFRA21-1水平高于nILD患者,而CEA水平低于nILD患者(P < 0.05),见表 3。
| Tumor marker | pSS | DM | SSc | MCTD | RA | |||||||||
| pSS-nILD (n = 112) | pSS-ILD (n = 91) | DM-nILD (n = 38) | DM-ILD (n = 175) | SSc-nILD (n = 10) | SSc-ILD (n = 54) | MCTD-nILD (n = 12) | MCTD-ILD (n = 33) | RA-nILD (n = 206) | RA-ILD (n = 142) | |||||
| AFP (ng/mL) | 4.51±15.77 | 3.13±3.05 | 3.28±2.10 | 3.32±2.54 | 2.45±1.03 | 2.87±1.47 | 2.31±1.28 | 2.48±1.28 | 2.51±1.27 | 2.82±1.541) | ||||
| CEA (ng/mL) | 1.52±0.92 | 2.64±2.572) | 2.24±2.01 | 4.68±6.443) | 4.37±7.43 | 2.71±2.30 | 1.18±1.16 | 2.77±3.574) | 3.60±26.37 | 3.16±3.251) | ||||
| NSE (ng/mL) | 12.11±3.39 | 13.94±6.012) | 20.37±12.29 | 18.91±8.81 | 13.47±2.37 | 15.03±3.09 | 15.08±6.20 | 16.96±9.33 | 12.80±3.41 | 14.24±4.151) | ||||
| CA125 (U/mL) | 9.91±5.38 | 18.09±17.36 | 18.30±20.21 | 20.51±18.59 | 23.46±35.73 | 29.51±54.80 | 19.34±13.89 | 37.40±55.72 | 15.00±15.03 | 43.27±63.131) | ||||
| CA153 (U/mL) | 18.35±12.46 | 41.80±82.352) | 12.98±7.09 | 23.61±14.303) | 10.82±5.60 | 20.97±14.255) | 14.02±11.97 | 25.17±27.164) | 10.07±5.81 | 18.33±14.141) | ||||
| CA199 (U/mL) | 14.19±14.16 | 28.74±107.03 | 21.10±29.47 | 23.28±78.00 | 35.86±64.67 | 23.91±73.49 | 10.54±9.07 | 23.57±34.87 | 10.86±13.21 | 21.30±37.411) | ||||
| CYFRA21-1 (ng/mL) | 2.14±1.00 | 2.71±1.422) | 3.81±4.24 | 4.43±3.413) | 3.26±2.41 | 2.90±1.67 | 2.95±1.65 | 3.11±2.09 | 2.01±1.69 | 3.01±2.041) | ||||
| SCC (μg/L) | 0.92±0.71 | 1.06±1.94 | 1.23±2.13 | 0.97±2.05 | 0.85±0.60 | 0.60±0.31 | 1.33±2.28 | 0.66±0.48 | 0.74±0.54 | 0.92±1.10 | ||||
| 1) P < 0.05 compared with RA-nILD group;2) P < 0.05 compared with pSS-nILD group;3) P < 0.05 compared with DM-nILD group;4) P < 0.05 compared with MCTD-nILD group;5) P < 0.05 compared with SSc-nILD group. | ||||||||||||||
2.4 不同影像学类型CTD-ILD患者的血清肿瘤标志物水平
将CTD-ILD患者根据HRCT结果,分为非特异性间质性肺炎(nonspecific interstitial pneumonia,NSIP) (n = 232)、机化性肺炎(organizing pneumonia,OP) (n = 109)、寻常型间质性肺炎(usual interstitial pneumonia,UIP) (n = 73) 和淋巴样间质性肺炎(lymphocytic interstitial pneumonia,LIP) (n = 14) 4种类型,并比较不同类型之间的肿瘤标志物水平。不同的HRCT分型之间CEA、NSE、CA153、CA125和CYFRA21-1存在统计学差异(P < 0.05),其中CEA、CA153、CA125和CYFRA21-1 4种肿瘤标志物均在UIP型中表达最高,NSE在OP中表达最高。其他肿瘤标志物之间无统计学差异,见表 4。
| Tumor marker | NSIP | UIP | LIP | OP | P |
| AFP (ng/mL) | 2.95±1.79 | 2.72±1.23 | 4.37±7.13 | 3.33±2.69 | 0.739 |
| CEA (ng/mL) | 3.13±5.11 | 4.13±4.13 | 3.00±1.93 | 3.64±4.06 | 0.001 |
| NSE (ng/mL) | 15.22±5.42 | 15.29±4.60 | 14.66±6.45 | 17.95±6.29 | < 0.001 |
| CA125 (U/mL) | 18.71±13.96 | 28.47±20.93 | 22.58±24.48 | 18.83±11.83 | < 0.001 |
| CA153 (U/mL) | 27.94±54.24 | 60.48±81.60 | 34.68±40.13 | 23.00±24.91 | < 0.001 |
| CA199 (U/mL) | 23.33±77.47 | 47.34±138.83 | 11.16±6.68 | 16.22±21.79 | 0.001 |
| CYFRA21-1 (ng/mL) | 2.96±2.05 | 4.18±3.42 | 2.41±1.24 | 3.67±2.76 | 0.086 |
| SCC (μg/L) | 0.70±0.54 | 0.87±0.60 | 0.87±0.56 | 1.04±1.92 | 0.135 |
2.5 单指标ROC分析
ROC曲线分析结果显示,肿瘤标志物对CTD-ILD均有明显的诊断价值,特别是CA153在多种CTD-ILD的都具有诊断价值,pSS-ILD患者的曲线下面积(area undercurve,AUC) 为0.72 (P < 0.05),最佳截断值为10.86 U/mL,灵敏度和特异度分别为64.8%和71.2%,阳性似然比为2.25;DM-ILD患者AUC为0.76 (P < 0.05),最佳截断值为17.9 U/mL,灵敏度和特异度分别为55. 2%和83.3%,阳性似然比为3.31;SSc-ILD患者的AUC为0.77 (P < 0.05),最佳截断值为11.47 U/mL,灵敏度和特异度分别为77.8%和80.0%,阳性似然比为3.89;RA-ILD患者的AUC达0.74 (P < 0.05),最佳截断值为11.10 U/mL,灵敏度和特异度分别为68. 1%和71. 8%,阳性似然比为2.42。此外,CEA在MCTD-ILD患者的AUC为0.77 (P < 0.05),最佳截断值为0.81 ng/mL,灵敏度和特异度分别为90.3%和58.3%,阳性似然比为2.17,见表 5。
| Disease | AUC | P | Sensitivity (%) | Specificity (%) | Likelihood ratio |
| pSS | |||||
| CEA | 0.67 | < 0.001 | 73.3 | 51.9 | 1.53 |
| NSE | 0.60 | 0.030 | 40.0 | 78.6 | 1.87 |
| CA153 | 0.72 | < 0.001 | 64.8 | 71.2 | 2.25 |
| CYFRA21-1 | 0.62 | < 0.001 | 38.8 | 83.1 | 2.30 |
| DM | |||||
| CEA | 0.67 | < 0.001 | 76.5 | 50.0 | 1.53 |
| CA153 | 0.76 | < 0.001 | 55.2 | 83.3 | 3.31 |
| SSc | |||||
| CA153 | 0.77 | < 0.001 | 77.8 | 80.0 | 3.89 |
| MCTD | |||||
| CEA | 0.77 | < 0.001 | 90.3 | 58.3 | 2.17 |
| RA | |||||
| CEA | 0.67 | < 0.001 | 37.9 | 90.2 | 3.88 |
| NSE | 0.61 | < 0.001 | 45.4 | 76.9 | 1.96 |
| CA153 | 0.74 | < 0.001 | 68.1 | 71.8 | 2.42 |
| CA125 | 0.71 | < 0.001 | 46.8 | 90.7 | 5.05 |
| CYFRA21-1 | 0.70 | < 0.001 | 66.9 | 63.2 | 1.82 |
| CA199 | 0.65 | < 0.001 | 53.0 | 75.4 | 2.16 |
2.6 多指标联合诊断分析
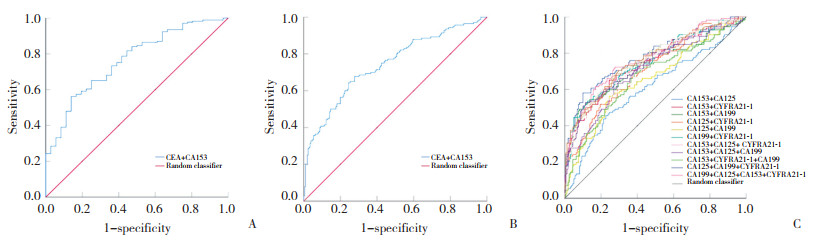
选取灵敏度≥50%的肿瘤标志物,通过Logit (P) 方程式进一步评估不同标志物联合诊断pSS、DM和RA患者合并ILD的价值,结果显示,在pSS-ILD患者中CEA +CA153的AUC为0.737 (P < 0.05),其相应的灵敏度和特异度分别为56.3%和82.7%,阳性似然比为3.25;DM-ILD患者中CEA+CA153的AUC为0.764 (P < 0.05),其相应的灵敏度和特异度分别为56.2%、86.1%,阳性似然比为4.05。RA-ILD患者的CA153+ CA125+CYFRA21-1与CA153+CA125+CYFRA21-1+ CA199的AUC最高,为0.794 (P < 0.05),CA153+CA125+ CYFRA21-1的灵敏度和特异度分别为62.3%、86.9%,阳性似然比为4.75;CA153+CA125+CYFRA21-1+CA 199的灵敏度和特异度分别为64.9%和83.7%,阳性似然比为3.99,见表 6、表 7,图 1。
| Tumor marker | AUC | P | Sensitivity (%) | Specificity (%) | Likelihood ratio |
| CEA+CA153 (pSS) | 0.737 | < 0.001 | 56.3 | 92.6 | 5.06 |
| CEA+CA153 (DM) | 0.764 | < 0.001 | 56.2 | 86.1 | 4.05 |
| Tumor marker | AUC | P | Sensitivity (%) | Specificity (%) | Likelihood ratio |
| CA153+CA125 | 0.782 | < 0.001 | 58.0 | 89.9 | 5.77 |
| CA153+ CYFRA21-1 | 0.772 | < 0.001 | 72.3 | 72.3 | 2.61 |
| CA153+CA199 | 0.756 | < 0.001 | 67.9 | 73.0 | 2.51 |
| CA125+ CYFRA21-1 | 0.760 | < 0.001 | 70.5 | 70.4 | 2.39 |
| CA125+CA199 | 0.734 | < 0.001 | 52.7 | 88.7 | 4.65 |
| CA199+CYFRA21-1 | 0.730 | < 0.001 | 48.2 | 86.2 | 3.48 |
| CA153+CA125+ CYFRA21-1 | 0.794 | < 0.001 | 62.3 | 86.9 | 4.75 |
| CA153+CA125+CA199 | 0.783 | < 0.001 | 64.9 | 81.9 | 3.58 |
| CA153+CYFRA21-1+CA199 | 0.776 | < 0.001 | 62.3 | 81.9 | 3.44 |
| CA125+CA199+CYFRA21-1 | 0.756 | < 0.001 | 70.2 | 71.9 | 2.50 |
| CA199+CA125+CA153+CYFRA21-1 | 0.794 | < 0.001 | 64.9 | 83.7 | 3.99 |
|
| A,DM;B,pSS;C,RA. 图 1 CTD-ILD患者多指标联合诊断分析 Fig.1 Analysis of combined diagnosis of CTD-ILD with multiple indicators |
3 讨论
ILD是CTD最常见的肺部并发症,预后差且死亡率高。血清肿瘤标志物不仅仅用于肿瘤的筛查和评估,有研究[4]发现肿瘤相关抗原与SSc患者的肺损伤程度(用力肺活量、间质及肺泡评分) 相关。
本研究结果显示,CTD-ILD患者血清肿瘤标志物CEA、NSE、CA125、CA199、CYFRA21-1水平明显高于CTD-nILD患者及健康对照组,提示CEA、NSE、CA125、CA199、CYFRA21-1可能参与间质性肺病的发生发展。既往研究[5]证实,血清CEA和CA125在大多数肿瘤和非肿瘤性疾病中可能是由非肿瘤细胞或组织产生的分子,并在血液循环中积聚。
CEA是参与细胞黏附的表面糖蛋白。有研究[6]证明CTD-ILD患者血清CEA水平升高并与病情严重程度呈正相关,是ILD重要且独立的生存预测因子。NSE是糖酵解的关键酶[7]。CTD-ILD患者血清NSE升高可能提示成纤维细胞的过度增殖并参与ILD的发生发展[8]。有研究[9]发现CA199和CA125在IPF患者的化生上皮细胞中大量分泌,不仅如此,CA199升高可预测进展性纤维化,CA125升高则可预测IPF的进展和IPF患者总存活率。因此,CA199可能与ILD的疾病进展相关[10-11],而CA125有可能作为抗纤维化治疗反应的血清标志物。
根据肺HRCT将CTD患者的间质性肺病分为NSIP、OP、UIP、LIP 4个影像学表型,结果显示,UIP型ILD患者血清CEA、CA153、CA125和CYFRA21-1最高,OP型ILD患者血清NSE表达最多。有研究[12]认为在肺纤维化形成中CA153参与免疫调节和纤维增殖过程,CA153水平升高与肺间质损伤、成纤维细胞活性及肺纤维化程度与进展有关。另有研究[13-14]表明CYFRA21-1可能是ILD上皮细胞损伤的标志物,而CYFRA21-1增加的可能是嗜酸性粒细胞和中性粒细胞产生的蛋白酶和氧化剂造成损伤。
本研究结果显示,不同病因CTD-ILD患者血清CEA、NSE、CA153、CA125、CYFRA21-1和SCC水平存在统计学差异。不同病因的ILD患者与不合并ILD患者的差异性肿瘤标志物也不完全相同。上述结果提示不同CTD的发病机制不同导致肺间质纤维化形成过程不同,肿瘤标志物的表达水平不完全相同,因此肿瘤标志物能否作为预测指标有待于进一步的研究。本研究对表达有差异的肿瘤标志物进行ROC曲线分析,结果显示,在pSS、DM、MCTD及RA中CA153的预测价值最高。此外,pSS、DM及RA均有2个及以上的肿瘤标志物有预测价值,本研究通过联合预测诊断分析发现,多个肿瘤标志物联合预测CTD-ILD的价值大于单一肿瘤标志物。总之,血清肿瘤标志物CEA、NSE、CA153、CYFRA21-1的血清水平升高提示CTD可能合并ILD,必要时可联合多个肿瘤标志物进行预测。
| [1] |
MA H, LU JH, SONG YY, et al. The value of serum Krebs von den Lungen-6 as a diagnostic marker in connective tissue disease associated with interstitial lung disease[J]. BMC Pulm Med, 2020, 20(1): 6. DOI:10.1186/s12890-019-1043-z |
| [2] |
ZHENG MH, LOU AJ, ZHANG HR, et al. Serum KL-6, CA19-9, CA125 and CEA are diagnostic biomarkers for rheumatoid arthritis-associated interstitial lung disease in the Chinese population[J]. Rheumatol Ther, 2021, 8(1): 517-527. DOI:10.1007/s40744-021-00288-x |
| [3] |
SHI L, HAN XL, GUO HX, et al. Increases in tumor markers are associated with primary Sjögren's syndrome-associated interstitial lung disease[J]. Ther Adv Chronic Dis, 2020, 11: 2040622320944802. DOI:10.1177/2040622320944802 |
| [4] |
DE LUCA G, BOSELLO SL, BERARDI G, et al. Tumour-associated antigens in systemic sclerosis patients with interstitial lung disease: association with lung involvement and cancer risk[J]. Rheumatology (Oxford), 2015, 54(11): 1991-1999. DOI:10.1093/rheumatology/kev204 |
| [5] |
ZHANG M, DOU HQ, YANG DD, et al. Retrospective analysis of glycan-related biomarkers based on clinical laboratory data in two medical centers during the past 6 years[J]. Prog Mol Biol Transl Sci, 2019, 162: 141-163. DOI:10.1016/bs.pmbts.2019.01.003 |
| [6] |
JIN Q, ZHENG JS, XU XR, et al. Value of serum carbohydrate antigen 19-9 and carcinoembryonic antigen in evaluating severity and prognosis of connective tissue disease-associated interstitial lung disease[J]. Arch Rheumatol, 2017, 33(2): 190-197. DOI:10.5606/ArchRheumatol.2018.6419 |
| [7] |
LI SY, CAO LJ, WANG XY, et al. Neuron-specific enolase is an independent prognostic factor in resected lung adenocarcinoma patients with anaplastic lymphoma kinase gene rearrangements[J]. Med Sci Monit, 2019, 25: 675-690. DOI:10.12659/MSM.913054 |
| [8] |
YAN P, HAN YM, TONG AN, et al. Prognostic value of neuron-specific enolase in patients with advanced and metastatic non-neuroendocrine non-small cell lung cancer[J]. Biosci Rep, 2021, 41(8): BSR20210866. DOI:10.1042/BSR20210866 |
| [9] |
MAHER TM, OBALLA E, SIMPSON JK, et al. An epithelial biomarker signature for idiopathic pulmonary fibrosis: an analysis from the multicentre PROFILE cohort study[J]. Lancet Respir Med, 2017, 5(12): 946-955. DOI:10.1016/S2213-2600(17)30430-7 |
| [10] |
AMIGUES I, RAMADURAI D, SWIGRIS JJ. Current perspectives on emerging biomarkers for rheumatoid arthritis-associated interstitial lung disease[J]. Open Access Rheumatol, 2019, 11: 229-235. DOI:10.2147/OARRR.S166070 |
| [11] |
ZHENG MH, LOU AJ, ZHANG HR, et al. Serum KL-6, CA19-9, CA125 and CEA are diagnostic biomarkers for rheumatoid arthritis-associated interstitial lung disease in the Chinese population[J]. Rheumatol Ther, 2021, 8(1): 517-527. DOI:10.1007/s40744-021-00288-x |
| [12] |
HIRASAWA Y, KOHNO N, YOKOYAMA A, et al. KL-6, a human MUC1 mucin, is chemotactic for human fibroblasts[J]. Am J Respir Cell Mol Biol, 1997, 17(4): 501-507. DOI:10.1165/ajrcmb.17.4.2253 |
| [13] |
VERCAUTEREN IM, VERLEDEN SE, MCDONOUGH JE, et al. CYFRA 21.1 in bronchoalveolar lavage of idiopathic pulmonary fibrosis patients[J]. Exp Lung Res, 2015, 41(8): 459-465. DOI:10.3109/01902148.2015.1073407 |
| [14] |
KANAZAWA H, YOSHIKAWA T, YAMADA M, et al. CYFRA 21-1, a cytokeratin subunit 19 fragment, in bronchoalveolar lavage fluid from patients with interstitial lung disease[J]. Clin Sci (Lond), 1998, 94(5): 531-535. DOI:10.1042/cs0940531 |
 2023, Vol. 52
2023, Vol. 52