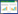文章信息
- 王帆, 王鹏皓
- WANG Fan, WANG Penghao
- 白藜芦醇介导SIRT1干预地塞米松诱导成骨细胞线粒体自噬的研究
- Resveratrol inhibits dexamethasone-induced mitophagy in osteoblasts via SIRT1
- 中国医科大学学报, 2023, 52(2): 97-102
- Journal of China Medical University, 2023, 52(2): 97-102
-
文章历史
- 收稿日期:2022-09-09
- 网络出版时间:2023-01-31 11:26:03
骨质疏松症是一种典型的衰老相关疾病,由骨重塑损伤引起,并伴有成骨细胞和破骨细胞的数量和活性失衡。研究[1]发现,成骨细胞功能障碍是包括糖皮质激素诱导的骨质疏松症在内的骨丢失的主要原因。细胞自噬可以去除受损的大分子和细胞器,是细胞内稳态的重要调节因素。线粒体自噬是一种选择性自噬的形式,有助于线粒体质量控制,在维持骨稳态中起着至关重要的作用[2]。成骨细胞的线粒体自噬与骨质疏松症有关。转录沉默信息调节因子1(sirtuin 1,SIRT1)是NAD+依赖的Ⅲ类组蛋白去乙酰化酶的sirtuin家族成员之一,在调节多种生物学功能中起着重要作用,包括线粒体稳态、细胞衰老和细胞死亡。研究[3]表明,白藜芦醇(resveratrol,RES)富含于红酒、葡萄和其他各种食物中,参与成骨细胞和破骨细胞活性平衡,但其具体机制尚不清楚。本研究拟深入研究RES影响糖皮质激素诱导成骨细胞线粒体自噬的机制,以期为RES应用于防治骨质疏松症提供理论依据。
1 材料与方法 1.1 细胞培养及分组人成骨细胞系hFob1.19购自307-北京青藤转化医学中心。用含10 %胎牛血清的DMEM培养基(美国Gibco公司)于37 ℃、5 % CO2培养箱中培养。将细胞随机分为5组:(1)正常对照组,常规培养;(2)DEX组,培养液中加入DEX(10-6 mol/L);(3)RES组,培养液中加入RES(10-6、10-7、10-8 mol/L);(4)DEX+ RES组,培养液中加入DEX(10-6 mol/L)及RES(10-6、10-7、10-8 mol/L);(5)烟酰胺(nicotinamide,NAM)组,培养液中加入SIRT1抑制剂NAM(100 μmol/L)及RES(10-6、10-7、10-8 mol/L)。
1.2 CCK-8法检测细胞增殖将hFob1.19细胞消化后,移入15 mL离心管,1 500 r/min离心5 min,将细胞转入6孔板培养48 h;使用CCK-8(南京奥青生物技术有限公司)检测hFob1.19细胞活力。将CCK-8溶液(5 mg/mL,10 μL)加入96孔板,避光孵育2 h后在450 nm处检测吸光度(optical density,OD)。
1.3 透射电子显微镜(transmission electron microscopy,TEM)观察收集hFob1.19细胞。室温下2.5%戊二醛PBS固定2 h,1%四氧化锇固定1 h,2 %醋酸铀酰染色1 h;梯度乙醇脱水,包埋并切片。行醋酸铀酰和柠檬酸铅双染色。TEM(JEM-1200EX,日本电子株式会社(JEOL))下观察。
1.4 实时荧光定量PCR(real-time fluorescence quantitative polymerase chain reaction,RT-qPCR)用TRIzol试剂(美国赛默飞公司)提取细胞总RNA,用Nanodrop2000(美国赛默飞公司)测定其浓度和纯度。用Primematipt混合RT随机引物逆转录mRNA。采用PrimeScript RT Master Mix(日本TaKaRa公司)和ABIPrism7500序列检测系统(美国ABI公司)行cDNA扩增。以GAPDH和U6作内参照,每个样品重复检测3次。采用2-ΔΔCt法分析mRNA的相对表达量。采用不同引物检测环状RNA的后剪接,采用聚合引物检测线性mRNA。mRNA引物序列见表 1。
| Gene | Forward primer(5’-3’) | Reverse primer(5’-3’) |
| SIRTl | CAAAGGAGCAGATTAGTAGGCG | CTCTGGCATGTCCCACTATCAC |
| GAPDH | TGACGTGGACATCCGCAAAG | CTGGAAGGTGGACAGCGAGG |
| U6 | CTCGCTTCGGCAGCACA | AACGCTTCACGAATTTGCGT |
1.5 碱性磷酸酶(alkaline phosphatase,ALP)及caspase 3蛋白活性的测定
将细胞(1×108/L)接种于6孔板中,培养7 d后弃培养液,磷酸盐缓冲液清洗3次,4%多聚甲醛固定30 min,按照BCIP/NBT ALP染色试剂盒(中国百奥莱博公司)[或CaspGLOW caspase 3染色试剂盒(美国BioVision公司)]说明书加入ALP染色剂(或caspase 3染色剂),20 ℃孵育10 min,PBS清洗3次,拍照,观察颜色变化。
1.6 酶联免疫吸附实验使用抗原96孔微孔板,每板中含3个阳性对照孔、2个阴性对照孔及2个空白对照孔,同时对标本进行编号并选择与之对应的加样孔进行检测。各标本复溶后加样100 μL,封板后37 ℃孵育60 min。使用自动洗板机(KHB ST-36W,上海科华试验系统有限公司)反复洗板6次,干燥后各反应孔加入100 μL底物,避光反应15 min,随后各反应孔加入50 μL终止液终止反应。采用自动酶标仪(Anthos 2010,郑州安图生物工程有限公司)检测波长450 nm各孔OD值。以OD值代表抗体水平,OD值> 截断(cut-off)值≥1为阳性,否则为阴性。
1.7 Western blotting采用放射免疫沉淀法提取总蛋白;8%或10%SDS-PAGE分离后,转至PVDF膜;加入抗鼠SIRT1抗体(稀释1︰250,美国赛默飞公司)孵育过夜;加入过氧化物酶耦联的二抗(稀释1︰4 000,美国赛默飞公司),37 ℃孵育2 h,PBS洗膜;采用增强的化学发光法显色,以GAPDH(1︰2 500,美国赛默飞公司)作内参照。实验分组如下:对照组,DEX(10-6 mol/L)处理组,RES(50 μmol/L)处理组,DEX+RES处理组,RES+NAM(40 mol/L)处理组。其中,一抗分别如下:TOM20(线粒体自噬标记蛋白,1∶200),Hsp60(线粒体基质、线粒体自噬标记蛋白,1∶200)和β-actin(内参照,1∶1 000)。
1.8 统计学分析采用Prism 7.0软件行统计学分析。计量数据用x±s表示。采用Shapiro-Wilk检验分析数据分布的变化,采用Levene检验分析是否方差齐。采用未配对的Student’s t检验(正态分布和方差齐)、Welcht检验(方差不齐)或Mann-Whitney U检验(非正态分布)进行2组间比较。P < 0.05为差异有统计学意义。
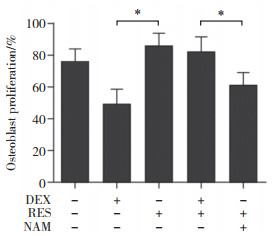
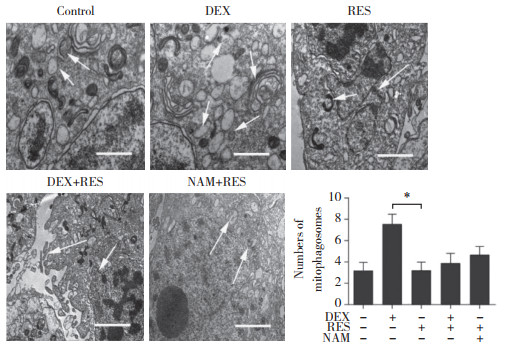
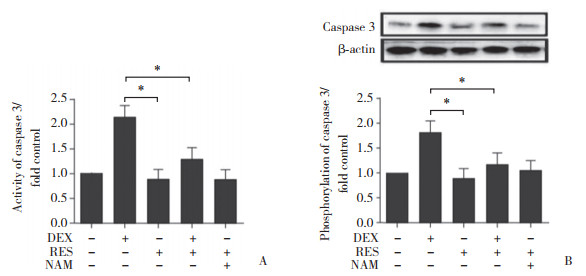
2 结果 2.1 RES对成骨细胞增殖、凋亡及线粒体自噬的影响CCK-8结果显示,DEX和RES作用成骨细胞2 h后,DEX明显地抑制了细胞的增殖,而RES明显地减弱了DEX对细胞增殖的抑制作用(P < 0.05),见图 1;TEM下可见,DEX+RES组自噬小体明显少于DEX组,提示DEX可促进成骨细胞自噬,而RES可抑制此效应,见图 2;ALP活性检测结果显示,DEX显著抑制了成骨细胞内的ALP活性,而RES则改善了这种抑制作用(P < 0.05),见图 3;同时,酶联免疫吸附实验和Western blotting结果均显示,RES组成骨细胞内caspase 3蛋白活性较DEX组显著降低(P < 0.05),见图 4。
|
| *P < 0.05. 图 1 RES对DEX抑制成骨细胞增殖的影响 Fig.1 Effect of RES on DEX inhibition of osteoblast proliferation |
|
| Arrows show autophagosomes. Scale bar = 0.5 μm. *P < 0.05. 图 2 RES对DEX促进形成成骨细胞自噬小体的影响 Fig.2 Effect of RES on the promotion of DEX to osteoblast autophagosome formation |
|
| *P < 0.05. 图 3 RES对成骨细胞内ALP蛋白活性的影响 Fig.3 Effect of RES on ALP protein activity in osteoblasts |
|
| A, enzyme linked immunosorbent assay was used to detect the protein activity of caspase 3;B, the active expression of caspase 3 was detected by Western blotting. * P < 0.05. 图 4 RES对成骨细胞内caspase 3蛋白活性的影响 Fig.4 Effect of RES on caspase 3 protein activity in osteoblasts |
2.2 RES对成骨细胞内SIRT1分子的正向调节作用
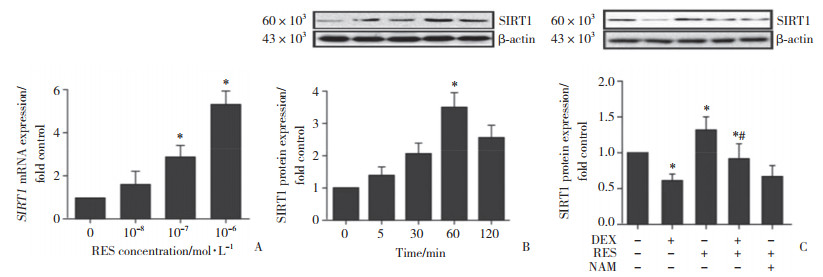
用不同浓度RES(10-8~10-6 mol/L)处理成骨细胞5~120 min,RT-qPCR和Western blotting结果显示,RES以剂量依赖和时间依赖的方式促进了成骨细胞中SIRT1 mRNA和蛋白的表达,见图 5A、5B。同时,DEX和(或)RES作用成骨细胞2 h后,DEX组成骨细胞中SIRT1表达水平显著降低,而RES组及DEX+RES组SIRT1表达水平则显著升高,而NAM消除了RES对成骨细胞中SIRT1表达的影响,见图 5C。
|
| A, the expression level of SIRT1 mRNA was detected by RT-qPCR; B, Western blotting was used to detect the time-dependent expression of SIRT1 activity; C, Western blotting was used to detect the influence of DEX and/or RES on SIRT1 expression. * P < 0.05 vs control group; # P < 0.05 vs RES group. 图 5 RES对成骨细胞内SIRT1活性的影响 Fig.5 Effect of RES on the activity of SIRT1 in osteoblasts |
2.3 RES对成骨细胞线粒体自噬的负向调节作用
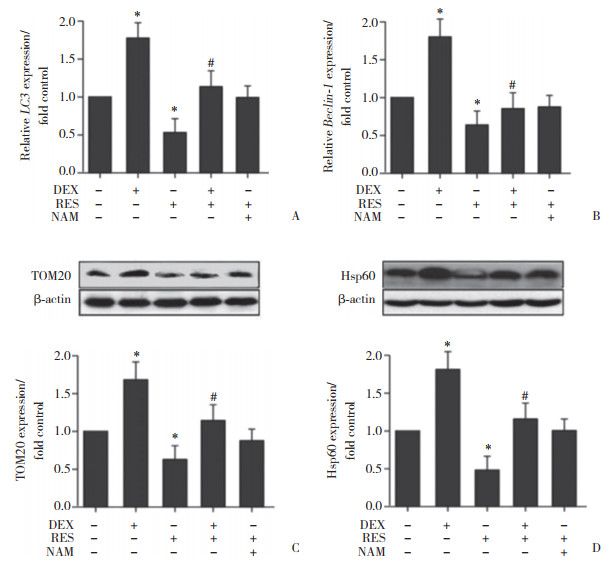
结果显示,DEX作用成骨细胞2 h后,成骨细胞中LC3和Beclin1 mRNA的表达水平显著升高(P < 0.05),且DEX显著增强了成骨细胞中TOM20和Hsp60蛋白的表达水平(P < 0.05);RES单独作用于成骨细胞可显著抑制细胞中LC3和Beclin1 mRNA的表达,并降低细胞内TOM20和Hsp60蛋白的表达水平(P < 0.05);DEX和RES联合作用于成骨细胞,TOM20和Hsp60的蛋白表达水平较DEX组显著降低(P < 0.05),而NAM处理后则与对照组无明显变化(P > 0.05)。提示RES可部分抑制DEX对成骨细胞线粒体自噬的激活效应。见图 6。
|
| A, the expression level of LC3 mRNA was detected by RT-qPCR.; B, Beclin 1 mRNA expression was detected by RT-PCR; C, the expression of TOM20 was detected by Western blotting; D, Western blotting was used to detect Hsp60 expression. *P < 0.05 vs control group; # P < 0.05 vs DEX group. 图 6 RES及DEX对成骨细胞线粒体自噬的调节作用 Fig.6 Assessment of autophagy in osteoblast induced by DEX and RES |
3 讨论
研究[4]发现,RES可通过调节幼年大鼠ALP水平促进骨骼生长;ALP不仅是类骨质形成和矿化的重要酶,也是骨形成的血清标志物,与成骨细胞和破骨细胞的活性变化有关。本研究发现,DEX+RES作用体外培养的成骨细胞后,RES可明显增强细胞内ALP的表达,证实RES可拮抗DEX对成骨细胞的成骨抑制效应,进而缓解糖皮质激素诱导的骨质流失。SIRT1在抑制肿瘤、维持线粒体稳态、能量代谢、细胞衰老以及细胞死亡等多种生物学功能的调控中发挥着重要的作用;最近的研究发现,SIRT1在小鼠体内的激活与骨质疏松等多种相关疾病的延迟发病有关[5];SIRT1的缺失或过表达会减少或增加小鼠的骨量[6];SIRT1还参与了组蛋白和非组蛋白赖氨酸残基之间的脱乙酰化,其中组蛋白会抑制骨形成,降低成骨细胞中ALP和骨钙素的表达,并减少成骨细胞的增殖和分化[7]。本研究发现,作为SIRT1的激动剂,RES有可能通过激活成骨细胞中SIRT1的蛋白活性表达,上调成骨细胞内ALP的活性,而SIRT1的特异性抑制剂NAM则可阻断此效应。
细胞自噬是真核细胞中溶酶体的降解途径。细胞自噬途径的功能紊乱与多种疾病的进展有关,如神经退行性疾病、肿瘤、糖尿病及骨质疏松症等。成骨细胞是骨形成的重要功能细胞,可产生细胞外基质蛋白和基质矿化调节因子,参与早期骨形成和晚期骨重建。体外培养敲除自噬基因(Beclin-1,Atg7)后的成骨细胞,会导致成骨细胞矿化过程缺乏[8];诱导成骨细胞自噬可以降低细胞的氧化应激并抑制细胞凋亡[9];研究[10]发现,成骨细胞内自噬的缺乏会增加氧化应激及降低其矿化能力,导致成骨细胞和破骨细胞的失衡,影响骨量的减少。本研究中,通过TEM观察到DEX作用成骨细胞后,细胞内的自噬小体明显增多,而RES可抑制DEX对自噬小体形成的促进作用;另外,RES可显著降低LC3和Beclin 1 mRNA的表达水平,表明RES可抑制细胞自噬的发生。本研究还发现,RES可干预成骨细胞内TOM20和Hsp60的活性。TOM20是一种线粒体外膜蛋白,是负责识别线粒体前导肽的重要受体,也是线粒体自噬发生的重要标志物。最近的研究[11]发现,血清饥饿诱导可促进HeLa细胞线粒体自噬,且伴有LC3蛋白表达升高及TOM20表达降低。Hsp60是一种线粒体基质蛋白,在活性氧诱导损伤线粒体中起重要的保护作用,也可作为线粒体自噬发生的标志物。本研究发现,DEX可明显促进成骨细胞内TOM20和Hsp60的蛋白表达,而RES能明显降低细胞内TOM20和Hsp60的蛋白表达,NAM则可阻断RES的此效应。
综上所述,本研究阐明了RES参与糖皮质激素诱导的成骨细胞线粒体自噬的作用机制。结果表明,RES通过上调SIRT1增强成骨细胞的增殖活性,并抑制DEX诱导的成骨细胞中线粒体自噬。
| [1] |
YANG RZ, XU WN, ZHENG HL, et al. Exosomes derived from vascular endothelial cells antagonize glucocorticoid-induced osteoporosis by inhibiting ferritinophagy with resultant limited ferroptosis of osteoblasts[J]. J Cell Physiol, 2021, 236(9): 6691-6705. DOI:10.1002/jcp.30331 |
| [2] |
WANG XD, MA HD, SUN J, et al. Mitochondrial ferritin deficiency promotes osteoblastic ferroptosis via mitophagy in type 2 diabetic osteoporosis[J]. Biol Trace Elem Res, 2022, 200(1): 298-307. DOI:10.1007/s12011-021-02627-z |
| [3] |
YU T, WANG ZY, YOU XM, et al. Resveratrol promotes osteogenesis and alleviates osteoporosis by inhibiting p53[J]. Aging, 2020, 12(11): 10359-10369. DOI:10.18632/aging.103262 |
| [4] |
MEI WH, SONG D, WU ZD, et al. Resveratrol protects MC3T3-E1 cells against cadmium-induced suppression of osteogenic differentiation by modulating the ERK1/2 and JNK pathways[J]. Ecotoxicol Environ Saf, 2021, 214: 112080. DOI:10.1016/j.ecoenv.2021.112080 |
| [5] |
ELSEWEIDY MM, ELSWEFY SE, SHAHEEN MA, et al. Effect of resveratrol and mesenchymal stem cell monotherapy and combined treatment in management of osteoporosis in ovariectomized rats: role of SIRT1/FOXO3a and Wnt/β-catenin pathways[J]. Arch Biochem Biophys, 2021, 703: 108856. DOI:10.1016/j.abb.2021.108856 |
| [6] |
CHEN XS, HAN DP, LIU TF, et al. Asiatic acid improves high-fat-diet-induced osteoporosis in mice via regulating SIRT1/FOXO1 signaling and inhibiting oxidative stress[J]. Histol Histopathol, 2022, 37(8): 769-777. DOI:10.14670/HH-18-446 |
| [7] |
LI P, MAO WW, ZHANG S, et al. Sodium hydrosulfide alleviates dexamethasone-induced cell senescence and dysfunction through targeting the miR-22/sirt1 pathway in osteoblastic MC3T3-E1 cells[J]. Exp Ther Med, 2021, 21(3): 238. DOI:10.3892/etm.2021.9669 |
| [8] |
ZHAO BK, PENG Q, POON EHL, et al. Leonurine promotes the osteoblast differentiation of rat BMSCs by activation of autophagy via the PI3K/Akt/mTOR pathway[J]. Front Bioeng Biotechnol, 2021, 9: 615191. DOI:10.3389/fbioe.2021.615191 |
| [9] |
WU YX, JIAO ZG, WAN ZT, et al. Role of autophagy and oxidative stress to astrocytes in fenpropathrin-induced parkinson-like da-mage[J]. Neurochem Int, 2021, 145: 105000. DOI:10.1016/j.neuint.2021.105000 |
| [10] |
WU M, LUO QY, NIE RX, et al. Potential implications of polyphenols on aging considering oxidative stress, inflammation, autophagy, and gut microbiota[J]. Crit Rev Food Sci Nutr, 2021, 61(13): 2175-2193. DOI:10.1080/10408398.2020.1773390 |
| [11] |
SULKSHANE P, RAM J, THAKUR A, et al. Ubiquitination and receptor-mediated mitophagy converge to eliminate oxidation-damaged mitochondria during hypoxia[J]. Redox Biol, 2021, 45: 102047. DOI:10.1016/j.redox.2021.102047 |
 2023, Vol. 52
2023, Vol. 52