文章信息
- 张萌, 石萌, 刘宝琴
- ZHANG Meng, SHI Meng, LIU Baoqin
- 铜稳态失衡相关疾病及铜死亡的研究进展
- Research progress on copper homeostasis imbalance related diseases and cuprotosis
- 中国医科大学学报, 2023, 52(12): 1125-1130
- Journal of China Medical University, 2023, 52(12): 1125-1130
-
文章历史
- 收稿日期:2022-06-09
- 网络出版时间:2023-12-07 11:36:22
2. 天津市肿瘤医院空港医院检验科,国家恶性肿瘤临床医学研究中心,天津 300308
2. Laboratory Department, Tianjin Cancer Hospital Airport Hospital, National Clinical Research Center for Cancer, Tianjin 300308, China
铜是生物体不可缺少的金属元素,对人体生物化学起关键作用。健康成人铜摄取量0.9 mg/d,主要经氨基酸转运蛋白在小肠内吸收,其吸收率约40%。组织中铜浓度为1~10 mg/g,血浆中铜浓度为1 000 ng/mL [1]。铜作为电子供体或者受体参与线粒体呼吸、神经递质的生物转化和结缔组织成熟过程。另外,铜还有其他生物学功能,包括胚胎发育、对血红蛋白水平的调控以及对肝细胞与神经元的调控功能等。体内铜有Cu+与Cu2+ 2种状态。体液中铜主要以Cu2+存在,细胞内主要以Cu+存在。在氧化还原酶作用下Cu+与Cu2+之间发生转换。铜特殊的电子结构使它作为氧化还原反应中酶的辅助因子参与并调控生物许多生命活动过程。
铜稳态是指机体对铜的吸收、分配、使用全过程处于动态平衡状态。尽管机体需要有足量铜来维持生长和发育,但铜过度积累会在机体内造成潜在的氧化损伤,或者会与生物大分子发生非正常结合[2]。铜转运系统在维持机体内铜稳态,确保组织正常功能方面起着关键性的作用。铜离子不足与过多均有危害,铜稳态失衡可能会导致各种疾病,并且与肿瘤的发生发展有关。铜死亡是铜依赖性受控细胞死亡方式,是一种新型细胞死亡方式。本文就铜转运系统、铜稳态失衡相关疾病与铜死亡进行综述,旨在为铜相关疾病的防治提供理论依据。
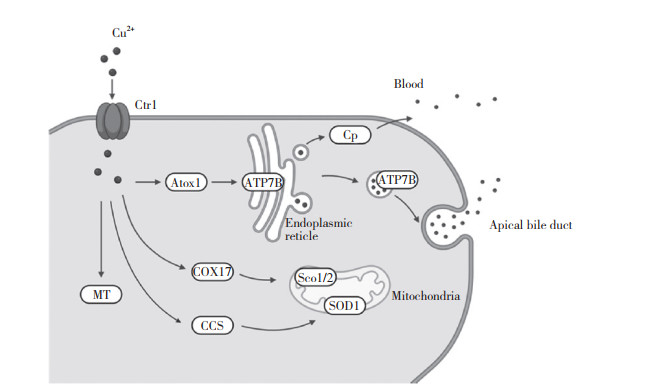
1 铜转运系统在多细胞生物体内,铜代谢包括吸收、分配、隔离和排泄。哺乳动物肠上皮细胞通过铜转运蛋白(copper transporter,Ctr) 1从食物中摄取铜离子。摄入后,铜离子被输送到铜转运P型ATP酶(ATP7A),ATP7A将肠细胞中的铜离子泵入血液。血液中铜离子经门静脉入肝,再通过Ctr1进入肝细胞[3]。在肝细胞中,如图 1所示,铜可通过胆管分泌,或经铜伴侣蛋白antioxidant 1 (Atox1) 和铜转运P型ATP酶(ATP7B) 转运、跨高尔基体网络转运后与铜蓝蛋白(ceruloplasmin,Cp) 结合释放到血液中。铜主要储存在线粒体中,细胞色素氧化酶17铜载体蛋白(cytochrome coxidase 17,COX17) 和Sco细胞色素氧化酶缺陷同源物1/2 (Sco 1/2) 结合作用于呼吸链复合体IV。过量铜也可以与金属硫蛋白(metallothionein,MT) 结合。另外,铜也通过超氧化物歧化酶的铜伴侣蛋白(Cu chaperone for SOD,CCS) 以及超氧化物歧化酶(superoxide dismutase,SOD) 1途径参与氧化应激调控。释放到血液中的铜通过与Cp、氨基酸或白蛋白结合来运输,通过相应的调节机制来维持铜动态平衡[4]。
|
| Ctr1, copper transporter 1;Atox1, antioxidant 1;Cp, ceruloplasmin; COX17, cytochrome coxidase 17;Sco 1/2, SCO cytochrome oxidase deficient homolog 1/2;CCS, Cu chaperone for SOD; SOD1, superoxide dismutase 1;MT, metallothionein. 图 1 细胞内铜转运 Fig.1 Intracellular copper transport |
铜转运系统中,Ctr家族、铜转运P型ATP酶、铜伴侣蛋白对于铜的摄取与转运以及维持细胞内铜稳态都起着至关重要的作用。
1.1 Ctr家族Ctr家族(Ctr1~5) 是真核细胞特异介导的铜吸收结构。Ctr1蛋白的结构M-XM2或M-X2-M,是细胞内进行代谢的前提条件和基础功能结构。Ctr2与Ctr1高度同源,编码低结合力转运蛋白。Ctr3是与Ctr1有关的铜缺失抑制物,其转运Cu2+的能力较强。Ctr4和Ctr5具有完整的膜蛋白结构,受铜水平和铜敏感因子共同调控[5]。Ctr1、Ctr3对铜吸收调节的高亲和力位点几乎在动物各组织中均有分布,且以肝脏及肾脏表达最多。Ctr1是细胞膜上的跨膜转运蛋白,Ctr1的C端在胞内,N端在胞外。Ctr1蛋白多以同型三聚体形式致密地排列于膜表面,与孔状结构相似,利于铜进入细胞[6]。Ctr1蛋白作为铜从细胞外向胞内转移的主要传送蛋白之一,其表达直接影响着体内铜代谢是否处于平衡状态,同时Ctr1蛋白还是铜吸收、转运以及促进生长等过程中的关键[7-8]。Ctr1蛋白表达受到体内Cu2+水平的调节,当体内Cu2+水平下降时会促进Ctr1蛋白表达,否则会抑制Ctr1蛋白表达。Ctr1对Cu2+的转运需要能量,受到细胞内H+浓度和细胞外K+浓度的影响。因此,细胞中仍然有其他物质能够利用Cu2+信号来调节Ctr1基因转录[9]。另有研究[10]显示,Ctr1翻译之后可能会通过负调控来调控细胞中Cu2+水平,通过提高Cu2+水平加速细胞膜上Ctr1蛋白的内吞与降解,从而调控铜吸收,避免铜超载。
当前已有研究表明哺乳动物体内至少有1条异于Ctr1蛋白所介导的铜转运途径。有研究[11]报道,敲除小鼠肠上皮细胞内Ctr1基因后发现8~10团高度聚集的铜,铜依赖性酶严重缺乏但CCS明显升高。细胞中高度聚集的铜不一定是通过Ctr1蛋白介导的铜转运进入细胞膜。另有研究[5]报道,铜含量缺乏的小鼠体内仅有一些特定组织(脑组织、脾脏等) 发现了Ctr1蛋白,提示Ctr1蛋白介导Cu2+的转运具有组织特异性,而其他组织则可能有异于Ctr1蛋白的转运机制来介导铜的转运。
1.2 铜转运P型ATP酶铜转运P型ATP酶有ATP7A和ATP7B 2个亚型,二者同源性较高,对细胞排泄Cu2+起关键性作用。ATP7A在小肠的表达较多,除了肝脏外,脑、肾脏及肌肉等部位均有少量表达。ATP7B表达以肝脏为主,脑、肾脏及胎盘等部位有少量表达。ATP7A和ATP7B主要分布在细胞内高尔基体上,C端存在6种Cu2+结合部位,每个结合部位可以与1个Cu2+结合进行铜的转运。ATP7A和ATP7B具有8种Tm跨膜区以及1种ATP结合部位[12]。N端可以和膜分子上63条氨基酸片段相结合,促进膜中囊小泡转运酶参与对铜的转运。铜转运P型ATP酶在体内主要与铜排泄有关,ATP7A、ATP7B共同催化ATP分解和供能,并促进铜排泄。
已有研究[13]报道,细胞内Cu2+水平正常时ATP7A更多是通过高尔基转运系统内铜分泌途径进行铜转运;而在细胞内铜水平升高时,ATP7A脱离高尔基体转运到细胞膜上并泵送Cu2+。可见ATP7A具有特异性铜结合位点,铜水平的改变对ATP7A转运产生影响。ATP7B基因缺陷后肝细胞无法转运铜至高尔基体中合成Cp,随着胆汁分泌而排出体外,或者大量铜进入血中沉积于肝和脑、肾和角膜等肝外组织,发生铜中毒而导致神经系统损伤[14]。
1.3 铜伴侣蛋白目前,已知细胞内主要的铜伴侣蛋白有Atox1、COX17和CCS。Atox1的结构为Met-X-Cys-X-X-Cys,结合并运载Cu2+至分泌部位。COX17是富含半胱氨酸的蛋白质,可结合1~4个Cu2+,为线粒体细胞色素氧化酶提供Cu2+。CCS能够将铜传递给Cu-ZnSOD。Ctr1蛋白在Cu2+转移到细胞后,随即与细胞中对应的铜伴侣蛋白融合、转运、组装到细胞中的不同靶蛋白上,协同发挥机体的多种生理功能。铜伴侣蛋白与Cu2+结合后辅助和转运到对应靶蛋白中发挥铜转运功能。铜伴侣蛋白能特异性地将铜转运至特定地点,在铜转运中必不可少;而且3种铜伴侣蛋白转运与调控方式均不相同。
1.3.1 Atox1主要分布于细胞质,Atox1将Cu2+向高尔基体上的ATP7A/B转运,再向Cp、赖氨酸酰氧化酶等铜依赖性蛋白酶(lysyloxidase,LOX) 转运,介导胞内过多铜离子向外释放[15]。有研究[16]报告敲除Atox1基因后细胞呈现Cu2+积累现象,表明Atox1在细胞内铜转运过程中发挥作用。
1.3.2 COX17最早研究[17]发现真菌中COX17具有细胞色素氧化酶作用,此后研究[18]发现哺乳动物中COX17具有活化细胞色素c氧化酶(cytochrome c oxidase,CCO) 和促进胚胎发育等作用。COX17接收从Ctr1蛋白转运来的Cu2+,再将Cu2+转运至线粒体,然后再转移至线粒体Sco1/2中,最后Cu2+组装成具有活性的CCO来发挥生物学作用[19]。
1.3.3 CCSCCS在哺乳动物细胞和酵母细胞内为SOD1提供Cu2+。已有研究[19]报道敲除CCS基因小鼠体内SOD1活性下降,SOD1敏感性升高,明确CCS是SOD1获得Cu2+的主要方式。
另外,铜伴侣蛋白的转运及调控中,可能还有其他铜伴侣蛋白一方面对细胞剩余游离铜毒性发挥屏蔽作用,另一方面也是特异性铜运输的载体,辅助组装到多种靶蛋白上,装配成活性蛋白而发挥作用。细胞中同时有许多铜伴侣蛋白,这些伴侣蛋白不是孤立存在,而是在体内互相协同转运发挥生物学功能。
总之,胞外Cu2+内流主要依靠高亲和力转运蛋白Ctr1,铜的利用途径包括Atox1-ATP7A/B-Cp途径、COX17-Sco1/2-CCO途径和CCS-SOD1途径。哺乳动物肠细胞和肝细胞中ATP7A和ATP7B将Cu2+泵入血液或胆汁中,由基底膜从肠细胞泵入血液的Cu2+可以转运到全身,而由ATP7B介导释放到胆汁中的Cu2+排出体外。铜通过这些途径进行转运,铜伴侣蛋白是可溶性胞质蛋白,它与Cu2+结合并将Cu2+运送到目标蛋白,即细胞通过蛋白质协调来保护自身不受Cu2+的伤害。
2 铜稳态失衡相关疾病 2.1 铜缺乏门克斯病是伴有X隐性遗传性疾病的罕见疾病,因ATP7A突变使铜无法由肠上皮细胞入血,妨碍大部分组织对铜的吸收与分配,从而造成机体铜的缺乏[20]。铜缺乏时首要临床表现为贫血、进一步铜缺乏可累及结缔组织缺陷甚至降低骨密度,铜缺乏症后期除全血细胞降低外还可出现严重精神症状[21]。门克斯病患者因铜转移到脑内减少而出现严重精神及发育障碍,一定程度上是由于铜依赖性酶活性下降所致。其临床表现除重度进行性神经变性外,还有结缔组织异常、肌张力下降、皮肤头发色素沉着减退等。
线粒体功能受损是造成门克斯病患者大脑严重损伤的重要原因。研究[22]发现,门克斯病患者CCO活性缺乏、脑内乳酸水平增高和N-乙酰天冬氨酸水平下降。这些产物与神经元线粒体能量的产生相关联,其水平变化可以作为线粒体氧化磷酸化失败的标志。
门克斯病治疗主要是肠内注入铜组氨酸,而且至少应在新生儿刚出生不久即开始治疗[23]。具有剩余ATP7A活性的门克斯病新生儿对这种治疗更敏感,因此,恢复低水平ATP7A的基因治疗可能成为一种替代的治疗方案。
2.2 铜过量肝豆状核变性疾病又称为威尔逊病,是主要发生于青少年的常染色体隐性遗传疾病,常伴有肝脏、眼和神经等症状,是铜运输ATP7B遗传缺陷所致。因ATP7B功能受损,铜无法由肝细胞分泌至胆汁而蓄积于肝脏等组织,引起恶性、呕吐及腹泻等肠胃道症状,导致慢性铜中毒。约半数威尔逊病患者出现中枢神经系统毒性表现,同时可影响神经节与脑协调活动部位而出现运动障碍[21, 24-26]。患者一般产生不正常星形胶质细胞(阿尔兹海默病Ⅰ型和Ⅱ型细胞),这可作为威尔逊病神经病理的典型特征。
威尔逊病治疗通常是限制饮食中铜的吸收;通过螯合治疗或肝移植来延长生存时间。研究[24, 27]认为,有或无神经系统症状的肝功能不全或肝炎患者应使用铜络合剂D-青霉胺、曲安汀或四硫代钼酸盐(TM) 或锌治疗。D-青霉胺作为还原性螯合剂可减少铜与蛋白质之间的亲和作用,从而更加高效地螯合铜,但是青霉胺还具有严重不良反应,可引起血液学或者肾脏毒性等。因此对无症状患者可采用锌处理。锌因诱导肠道MT合成导致体内铜水平下降,MT蛋白与铜亲和力强而形成铜-蛋白复合物,铜-蛋白复合物不吸收从粪便中排泄,因此,锌已成为威尔逊病维持治疗的首选药物[21]。
2.3 肿瘤铜参与肿瘤发生发展过程中的一系列生物学行为(肿瘤细胞的无限分裂,血管的生成与转移等等) [28-29]。近年来研究[30-32]发现肿瘤组织及肿瘤患者血清中Cu2+水平较正常组织明显偏高。可见细胞内Cu2+水平与肿瘤发生、发展密切相关。研究显示,一方面Cu2+可直接与血管生成因子结合,促使肿瘤组织血管生成[33];另一方面,Cu2+可活化肿瘤细胞中与增殖、代谢有关的蛋白酶,从而影响肿瘤细胞的侵袭和转移[34-35]。临床研究[36]显示癌变组织及患者血清中Cu2+含量显著增加,铁、锌等其他金属离子含量显著减少。
调控细胞内Cu2+浓度及转运途径在癌细胞增殖及转运过程中起着至关重要的作用,体内Cu2+含量减少使COX1活性、ATP含量下降,氧化磷酸化程度下降,进而抑制癌细胞增殖。Cu2+水平下降可以抑制细胞内上皮细胞-间质转化[37]。上皮细胞-间质转化是细胞释放极性和细胞间黏附而获得迁移和侵入的过程,但此结果是否在癌症患者体内发生尚不明确[37]。
研究[38]证明,抑制铜转运蛋白Atox1盒CCS可以显著抑制癌细胞增殖,而且不影响正常细胞;进行靶向Cu2+调控及转运通路的药物研究可能是抗肿瘤药物开发的一种新策略。治疗铜过量的经典药物为铜螯合剂四硫代钼酸盐,它能迅速螯合耗用铜而成为高效抗血管生成剂。四硫代钼酸盐具有双重作用,向食品中添加四硫代钼酸盐,可使铜及食品中蛋白组成三方复合物以阻止铜吸收[20, 39]。另有研究[40]报道COX17也能使抗肿瘤药物顺铂转移到线粒体内,进而促进细胞凋亡。另外,肿瘤组织中Cu2+水平高,应考虑抗癌药物与铜的相互作用[41]。
3 铜死亡多细胞生物在发育过程中,存在着多种预定的、精确控制下的细胞程序性死亡(细胞凋亡、程序性坏死、细胞焦亡以及铁死亡等) [42]。其中,铁死亡是2012年发现的一种铁依赖性的新型细胞程序性死亡方式[43]。铁死亡由过度堆积的过氧化脂质诱导发生,其形态特征、作用方式以及分子机制与其他程序性死亡方式截然不同。铜死亡是2022年3月发现的铜依赖性受控细胞死亡方式。研究[44]证实,当阻断已知的细胞死亡方式,铜离子仍然可以诱导细胞死亡。研究[44]进一步揭示了铜死亡的机制,是通过铜离子与线粒体呼吸的三羧酸循环中的脂酰化成分直接结合而发生的,导致脂酰化蛋白质聚集和随后的铁硫蛋白簇蛋白下调,从而导致蛋白质毒性应激并最终导致细胞死亡。研究[44]还确定了肝细胞和神经元更容易受到铜死亡的影响,这些发现有助于人们研究铜失调疾病,可为肿瘤治疗提供了新的思路。
4 总结与展望铜是人体不可忽视的微量元素,铜稳态对于维持生命体正常功能至关重要。铜稳态失衡可引起许多生理功能改变和疾病的发生。因此,未来有望通过调节细胞内铜的含量来治疗与铜相关的疾病。(1) 螯合剂治疗:使用特定的螯合剂来结合和清除体内过量的游离铜离子。这些螯合剂能够结合铜并促使其排出体外,从而降低细胞内铜的含量。(2) 铜代谢调控药物:开发药物来干预体内铜代谢的不正常过程。这包括促进铜的吸收、分配或排泄,以恢复正常的铜平衡。(3) 基因治疗:在某些遗传性铜代谢疾病中,可能使用基因治疗方法来修复或替代缺陷基因,以恢复正常的铜代谢。(4) 蛋白质调控:通过改变铜相关蛋白质的表达或功能,可以调节细胞内铜的含量。这可能包括增加或减少铜运输蛋白的表达,以控制铜的吸收和分配。(5) 定向疗法:针对特定疾病或情境,开发针对性的治疗方法。例如,对威尔逊病,可以使用针对ATP7B蛋白的药物来减少铜在肝脏中的积累。这些方法的开发和应用需要深入的研究,以确保它们的有效性和安全性。治疗铜相关疾病是一个复杂的领域,随着对铜代谢和铜相关疾病的深入了解,我们有望在未来提供更有效的治疗方法。
| [1] |
COOK MW, LAPENNA KB, BAKER JW, et al. Our patients do indeed have excess serum copper (and normal ceruloplasmin): the reasons why are yet to be determined[J]. Obes Surg, 2022, 32(6): 2071-2072. DOI:10.1007/s11695-021-05836-6 |
| [2] |
LINDER MC. Copper homeostasis in mammals, with emphasis on secretion and excretion. A review[J]. Int J Mol Sci, 2020, 21(14): 4932. DOI:10.3390/ijms21144932 |
| [3] |
LUTSENKO S. Dynamic and cell-specific transport networks for intracellular copper ions[J]. J Cell Sci, 2021, 134(21). DOI:10.1242/jcs.240523 |
| [4] |
BHATTACHARJEE A, CHAKRABORTY K, SHUKLA A. Cellular copper homeostasis: current concepts on its interplay with glutathione homeostasis and its implication in physiology and human diseases[J]. Metallomics, 2017, 9(10): 1376-1388. DOI:10.1039/C7MT00066A |
| [5] |
赵春雨, 张天芮, 刘博, 等. 机体内铜转运系统的研究进展[J]. 黑龙江畜牧兽医(上半月), 2016(6): 66-69. DOI:10.3969/j.issn.1002-2090.2009.06.009 |
| [6] |
REN FF, LOGEMAN BL, ZHANG XH, et al. X-ray structures of the high-affinity copper transporter Ctr1[J]. Nat Commun, 2019, 10: 1386. DOI:10.1038/s41467-019-09376-7 |
| [7] |
CURNOCK R, CULLEN PJ. Mammalian copper homeostasis requires retromer-dependent recycling of the high-affinity copper transporter 1[J]. J Cell Sci, 2020, 133(16): jcs249201. DOI:10.1242/jcs.249201 |
| [8] |
DAVIS CI, GU XX, KIEFER RM, et al. Altered copper homeostasis underlies sensitivity of hepatocellular carcinoma to copper chelation[J]. Metallomics, 2020, 12(12): 1995-2008. DOI:10.1039/D0MT00156B |
| [9] |
WEN Y, LI RX, PIAO XS, et al. Different copper sources and levels affect growth performance, copper content, carcass characteristics, intestinal microorganism and metabolism of finishing pigs[J]. Anim Nutr, 2022, 8(1): 321-330. DOI:10.1016/j.aninu.2021.10.007 |
| [10] |
HARRIS ED. Copper homeostasis: the role of cellular transporters[J]. Nutr Rev, 2001, 59(9): 281-285. DOI:10.1111/j.1753-4887.2001.tb07017.x |
| [11] |
ZIMNICKA AM, MARYON EB, KAPLAN JH. Human copper transporter hCTR1 mediates basolateral uptake of copper into enterocytes[J]. J Biol Chem, 2007, 282(36): 26471-26480. DOI:10.1074/jbc.m702653200 |
| [12] |
SPIERS JG, TAN LI SI, ANDERSON ST, et al. Hepatic homeostasis of metal ions following acute repeated stress exposure in rats[J]. Antioxidants, 2021, 11(1): 85. DOI:10.3390/antiox11010085 |
| [13] |
Arnesano F, Natile G. Interference between copper transport systems and platinum drugs[J]. Semin Cancer Biol, 2021, 76: 173-188. DOI:10.1016/j.semcancer.2021.05.023 |
| [14] |
MOOS T, MØLLER LB. Editorial: the neurodietetics and genetics of copper and iron[J]. Front Mol Neurosci, 2021, 14: 722234. DOI:10.3389/fnmol.2021.722234 |
| [15] |
张美琪, 陈林, 王晶. 铜转运蛋白与癌症的研究进展[J]. 中国科学: 化学, 2018, 48(11): 1385-1393. DOI:10.1360/N032018-00087 |
| [16] |
王希笛. 日粮铜源及水平对鸡小肠上皮细胞铜转运的影响[D]. 长春: 吉林农业大学, 2012.
|
| [17] |
HORNG YC, COBINE PA, MAXFIELD AB, et al. Specific copper transfer from the Cox17 metallochaperone to both Sco1 and Cox11 in the assembly of yeast cytochrome C oxidase[J]. J Biol Chem, 2004, 279(34): 35334-35340. DOI:10.1074/jbc.M404747200 |
| [18] |
TAKAHASHI Y, KAKO K, KASHIWABARA SI, et al. Mammalian copper chaperone Cox17p has an essential role in activation of cytochrome C oxidase and embryonic development[J]. Mol Cell Biol, 2002, 22(21): 7614-7621. DOI:10.1128/MCB.22.21.7614-7621.2002 |
| [19] |
ARNESANO F, BANCI L, BERTINI I, et al. Characterization of the binding interface between the copper chaperone Atx1 and the first cytosolic domain of Ccc2 ATPase[J]. J Biol Chem, 2001, 276(44): 41365-41376. DOI:10.1074/jbc.m104807200 |
| [20] |
HORN N, MØLLER LB, NURCHI VM, et al. Chelating principles in Menkes and Wilson diseases[J]. J Inorg Biochem, 2019, 190: 98-112. DOI:10.1016/j.jinorgbio.2018.10.009 |
| [21] |
GOODMAN VL, BREWER GJ, MERAJVER SD. Copper deficiency as an anti-cancer strategy[J]. Endocr Relat Cancer, 2004, 11(2): 255-263. DOI:10.1677/erc.0.0110255 |
| [22] |
BATZIOS S, TAL G, DISTASIO AT, et al. Newly identified disorder of copper metabolism caused by variants in CTR1, a high-affinity copper transporter[J]. Hum Mol Genet, 2022, 31(24): 4121-30. DOI:10.1093/hmg |
| [23] |
VAIRO FPE, CHWAL BC, PERINI S, et al. A systematic review and evidence-based guideline for diagnosis and treatment of Menkes disease[J]. Mol Genet Metab, 2019, 126(1): 6-13. DOI:10.1016/j.ymgme.2018.12.005 |
| [24] |
CZŁONKOWSKA A, LITWIN T, DUSEK P, et al. Wilson disease[J]. Nat Rev Dis Primers, 2018, 4: 21. DOI:10.1038/s41572-018-0018-3 |
| [25] |
ZISCHKA H, EINER C. Mitochondrial copper homeostasis and its derailment in Wilson disease[J]. Int J Biochem Cell Biol, 2018, 102: 71-75. DOI:10.1016/j.biocel.2018.07.001 |
| [26] |
AGGARWAL A, BHATT M. Wilson disease[J]. Curr Opin Neurol, 2020, 33(4): 534-542. DOI:10.1097/wco.0000000000000837 |
| [27] |
SMIRNOVA J, KABIN E, JÄRVING I, et al. Copper (I) -binding properties of de-coppering drugs for the treatment of Wilson disease. α-Lipoic acid as a potential anti-copper agent[J]. Sci Rep, 2018, 8: 1463. DOI:10.1038/s41598-018-19873-2 |
| [28] |
GE EJ, BUSH AI, CASINI A, et al. Connecting copper and cancer: from transition metal signalling to metalloplasia[J]. Nat Rev Cancer, 2022, 22(2): 102-113. DOI:10.1038/s41568-021-00417-2 |
| [29] |
GUO JP, CHENG J, ZHENG NN, et al. Copper promotes tumorigenesis by activating the PDK1-AKT oncogenic pathway in a copper transporter 1 dependent manner[J]. Adv Sci (Weinh), 2021, 8(18): e2004303. DOI:10.1002/advs.202004303 |
| [30] |
DENOYER D, MASALDAN S, LA FONTAINE S, et al. Targeting copper in cancer therapy: 'Copper That Cancer'[J]. Metallomics, 2015, 7(11): 1459-1476. DOI:10.1039/c5mt00149h |
| [31] |
SU YQ, ZHANG XM, LI SQ, et al. Emerging roles of the copper-CTR1 axis in tumorigenesis[J]. Mol Cancer Res, 2022. |
| [32] |
TSANG T, POSIMO JM, GUDIEL AA, et al. Copper is an essential regulator of the autophagic kinases ULK1/2 to drive lung adenocarcinoma[J]. Nat Cell Biol, 2020, 22(4): 412-424. DOI:10.1038/s41556-020-0481-4 |
| [33] |
KARGINOVA O, WEEKLEY CM, RAOUL A, et al. Inhibition of copper transport induces apoptosis in triple-negative breast cancer cells and suppresses tumor angiogenesis[J]. Mol Cancer Ther, 2019, 18(5): 873-885. DOI:10.1158/1535-7163.MCT-18-0667 |
| [34] |
BOSCHI A, MARTINI P, JANEVIK-IVANOVSKA E, et al. The emerging role of copper-64 radiopharmaceuticals as cancer theranostics[J]. Drug Discov Today, 2018, 23(8): 1489-1501. DOI:10.1016/j.drudis.2018.04.002 |
| [35] |
SHIMADA K, REZNIK E, STOKES ME, et al. Copper-binding small molecule induces oxidative stress and cell-cycle arrest in glioblastoma-patient-derived cells[J]. Cell Chem Biol, 2018, 25(5): 585-594. DOI:10.1016/j.chembiol.2018.02.010 |
| [36] |
CHEN QIAO YI, DESMARAIS T, COSTA M. Metals and mechanisms of carcinogenesis[J]. Annu Rev Pharmacol Toxicol, 2019, 59: 537-554. DOI:10.1146/annurev-pharmtox-010818-021031 |
| [37] |
BRABLETZ T, KALLURI R, NIETO MA, et al. EMT in cancer[J]. Nat Rev Cancer, 2018, 18(2): 128-134. DOI:10.1038/nrc.2017.118 |
| [38] |
ISHIDA S, ANDREUX P, POITRY-YAMATE C, et al. Bioavailable copper modulates oxidative phosphorylation and growth of tumors[J]. Proc Natl Acad Sci USA, 2013, 110(48): 19507-19512. DOI:10.1073/pnas.1318431110 |
| [39] |
TIAN Y, FANG TT, YUAN SM, et al. Tetrathiomolybdate inhibits the reaction of cisplatin with human copper chaperone Atox1[J]. Metallomics, 2018, 10(5): 745-750. DOI:10.1039/C8MT00084K |
| [40] |
SHANBHAG VC, GUDEKAR N, JASMER K, et al. Copper metabolism as a unique vulnerability in cancer[J]. Biochim Biophys Acta Mol Cell Res, 2021, 1868(2): 118893. DOI:10.1016/j.bbamcr.2020.118893 |
| [41] |
KUO MT, HUANG YF, CHOU CY, et al. Targeting the copper transport system to improve treatment efficacies of platinum-containing drugs in cancer chemotherapy[J]. Pharmaceuticals, 2021, 14(6): 549. DOI:10.3390/ph14060549 |
| [42] |
LI X, SHAO FL, SUN J, et al. Enhanced copper-temozolomide interactions by protein for chemotherapy against glioblastoma multiforme[J]. ACS Appl Mater Interfaces, 2019, 11(45): 41935-41945. DOI:10.1021/acsami.9b14849 |
| [43] |
TANG DL, KANG R, BERGHE TV, et al. The molecular machinery of regulated cell death[J]. Cell Res, 2019, 29(5): 347-364. DOI:10.1038/s41422-019-0164-5 |
| [44] |
DIXON SJ, LEMBERG KM, LAMPRECHT MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072. DOI:10.1016/j.cell.2012.03.042 |
 2023, Vol. 52
2023, Vol. 52