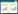文章信息
- 曹雪峰, 赵亮, 方波, 刘旭东, 段凤梅, 姬云飞
- CAO Xuefeng, ZHAO Liang, FANG Bo, LIU Xudong, DUAN Fengmei, JI Yunfei
- 右美托咪定对病理性心肌细胞肥大的保护作用
- Protective effect of dexmedetomidine on pathological cardiomyocyte hypertrophy
- 中国医科大学学报, 2023, 52(12): 1057-1061
- Journal of China Medical University, 2023, 52(12): 1057-1061
-
文章历史
- 收稿日期:2023-01-29
- 网络出版时间:2023-12-07 11:14:47
2. 承德医学院基础医学院药理教研室,河北 承德 067000;
3. 中国医科大学附属第一医院麻醉科,沈阳 110001;
4. 承德市中心医院麻醉疼痛科,河北 承德 067000
2. Department of Pharmacology, School of Basic Medicine, Chengde Medical College, Chengde 067000, China;
3. Department of Anesthesiology, The First Hospital of China Medical University, Shenyang 110001, China;
4. Department of Anesthesiology and pain, Chengde Central Hospital, Chengde 067000, China
心肌肥厚是重要心血管疾病的高危因素,是心功能恶化及心源性死亡的独立危险因素,会增加冠状动脉粥样硬化性心脏病、充血性心力衰竭等其他心血管疾病的发生率,而这些疾病都易导致患者病死率的增加甚至猝死的发生[1-2]。对于心肌肥厚的治疗,目前仍局限于降低心肌收缩力、扩张血管和降低后负荷等手段,很少直接针对心肌肥大的形成过程进行干预。心肌肥厚的改善可以降低心血管疾病的危险性,深入研究心肌肥厚的发生机制,将为药物干预及防治心肌肥厚开拓全新的思路。
右美托咪定(dexmedetomidine,DEX) 是一种α2-肾上腺素能受体(α2-adrenergic receptor,α2-AR) 激动剂,对心血管有直接作用,目前研究[3-7]主要针对心肌缺血再灌注损伤的保护作用。DEX具有抗交感和稳定循环的功能,围手术期使用DEX可改善行心脏手术患者的预后[8],目前关于DEX对病理性心肌肥大的保护作用研究甚少。本研究旨在探究DEX通过诱发代偿性心肌肥大来改善病理性心肌肥大的过程。
1 材料与方法 1.1 主要仪器二氧化碳细胞培养箱(日本三洋株式会社PHCbi公司);倒置显微镜(日本奥林巴斯株式会社Olympus公司);低温恒速变速离心机(德国艾本德股份公司Eppendorf公司);ECL化学发光仪(中国天能科技责任有限公司Tanon公司);激光扫描共聚焦显微成像系统FV3000 (日本奥林巴斯株式会社)。
1.2 主要药品与试剂DEX (批号HY-12719,纯度99.63%) 购自美国新泽西MedChemExpress生物科技有限公司;高糖培养基(批号C11330500BT) 购自中国武汉普诺赛生命科技有限公司(规格:500 mL/瓶);南美胎牛血清(批号10270106) 购自中国Gibco赛默飞世尔科技股份有限公司(规格:500 mL/瓶);胰蛋白酶含EDTA (批号10039232) 购自中国Phygene飞净生物高新技术股份有限公司(规格:100 mL/瓶);二甲基亚砜(批号KMO0697) 购自中国天津科密欧化学试剂有限公司(规格:500 mL/瓶)。心房钠尿肽(atrial natriuretic peptide,ANP) 抗体(批号ab189921) 购自英国abcam生物科技有限公司(规格:100 μL/支);脑尿钠肽(brain natriuretic peptide,BNP) (批号ab19646)、肌球蛋白重链(β- myosin heavy chain,β-MHC) 抗体和α-actinin抗体(批号EP2528Y) 均购自英国abcam生物科技有限公司(规格:100 μL/支)。
1.3 实验分组实验分为6组,无血清培养液培养细胞24 h作为对照组(C组);无血清培养液中加血管紧张素Ⅱ (angiotensinⅡ,Ang Ⅱ,1 μmol/L),细胞培养24 h作为模型组(A组);无血清培养液中加入Ang Ⅱ(1 μmol/L)+ DEX (5 μmol/L),培养24 h作为右美托咪定组(AD组);无血清培养液培养细胞48 h作为C’组;无血清培养液加入Ang Ⅱ(1 μmol/L),培育24 h,停药24 h作为A’组;无血清培养液加入DEX (5 μmol/L)+Ang Ⅱ(1 μmol/L),培育24 h,停药24 h作为AD’组。
1.4 实验方法 1.4.1 新生大鼠心室肌细胞(neonatal rat ventricle myocytes,NRVMs) 分离培养无菌环境下,将新生大鼠心室肌剪成1 mm3,用DMEM冲洗。弃去上清液,加入含0.25%胰蛋白酶消化,37 ℃进行5 min,弃去消化液,细胞转移到含有20 mL DMEM培养液的试管中,以1 000 r/min离心5 min,弃上清液,细胞沉淀再次用培养液重悬。重悬液经筛网过滤,用差速贴壁分选法分离2 h后计数,以1×105/cm2细胞浓度接种于培养皿中,3 d后可以用于实验。本研究获得承德医学院动物保护与使用委员会批准,并按照《国家卫生研究院实验动物中心小动物区动物使用》要求执行。
1.4.2 离体心肌肥厚模型建立细胞贴壁3 d后,用含有1%胎牛血清的DMEM培养液替换正常细胞培养液,加入浓度为1 μmol/L的Ang Ⅱ,于37 ℃、5%CO2、95%湿度环境中培养,培养1 d后,通过检测心肌细胞面积、体积、肥大相关基因(ANP、BNP和β-MHC) 蛋白含量来判断模型是否成功。
1.4.3 免疫荧光化学染色心肌细胞用PBS洗3遍,冷甲醇固定30 min,加入TritonX2100,1%BSA室温孵育1 h,封闭羊血清封闭5 h,一抗37 ℃孵育,荧光二抗37 ℃孵育,共聚焦成像系统观察蛋白表达和定位。
1.4.4 心肌细胞面积测量将细胞接种于6孔板(3×105/孔) 上,不同组别分别加入生理盐水,Ang Ⅱ和DEX (5 μmol/L) 孵育24 h,应用医学图像分析系统测量单个细胞表面积,确认心肌细胞肥大的发生情况。
1.4.5 CCK-8检测细胞活性当细胞生长至70%~80%
融合时,用胰酶消化,收集贴壁细胞后计数,制成5×104/mL密度的细胞悬液,在96孔板中配置100 μL的细胞悬液。在培养箱预培养24 h (37 ℃,5%CO2)。更换1%FBS+DMEM低血清培养液,随机分为6组,并设置空白对照孔。分别在常氧和低氧培养箱中培养24 h。每孔加入10 μL CCK溶液。在培养箱内孵育1~4 h,2 h后用酶标仪测定在450 nm处的吸光度。
1.4.6 Western blotting检测心肌细胞(细胞数量约2×106~3×106) 吸管吹打后冰里放置30 min,离心(20 000 r/min、4 ℃、10 min),取上清液,按Bradford法测定蛋白浓度。稀释后100 ℃变性5 min,8%~10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白质,半干式电转膜60~120 min,5%脱脂牛奶室温封闭1 h。分别加入ANP、BNP、β-MHC抗体,4 ℃过夜,加入二抗室温孵育1 h后DAB显影,凝胶成像仪分析系统扫描,计算各条带与内参照(β-actin)的相对灰度值作为各蛋白表达的相对含量。
1.5 统计学分析采用GraphPad Prism软件进行统计分析。数据以x±s表示。2组间差异比较采用t检验。采用单因素方差分析(ANOVA) 比较多组间差异。P < 0.05为差异有统计学意义。
2 结果 2.1 3组大鼠心肌细胞的形态变化与C组比较,A组和AD组细胞面积均增加,差异有统计学意义(P < 0.01)。提示Ang Ⅱ和DEX能够诱导心肌细胞肥大。见图 1。
|
| A, cardiomyocytes stained with α-actinin were observed by a confocal imaging system×200. Red, α-actinin cardiomyocytes; blue, DAPI-stained myocardial nuclei. B, statistical diagram of relative area of cells in groups C, A, and AD. *P < 0.001 vs group C. 图 1 Ang Ⅱ、DEX诱发心肌细胞发生肥大 Fig.1 Cardiomyocyte hypertrophy induced by AngⅡand DEX |
2.2 3组大鼠心肌细胞ANP、BNP和β-MHC蛋白的表达
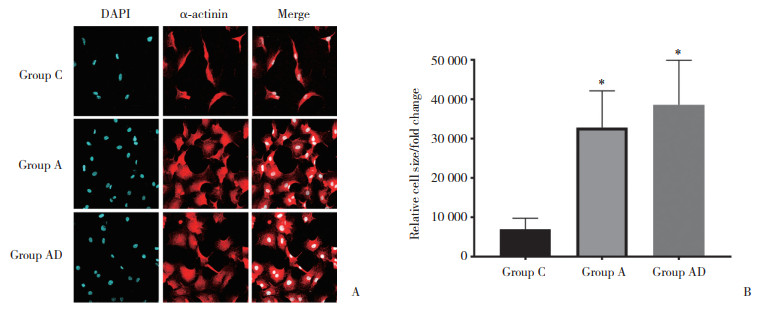
与C组比较,A组和AD组的ANP、BNP和β-MHC蛋白表达均增加,且AD组增加更为显著(图 2),差异有统计学意义(P < 0.05)。
|
| A, Western blotting detection of ANP, BNP, and β-MHC expression in three groups of cardiomyocytes; B, statistical map of ANP, BNP, and β-MHC protein expression in cardiomyocytes of the three groups. 1, group C; 2, group A; 3, group AD. **P < 0.01, ***P < 0.001 vs group C. 图 2 DEX增加心肌肥大相关蛋白的表达 Fig.2 DEX increased the expression of cardiac hypertrophy associated protein |
2.3 CCK-8细胞活性检测结果
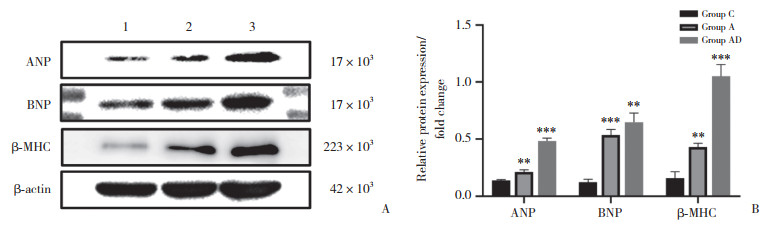
为了检测不同药物浓度对细胞活性的影响,加入高浓度DEX (10 μmol/L和20 μmol/L) 组,结果显示,与C组比较,A组细胞活性明显降低;而与A组比较,AD组以及Ang Ⅱ+DEX (10 μmol/L)、Ang Ⅱ+DEX (20 μmol/L) 细胞活性明显升高。为了研究药物作用时长对细胞活性的影响,同样的组别,继续孵育细胞至36 h再次检测CCK-8,结果显示细胞趋势与24 h一致(图 3)。证实Ang Ⅱ诱导心肌肥大,细胞活性降低;而DEX诱导心肌肥大,细胞活性明显升高。DEX明显改善了Ang Ⅱ引起的细胞活性降低,与A组比较,AD组与C组细胞活性差异均有统计学意义(P < 0.01)。
|
| A, after incubation for 24 hours, the cell viability was detected by CCK-8;B, after incubation for 36 hours, the cell viability was detected by CCK-8. **P < 0.01 vs group C; ##P < 0.01, ###P < 0.001 vs group A. 图 3 DEX增加病理性心肌肥大细胞的活性 Fig.3 DEX increased the activity of pathological myocardial mast cells |
2.4 C’、A’和AD’各组肥大相关蛋白的表达
将大鼠心肌细胞分成3组验证肥大相关蛋白ANP、BNP和β-MHC的表达。与C’组比较,A’组ANP、BNP、β-MHC蛋白表达明显增加。与A’组比较,AD’组肥大相关蛋白ANP和BNP的表达明显减少,β-MHC并无明显改变(图 4)。停药24 h后,DEX能明显减少Ang Ⅱ引起的病理性心肌肥大相关蛋白的表达,而停药后A’组肥大相关蛋白未见减少。证实DEX通过诱导代偿性、类似于生理性心肌肥大来产生心肌保护作用。

|
| 1, group C'; 2, group A'; 3, group AD'. 图 4 DEX对病理性心肌肥大发生的影响 Fig.4 Effect of DEX on pathological cardiac hypertrophy |
3 讨论
DEX具有镇痛、镇静和抗焦虑的临床作用[9-11]。DEX与其他全身麻醉药物合用可以减少麻醉药物的用量,复合局部麻醉药物的使用可以延长麻醉作用时间。与苯二氮卓类镇静药物相比,DEX能镇静且不抑制呼吸,患者进入类似于生理睡眠的状态,大大提升了麻醉的安全性和患者的舒适度。DEX应用范围广且不良反应轻,近年研究重点已转移至脏器保护方面,包括对心肌的保护作用。DEX可以减少心肌缺血/再灌注损伤中的促炎细胞因子和氧化产物,从而减轻心肌损伤[12]。DEX通过抑制线粒体活性氧生成减轻阿霉素心脏毒性[13]。本研究结果显示,与C组比较,A组细胞面积增大,心肌肥大相关蛋白ANP、BNP和β-MHC表达增加,证明离体心肌肥大模型建立成功。AD组细胞面积进一步增大,肥大相关蛋白表达进一步增加,提示DEX促进了心肌肥大的发生。既往研究[3-4]发现DEX有心肌保护作用,提示DEX可能诱发生理性心肌肥大的发生。
生理性心肌肥厚是指体育锻炼或妊娠等所致的心肌肥厚,随着体育锻炼终止或妊娠结束生理性心肌肥厚将恢复[14]。生理性肥厚引起左心室容积增加、室壁厚度增大,但室壁厚度与心脏质量成比例增加,不发生心肌纤维化,是一种良性的适应性改变,有助于提高心功能,对病理性的心肌损伤具有保护效应。为探究DEX引起的心肌肥大的性质,本研究模拟了体外实验C’组、A’组和AD’组。其中AD’组类似于身体锻炼或妊娠结束,随着加药终止,肥大相关蛋白ANP、BNP明显减少,接近C’组,而A’组没有随加药的终止而减少。这说明DEX诱发的心肌细胞肥大是可逆的且为代偿性,对肥大心肌细胞是一种保护作用。
本研究存在一定局限性,缺少体内实验验证,未来将开展体内实验,进一步研究DEX诱发生理性心肌肥厚保护心肌细胞的分子机制。探讨心肌肥厚发生机制对心血管领域研究具有重要的理论价值和临床意义,有望为临床诊疗提供新思路。
| [1] |
RIAZ S, ZEIDAN A, MRAICHE F. Myocardial proteases and cardiac remodeling[J]. J Cell Physiol, 2017, 232(12): 3244-3250. DOI:10.1002/jcp.25884 |
| [2] |
ZHAO L, WU D, SANG M, et al. Stachydrine ameliorates isoprote-renol-induced cardiac hypertrophy and fibrosis by suppressing inflammation and oxidative stress through inhibiting NF-κB and JAK/STAT signaling pathways in rats[J]. Int Immunopharmacol, 2017, 48: 102-109. DOI:10.1016/j.intimp.2017.05.002 |
| [3] |
OKADA H, KURITA T, MOCHIZUKI T, et al. The cardioprotective effect of dexmedetomidine on global ischaemia in isolated rat hearts[J]. Resuscitation, 2007, 74(3): 538-545. DOI:10.1016/j.resuscitation.2007.01.032 |
| [4] |
KOCOGLU H, KARAASLAN K, GONCA E, et al. Preconditionin effects of dexmedetomidine on myocardial ischemia/reperfusion injury in rats[J]. Curr Ther Res Clin Exp, 2008, 69(2): 150-158. DOI:10.1016/j.curtheres.2008.04.003 |
| [5] |
YOSHITOMI O, CHO S, HARA T, et al. Direct protective effects of dexmedetomidine against myocardial ischemia-reperfusion injury in anesthetized pigs[J]. Shock, 2012, 38(1): 92-97. DOI:10.1097/shk.0b013e318254d3fb |
| [6] |
IBACACHE M, SANCHEZ G, PEDROZO Z, et al. Dexmedetomidine preconditioning activates pro-survival kinases and attenuates regional ischemia/reperfusion injury in rat heart[J]. Biochim Biophys Acta BBA Mol Basis Dis, 2012, 1822(4): 537-545. DOI:10.1016/j.bbadis.2011.12.013 |
| [7] |
RIQUELME JA, WESTERMEIER F, HALL AR, et al. Dexmedetomidine protects the heart against ischemia-reperfusion injury by an endothelial eNOS/NO dependent mechanism[J]. Pharmacol Res, 2016, 103: 318-327. DOI:10.1016/j.phrs.2015.11.004 |
| [8] |
JI FH, LI ZM, NGUYEN H, et al. Perioperative dexmedetomidine improves outcomes of cardiac surgery[J]. Circulation, 2013, 127(15): 1576-1584. DOI:10.1161/CIRCULATIONAHA.112.000936 |
| [9] |
NGUYEN V, TIEMANN D, PARK E, et al. Alpha-2 agonists[J]. Ane-sthesiol Clin, 2017, 35(2): 233-245. DOI:10.1016/j.anclin.2017.01.009 |
| [10] |
WANG YQ, ZHANG XJ, WANG Y. Effect of intrathecal dexmedetomidine on cesarean section during spinal anesthesia: a meta-analysis of randomized trials[J]. Drug Des Dev Ther, 2019, 13: 2933-2939. DOI:10.2147/dDDT.s207812 |
| [11] |
PAN H, LIU CX, MA XC, et al. Perioperative dexmedetomidine reduces delirium in elderly patients after non-cardiac surgery: a systematic review and meta-analysis of randomized-controlled trials[J]. Can J Anesth Can D'anesthésie, 2019, 66(12): 1489-1500. DOI:10.1007/s12630-019-01440-6 |
| [12] |
XU Z, Wang D, ZHOU Z, et al. Dexmedetomidine attenuates renal and myocardial ischemia/reperfusion injury in a dose-dependent manner by inhibiting inflammatory response[J]. Ann Clin Lab Sci, 2019, 49(1): 31-35. DOI:10.7727/wimj.2016.455 |
| [13] |
YU JL, JIN Y, CAO XY, et al. Dexmedetomidine alleviates doxorubicin cardiotoxicity by inhibiting mitochondrial reactive oxygen species generation[J]. Hum Cell, 2020, 33(1): 47-56. DOI:10.1007/s13577-019-00282-0 |
| [14] |
OKA T, AKAZAWA H, NAITO AT, et al. Angiogenesis and cardiac hypertrophy: maintenance of cardiac function and causative roles in heart failure[J]. Circ Res, 2014, 114(3): 565-571. DOI:10.1161/CIRCRESAHA.114.300507 |
 2023, Vol. 52
2023, Vol. 52