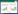文章信息
- 申开文, 张瑞波, 王强, 袁强, 沈俊
- SHEN Kaiwen, ZHANG Ruibo, WANG Qiang, YUAN Qiang, SHEN Jun
- 丹皮酚对大鼠肾缺血再灌注损伤的作用及其机制
- Effect of paeonol on renal ischemia-reperfusion injury in rats and its mechanism
- 中国医科大学学报, 2023, 52(11): 1004-1008, 1014
- Journal of China Medical University, 2023, 52(11): 1004-1008, 1014
-
文章历史
- 收稿日期:2022-12-20
- 网络出版时间:2023-11-02 14:37:29
2. 中山大学附属第一医院贵州医院泌尿外科, 贵阳 550000
2. Department of Urology Surgery, Guizhou Hospital, The First Affiliated Hospital of Sun Yat-sen University, Guiyang 550000, China
肾缺血再灌注损伤(renal ischemia reperfusion injury,RIRI)是急性肾损伤(acute kidney injury,AKI)的常见原因,也是影响肾移植术后存活率的关键因素。AKI进展经常导致多器官衰竭和败血症,因此有必要开发有效的方法来预防或减轻RIRI [1]。细胞焦亡是RIRI的一个重要过程,是一种不同于细胞凋亡和坏死的促炎程序性细胞死亡,其特征是促炎细胞因子和细胞内容物的释放。抑制细胞焦亡可以减轻RIRI。Gasdermin D(GSDMD)蛋白是细胞焦亡的关键效应蛋白。GSDMD的N末端由活性caspase 1或caspase 11产生,它们形成细胞膜孔,导致细胞死亡并释放成熟形式的白细胞介素(interleukin,IL)-1β和IL-18,进而发生细胞焦亡[2-3]。Toll样受体4(toll-like receptor 4,TLR4)信号通路过度激活也是RIRI的一种机制,在RIRI大鼠模型中可观察到TLR4表达明显上调,导致TLR4下游信号分子MyD88和NF-κB激活,促炎细胞因子和趋化因子分泌增加[4]。
丹皮酚是从牡丹皮中提取的一种生物活性成分,具有广泛缓解动脉粥样硬化病变的药理特性,与改善内皮损伤、抑制血管平滑肌细胞及降低血脂有关[5]。除此之外,丹皮酚还具有抑制炎症反应、抗氧化、抗肿瘤等多种药理作用[6-8]。以往关于丹皮酚在RIRI中的重要作用主要集中在对肝脏、大脑及心脏方面的研究,目前,丹皮酚在RIRI中作用的研究鲜有报道。本研究应用丹皮酚干预后建立大鼠RIRI模型,探讨丹皮酚对大鼠RIRI的影响及其机制,旨在为临床防治RIRI提供新的思路。
1 材料与方法 1.1 实验动物与试剂SPF级雄性SD大鼠30只,体质量170~200 g,购自辽宁长生生物技术股份有限公司[合格证号:SCXK(辽)2020-0001]。大鼠于贵州医科大学实验动物中心饲养,饲养条件:湿度40%~70%、温度20~26 ℃、昼夜12 h明暗交替、自由饮水和进食。丹皮酚、TLR4抑制剂(TAK242)购于贵州明涵生物科技有限公司,HE染液购于武汉阿斯本生物技术有限公司,血尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,Scr)检测试剂盒购于南京建成生物工程研究所,胱抑素C(cystatin C,CysC)检测试剂盒、IL-1β和IL-18检测试剂盒购于科鹿(武汉)生物科技有限责任公司。蛋白质印迹抗体,NLRP3、GSDMD、IL-1β一抗购于英国Abcam公司,caspase 1购于江苏亲科生物研究中心有限公司,TLR4、IL-18一抗购于武汉三鹰生物技术有限公司,MyD88一抗购于美国CST公司,二抗均购于武汉阿斯本生物技术有限公司。免疫组化抗体,caspase 1、IL-18一抗购于武汉三鹰生物技术有限公司,TLR4,IL-1β一抗购于美国Affinity公司,MyD88一抗购于英国abcam公司,二抗均购于武汉塞维尔生物科技有限公司。
1.2 实验分组与RIRI模型建立将30只SD大鼠适应性喂养7 d后随机分为5组:假手术组(Sham组)、模型组(RIRI组)、丹皮酚组(Pae组)、TLR4抑制剂组(TAK242组)和丹皮酚+ TLR4抑制剂组(Pae+TAK242组),每组6只。本研究获得贵州医科大学动物伦理委员会批准。
大鼠术前8~12 h禁饮食。建模前2 h Pae组和Pae+TAK242组分别腹腔注射丹皮酚(50 mg/kg)[9],TAK242组和Pae+TAK242组大鼠分别腹腔注射TAK242(3 mg/kg)[10],Sham组和RIRI组大鼠腹腔注射等量生理盐水。大鼠腹腔注射3%戊巴比妥钠(50 mg/kg)进行麻醉,麻醉生效后沿腹中线切开腹部,逐层分离皮肤、皮下组织进入腹腔,RIRI组、Pae组、TAK242组和Pae+TAK242组大鼠暴露双侧肾蒂后用微型动脉夹钳夹住双肾肾蒂周围45 min后松开。通过肾脏颜色改变判断缺血及再灌注是否成功。Sham组大鼠手术进入腹腔后仅游离双侧肾蒂,但不夹闭肾蒂。术闭,各组大鼠缝合腹部切口后饲养24 h,麻醉处死后留取血清和肾组织进行后续实验。
1.3 检测方法 1.3.1 大鼠肾功能检查采用试剂盒检测各组大鼠BUN、Scr和CysC水平,具体操作按照试剂盒说明书进行。
1.3.2 酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)采用ELISA试剂盒检测各组大鼠血清IL-1β和IL-18水平,具体操作按照试剂盒说明书进行。
1.3.3 病理学检查4%多聚甲醛固定肾组织标本24 h以上,脱水后包埋在石蜡中。石蜡切片脱蜡水洗后进行HE染色,通过光镜观察肾脏损伤情况。
1.3.4 免疫组织化学染色肾组织石蜡切片脱蜡后水洗,抗原修复,封闭。一抗(1∶300)覆盖切片4 ℃孵育过夜,洗涤后辣根过氧化物酶(horseradish peroxidase,HRP)偶联的山羊抗兔二抗(1∶200)孵育,显微镜控制下3,3’-二氨基联苯胺(3,3’-diaminobenzidine,DAB)染色,光学显微镜观察,MicroPublisher获取图像,细胞核或胞质染色呈黄褐色为阳性染色。
1.3.5 Western blotting检测提取各组大鼠肾组织蛋白,检测TLR4、MyD88以及焦亡相关蛋白NLRP3、caspase 1、GSDMD、IL-1β、IL-18的表达。一抗覆盖聚偏氟乙烯膜4 ℃孵育过夜,洗涤后HRP偶联的二抗孵育1 h。使用化学发光对印迹进行检测,采用Image J软件进行分析。
1.4 统计学分析采用GraphPad Prism 7.01软件对数据进行统计学分析。计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P < 0.05为差异有统计学意义。
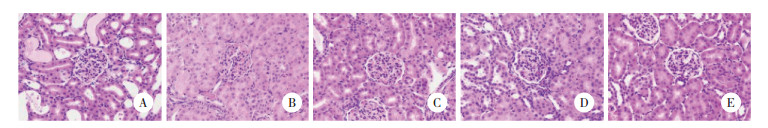
2 结果 2.1 丹皮酚对RIRI后大鼠肾脏病理及肾功能的影响HE染色结果显示,与Sham组比较,RIRI组肾脏结构紊乱,肾小管上皮细胞严重变性坏死,Pae组及TAK242组肾小管上皮细胞轻度坏死,Pae联合TAK242组肾脏结构基本完整,少量细胞坏死(图 1)。RIRI组Scr、BUN和CysC水平较Sham组升高;Pae组、TAK242组及Pae组+TAK242组Scr、BUN、CysC水平较RIRI组下降,差异均有统计学意义(均P < 0.05),见图 2。
|
| A, sham group; B, RIRI group; C, Pae group; D, TAK242 group; E, Pae+TAK242 group. 图 1 各组大鼠肾脏组织HE染色×400 Fig.1 HE staining of kidney tissue in each group×400 |
|
| A, BUN; B, Scr; C, CysC. * P < 0.05 vs sham group; #P < 0.05 vs RIRI group; Δ P < 0.05 vs Pae group. 图 2 各组大鼠BUN、Scr、CysC水平比较 Fig.2 Comparison of BUN, Scr, and CysC in each group |
2.2 丹皮酚对大鼠RIRI后肾组织及血清炎性细胞因子的影响
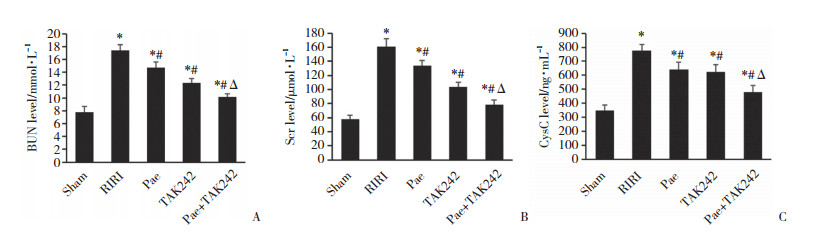
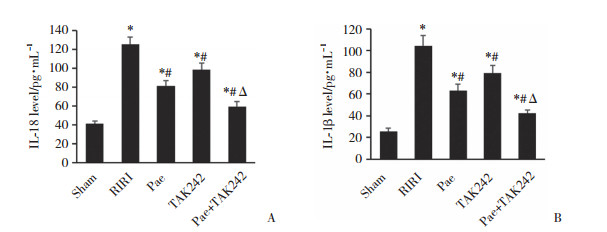
各组大鼠RIRI后24 h免疫组化结果显示,与Sham组比较,RIRI组、Pae组、TAK242组及Pae+TAK242组TLR4、MyD88、caspase 1、IL-18、IL-1β表达增多;与RIRI比较,Pae组、TAK242组及Pae+TAK242组TLR4、MyD88、caspase 1、IL-18、IL-1β表达均减少,见图 3。ELISA检测结果显示,与Sham组比较,Pae组、TAK242组及Pae+TAK242组IL-18、IL-1β水平均升高;与RIRI组比较,Pae组、TAK242组及Pae+TAK242组IL-18、IL-1β水平均降低,差异均有统计学意义(均P < 0.05,图 4)。
|
| 图 3 免疫组化检测各组大鼠TLR4、MyD88、caspase 1、IL-1β、IL-18表达×400 Fig.3 Expression of TLR4, MyD88, caspase 1, IL-1β, and IL-18 in each group by immunohistochemistry ×400 |
|
| A, serum IL-18 level; B, serum IL-1β level. * P < 0.05 vs sham group; #P < 0.05 vs RIRI group; Δ P < 0.05 vs Pae group. 图 4 各组大鼠血清IL-18、IL-1β水平比较 Fig.4 Serum IL-18 and IL-1β levels in the rats of each group |
2.3 丹皮酚对大鼠RIRI后TLR4、MyD88蛋白及焦亡相关蛋白表达的影响
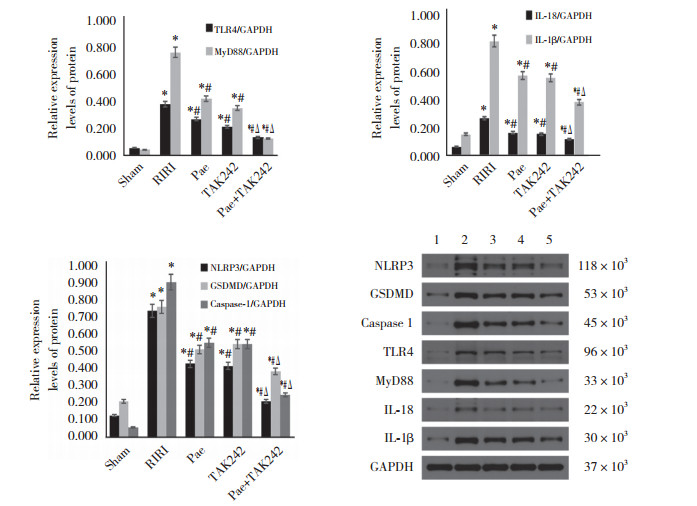
与Sham组比较,RIRI组中TLR4、MyD88、NLRP3、caspase 1、GSDMD、IL-1β、IL-18蛋白表达水平均升高;与RIRI组比较,Pae组、TAK242组及Pae+TAK242组TLR4、MyD88、NLRP3、caspase 1、GSDMD、IL-1β、IL-18蛋白表达水平下降,差异均有统计学意义(均P < 0.05,图 5)。
|
| 1, sham group; 2, RIRI group; 3, Pae group; 4, TAK242 group; 5, Pae+TAK242 group. * P < 0.05 vs sham group; #P < 0.05 vs RIRI group; Δ P < 0.05 vs Pae group. 图 5 各组大鼠TLR4、MyD88蛋白及焦亡相关蛋白表达 Fig.5 Expression of TLR4, MyD88, and pyrodeath related proteins in each group |
3 讨论
RIRI是一个复杂的病理生理现象,RIRI过程中过量的活性氧引起氧化应激,继而引发缺血组织中脂质过氧化和细胞死亡。此外,炎症在RIRI中起着重要作用,缺血组织中DNA和蛋白质损伤引起凋亡、焦亡等程序性细胞死亡,伴随白细胞浸润和促炎细胞因子产生过多,进而加重肾脏组织损伤[11]。
细胞焦亡是由GSDMD蛋白介导的一种程序性细胞死亡方式,其特点是过度的细胞死亡和炎症。GSDMD在质膜上形成孔道,最终导致细胞肿胀、膜溶解和炎性细胞因子释放。已证实GSDMD蛋白介导的细胞焦亡是RIRI的必要过程[12]。细胞焦亡过程需要NLRP3炎症小体和GSDMD蛋白共同参与,NLRP3炎症小体在细胞焦亡中同样至关重要。NLRP3炎症小体是一种细胞质多蛋白复合体,由先天免疫受体蛋白NLRP3、适配器蛋白ASC和炎症蛋白酶caspase 1组成,对微生物感染、内源性危险信号和环境刺激产生反应。组装的NLRP3炎症小体可以激活蛋白酶caspase 1,诱导GSDMD激活,促进IL-1β和IL-18释放,介导炎症反应,引起细胞焦亡[13]。本研究结果显示,与Sham组比较,RIRI组大鼠焦亡相关蛋白及炎性细胞因子明显升高,说明细胞焦亡在RIRI中发挥关键作用。与RIRI组比较,Pae组、TAK242组及Pae+TAK242组TLR4、MyD88、NLRP3、caspase 1、GSDMD、IL-1β、IL-18蛋白表达水平下降(均P < 0.05),表明应用丹皮酚预处理可减轻RIRI引起的细胞焦亡。
TLR4是细胞膜Ⅰ型跨膜蛋白,能识别病原体相关的分子模式,通过细胞信号路径最终导致炎性细胞因子和趋化因子释放。已有研究[14-15]证明TLR4信号通路激活可以增加NLRP3炎症小体、caspase 1和促炎细胞因子的表达,从而诱导细胞焦亡。RIRI中TLR4触发了肾脏的炎症反应,加剧了肾组织损伤。
本研究结果显示,与Sham组比较,RIRI组大鼠炎性细胞因子释放增加,肾损伤加重。丹皮酚预处理大鼠细胞焦亡相关蛋白表达减少,肾脏组织损伤减轻及炎性细胞因子释放减少,效果与TAK242预处理相似。其机制可能是RIRI使TLR4信号通路活化,刺激NLRP3生成增多,产生大量细胞焦亡,诱发炎症风暴;而丹皮酚通过抑制TLR4-MyD88-NLRP3通路减少了细胞焦亡,发挥肾脏保护作用。
综上所述,本研究证实了丹皮酚可减轻大鼠RIRI,其机制可能是通过抑制TLR4-MyD88-NLRP3通路,从而抑制细胞焦亡实现的。因此,丹皮酚有可能成为未来RIRI精准治疗的新靶点。本研究仅为动物模型实验研究,丹皮酚调控TLR4-MyD88-NLRP3通路的具体机制需完善细胞实验来进一步论证。
| [1] |
XIAN WJ, WU JL, LI QS, et al. CXCR3 alleviates renal ischemia-reperfusion injury via increase of Tregs[J]. Mol Med Rep, 2021, 24: 541. DOI:10.3892/mmr.2021.12180 |
| [2] |
PANG Y, ZHANG PC, LU RR, et al. Andrade-Oliveira salvianolic acid B modulates caspase-1-mediated pyroptosis in renal ischemia-reperfusion injury via Nrf2 pathway[J]. Front Pharmacol, 2020, 11: 541426. DOI:10.3389/fphar.2020.541426 |
| [3] |
CAI Q, SUN Z, BAO M, et al. Pos-063 disulfiram ameliorates ischemia/reperfusion-induced acute kidney injury by suppressing the caspase-11-gsdmd pathway[J]. Kidney Int Rep, 2022, 7(2): S26-S27. DOI:10.1016/j.ekir.2022.01.072 |
| [4] |
WANG Y, WANG D, JIN Z. miR-27a suppresses TLR4-induced renal ischemia-reperfusion injury[J]. Mol Med Report, 2019, 20(2): 967-976. DOI:10.3892/mmr.2019.10333 |
| [5] |
LU L, QIN YT, CHEN C, et al. Beneficial effects exerted by paeonol in the management of atherosclerosis[J]. Oxidative Med Cell Longev, 2018, 2018: 1-11. DOI:10.1155/2018/1098617 |
| [6] |
MIAO JF, ZHONG J, LAN J, et al. Paeonol attenuates inflammation by confining HMGB1 to the nucleus[J]. J Cell Mol Med, 2021, 25(6): 2885-2899. DOI:10.1111/jcmm.16319 |
| [7] |
LI Q, ZHANG Y, SUN J, et al. Paeonol-mediated apoptosis of hepatocellular carcinoma cells by NF-κB pathway[J]. Oncol Lett, 2019, 17(2): 1761-1767. DOI:10.3892/ol.2018.9730 |
| [8] |
ZHANG L, LI DC, LIU LF. Paeonol: pharmacological effects and mechanisms of action[J]. Int Immunopharmacol, 2019, 72: 413-421. DOI:10.1016/j.intimp.2019.04.033 |
| [9] |
TSAI CF, SU HH, CHEN KM, et al. Paeonol protects against myocardial ischemia/reperfusion-induced injury by mediating apoptosis and autophagy crosstalk[J]. Front Pharmacol, 2021, 11: 586498. DOI:10.3389/fphar.2020.586498 |
| [10] |
ONO Y, MAEJIMA Y, SAITO M, et al. TAK-242, a specific inhibitor of Toll-like receptor 4 signalling, prevents endotoxemia-induced skeletal muscle wasting in mice[J]. Sci Rep, 2020, 10(1): 694. DOI:10.1038/s41598-020-57714-3 |
| [11] |
LIU DM, TANG SL, GAN L, et al. Renal-protective effects and potential mechanisms of traditional Chinese medicine after ischemia-reperfusion injury[J]. Evid Based Complementary Altern Med, 2021, 2021: 1-6. DOI:10.1155/2021/5579327 |
| [12] |
XIAO CC, ZHAO HJ, ZHU H, et al. Tisp40 induces tubular epithelial cell GSDMD-mediated pyroptosis in renal ischemia-reperfusion injury via NF-κB signaling[J]. Front Physiol, 2020, 11: 906. DOI:10.3389/fphys.2020.00906 |
| [13] |
HUANG Y, XU W, ZHOU RB. NLRP3 inflammasome activation and cell death[J]. Cell Mol Immunol, 2021, 18(9): 2114-2127. DOI:10.1038/s41423-021-00740-6 |
| [14] |
ZHAO HL, PEREZ JS, LU KZ, et al. Role of Toll-like receptor-4 in renal graft ischemia-reperfusion injury[J]. Am J Physiol Renal Physiol, 2014, 306(8): F801-F811. DOI:10.1152/ajprenal.00469.2013 |
| [15] |
LI X, ZOU Y, FU YY, et al. Ibudilast attenuates folic acid-induced acute kidney injury by blocking pyroptosis through TLR4-mediated NF-κB and MAPK signaling pathways[J]. Front Pharmacol, 2021, 12: 650283. DOI:10.3389/fphar.2021.650283 |
 2023, Vol. 52
2023, Vol. 52