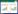文章信息
- 徐延, 于晴, 房睿, 阎旭, 丛芳, 王文茉, 张桂荣
- XU Yan, YU Qing, FANG Rui, YAN Xu, CONG Fang, WANG Wenmo, ZHANG Guirong
- 微弧氧化涂层促进3D打印个性化钛种植体骨愈合的体内实验研究
- Experimental study on microarc oxidation coating promoting in vivo bone healing of 3D-printed personalized titanium implants
- 中国医科大学学报, 2023, 52(10): 950-954
- Journal of China Medical University, 2023, 52(10): 950-954
-
文章历史
- 收稿日期:2022-12-16
- 网络出版时间:2023-10-16 18:50:55
2. 中国医科大学口腔医学院·附属口腔医院干诊科, 沈阳 110002;
3. 沈阳市口腔医院科教科, 沈阳 110002
种植体与其周围骨组织结合是口腔种植成功的关键。目前,临床上多采用形态规则的锥形或柱状种植体,这些种植体与拔牙窝外形不吻合,初期稳定性较差。3D打印个性化钛种植体为仿牙根形态设计,可更好模拟自然牙的传力特性和牙根的应力分布特性,提高了骨与种植体的结合率[1]。电子束熔融(electron beam melting,EBM)是一种3D打印技术,采用电子束作为能量源,是使材料完全熔化后再冷却凝固成型的三维实体制造方法。EBM后期无需热处理,工艺流程简化,可精准控制材料的孔隙结构,多孔部分和致密实体部分可一次成型,具有良好的结构连续性[2]。
钛种植体表面致密的氧化钛层具有生物惰性,无促进成骨能力。钛种植体在模拟体液或者机体内几乎不能诱导羟基磷灰石的沉积,只是与骨组织形成一般的骨整合,因此骨结合率较低[3]。钛种植体表面进行改性等活化处理,可增强种植体与骨的结合,预防种植体周围骨吸收[4]。近年来随着材料学表面处理工艺的发展,应用微弧氧化表面处理成为钛种植体表面改性研究的热点。微弧氧化由阳性氧化技术升级而来,可将钛合金表面改性形成微纳米生物活性钛涂层,促进成骨细胞在种植体表面黏附,增强附着力[5]。另外,微弧氧化技术操作方便、成本低,能有效调整所制备表面涂层的微观结构和元素,提高种植体的成骨性和抗菌性[6]。本研究通过EBM技术制备个性化钛种植体,并在其表面制备微弧氧化涂层,探讨微弧氧化涂层对3D打印个性化钛种植体骨愈合的作用,旨在为复合涂层3D打印钛种植体的临床应用提供依据,并为提高临床种植成功率及使用寿命提供新思路。
1 材料与方法 1.1 3D打印个性化根形钛种植体的设计与制作通过CT(日本HITACHI公司)检查获取实验犬目标牙牙根原始形态数据,将DICM格式原始图像导入Mimicis10.0软件中,选取双侧第四前臼齿作为目标牙,获取目标牙图像数据,建立三维模型并进行修整处理,将种植体设计为表面孔径300 μm、孔隙率70%的多孔结构,通过EBM 3D打印机(瑞典Arcam公司)制作出与目标牙牙根形态高度吻合的个性化钛种植体,共16个。见图 1。

|
| 图 1 个性化钛种植体三维模型及制备完成的种植体样本 |
1.2 微弧氧化涂层制备
喷砂抛光30 s(去除种植体3D打印过程中表面未完全熔融的残留颗粒),丙酮清洗3D打印钛种植体试样15 min(去除表面钛金属粉末)。盐酸∶硫酸∶去离子水按照2∶1∶1比例配置酸洗液,将种植体置入酸洗液酸蚀5 min,酸蚀后的种植体依次用无水乙醇、蒸馏水超声清洗各10 min,常温氮气干燥。将16个3D打印个性化种植体均分为2组:微弧氧化涂层组和对照组。微弧氧化涂层组种植体置入含有乙酸钙、磷酸二氢钠、碳化硅纳米颗粒的电解质溶液中处理10 min,进行表面微弧氧化;对照组种植体不做处理。通过扫描电镜(EVO10,德国ZEISS公司)观察种植体表面形态,使用X射线能谱仪(XPS,美国ThermoVG公司)检测种植体的元素组成。
1.3 实验动物、分组及手术方法健康雄性成年比格犬4只,年龄12~18个月,体质量12~15 kg,沈阳康平实验动物研究所提供。微创拔除4只实验犬下颌双侧第四前臼齿,保证骨壁完整无破坏。每只实验犬共有2个近中和2个远中拔牙窝,共16个拔牙窝。将16个拔牙窝随机分为2组,一组拔牙窝内植入微弧氧化涂层组钛种植体,另一组拔牙窝植入对照组钛种植体。手术方法:将个性化种植体冠方牙体部分截去,依据相应的方向植入拔牙窝内,轻敲击或按压就位,使种植体顶端与牙槽嵴顶平齐在无张力下缝合创口,10 d后拆除缝线。见图 2。术后抗感染治疗,常规半流食饲养,定期观察实验犬生命体征及植入区组织愈合情况。所有犬的选择、管理、手术方案以及术前准备处理工作都符合国际动物保健和使用委员会的要求。
|
| 图 2 拔除犬下颌第四前臼齿,并将种植体植入拔牙窝内 |
1.4 影像学观察
术后2个月进行CT检查,观察种植体周围骨吸收及骨愈合情况。
1.5 组织形态学分析术后2个月安乐死实验犬,在种植体外周0.5 cm处截断获取带种植体的下颌骨标本,于4%多聚甲醛中固定24 h。采用梯度乙醇进行标本脱水,将脱水后的组织用环氧树脂包埋,然后使用硬组织切片机(300-CP,德国EXAKT公司)沿颊舌向种植体长轴切片(厚度50 μm)。切片进行甲苯胺蓝试剂染色,然后利用光学显微镜(日本Olympus公司)观察组织形态。利用Image-Pro Plus 6.0软件计算骨长入面积率和骨结合率。其中,骨长入面积率(%)=骨与种植体接触的实际面积/种植体能提供骨长入的总面积×100;骨结合率(%)=骨与种植体实际接触面的总长度/种植体能提供骨接触面的总长度×100。
1.6 统计学分析利用SPSS 25.0软件进行统计学分析,计量资料采用x±s表示,2组比较采用t检验,P < 0.05为差异有统计学意义。
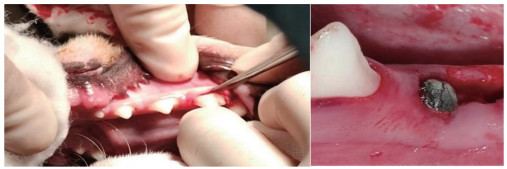
2 结果 2.1 2组扫描电镜结果结果显示,微弧氧化涂层组钛种植体表面较粗糙,形成TiO2膜层,表面有较多孔洞,多呈圆形、椭圆形分布;对照组钛种植体表面呈现波浪状多孔结构,见图 3。X射线能谱仪检测结果显示,微弧氧化涂层组表面除了钛合金所含元素外,还具有Ca、P、Si、O、Na等元素;对照组表面仅含有钛合金元素,见图 4。

|
| A,微弧氧化涂层组;B,对照组. 图 3 2组扫描电镜结果比较 |
|
| A,微弧氧化涂层组;B,对照组. 图 4 X射线能谱元素分析结果 |
2.2 2组术后观察及CT检查结果
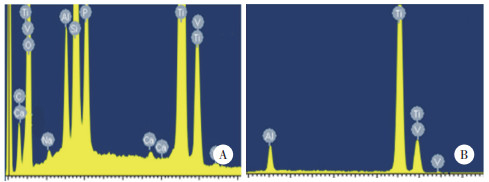
结果显示,术后2个月2组犬体征良好,种植体牙龈软组织创口愈合良好,周围牙龈未见红肿,未见种植体脱落现象。2组种植体周围均无低密度影像,未见骨吸收,骨愈合良好,未见骨折、骨裂。见图 5。
|
| A,微弧氧化涂层组;B,对照组. 图 5 术后2个月2组种植体CT影像 |
2.3 2组组织形态学结果
术后2个月制取硬组织切片并利用光学显微镜观察,镜下种植体显示为黑色,骨组织显示为蓝色。结果显示,镜下见骨结合界面清晰,2组种植体周围均有不同程度骨结合,表面均有不同程度新生骨长入。微弧氧化涂层组种植体表面被较多新生骨包绕,结合紧密,且结合面积较广泛;种植体外层孔隙内可见有新生骨组织充填,且与周围孔壁紧密结合。对照组种植体表面新生骨附着较少,部分新生骨组织呈游离状态;新生骨与种植体之间可见空泡区域,骨结合面积较小且结合不紧密。见图 6。
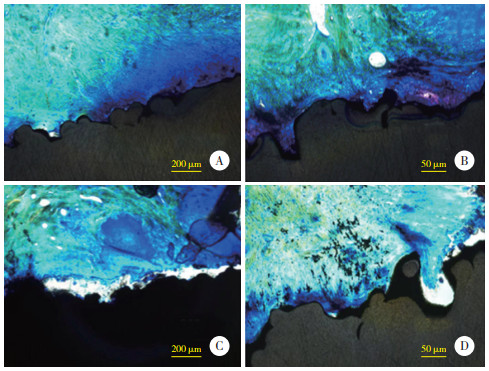
|
| A,B,微弧氧化涂层组;C,D,对照组. 图 6 2组组织形态学比较 |
微弧氧化涂层组与对照组骨长入面积率分别为34.9%±2.4%、24.6%±3.6%,骨结合率分别为40.8%±3.4%、29.6%±3.6%,微弧氧化涂层组骨长入面积率、骨结合率均显著高于对照组(均P < 0.05)。
3 讨论种植义齿修复已在临床牙列缺损治疗中广泛应用。与传统的早期种植和延期种植相比,即刻种植具有缩短手术时间、减少治疗周期、降低治疗成本等优点。临床上即刻种植更多应用于前牙的种植修复。已有研究[7]显示磨牙区即刻种植骨结合良好。但在即刻种植时,现有螺纹状和柱状结构的单牙根式种植体与天然牙牙根形状不同,与拔牙后的牙槽窝形状不一致,种植体与骨组织间常存在间隙,既影响种植体初期稳定性,又影响种植体和骨组织间的骨性愈合,进而影响种植手术的成功率[8]。本实验中个性化钛种植体为仿天然牙根形态设计,可以与其牙槽窝形态匹配,植入时不需要制备种植窝,种植体与牙槽窝之间可以更好模拟天然牙根的应力分布特性。传统纯钛种植体由于材料弹性模量过高导致应力遮挡效应而容易造成周围牙槽骨吸收、种植体脱落[9]。研究[10-11]表明,3D打印技术可制造表面具有多孔结构的钛合金个性化种植体,调节孔隙率和孔径使种植体具有与骨组织相匹配的弹性模量,适宜的弹性模量可有效减小钛的应力屏障作用,多孔结构也可使个性化钛种植体与牙槽骨之间结合面积增大,增强种植体初期稳定性。本实验个性化钛种植体表面多孔结构的孔径为300 μm,孔隙率为70%,形成具有凹面和孔隙的类骨小梁结构,有利于骨细胞生长,促进骨结合,其中表层的多孔结构能够避免应力集中造成的牙槽骨壁吸收,同时牙根内部的实心结构也可以保证种植体的强度。本实验中多孔结构厚度略薄,未来可增加多孔层厚度,更有利于骨组织长入。目前,制作个性化根形钛合金种植体多选用选择性金属熔融(selective laser melting,SLM)和EBM技术[12]。与以激光为能源的SLM技术比较,EBM技术制备的样本是在真空环境下完成,因而避免了样本制作过程中受到污染;且EBM技术以电子束作为热源,能量利用率较SLM高,加工速度快[13]。
本实验在含有Ca、P和Si等元素的电解质中通过微弧氧化技术在种植体表面制备多孔TiO2涂层。有研究[14]显示多孔TiO2涂层具有较高的表面能和较大的表面粗糙度,能更好促进成骨细胞黏附和扩散。本研究结果显示,术后2个月微弧氧化涂层组种植体表面骨结合比对照组更加广泛、紧密,空泡区域较少,接触成骨更明显;微弧氧化涂层组骨长入面积率及骨结合率均高于对照组(均P < 0.05),说明微弧氧化TiO2涂层能明显促进骨愈合,具有良好的骨诱导能力,使骨组织快速沉积到种植体表面,从而促进骨质矿化和改建,与以往研究[14-15]结果一致。
综上所述,EBM 3D打印技术可制作出与目标牙形态完全一致的钛种植体,微弧氧化涂层可促进3D打印个性化钛种植体骨愈合。微弧氧化涂层个性化钛种植体可作为一种性能优良的种植体在口腔种植修复中应用。本研究样本量较小,微弧氧化涂层促进3D打印个性化钛种植体骨愈合的具体机制尚未明确,今后需进一步论证。
| [1] |
DANTAS TA, NETO JPC, ALVES JL, et al. In silico evaluation of the stress fields on the cortical bone surrounding dental implants: comparing root-analogue and screwed implants[J]. J Mech Behav Biomed Mater, 2020, 104: 103667. DOI:10.1016/j.jmbbm.2020.103667 |
| [2] |
赵飞亚, 余晓雯, 叶冠琛, 等. 个性化根形种植体的相关研究及临床应用进展[J]. 中国实用口腔科杂志, 2022, 15(4): 485-490. DOI:10.19538/j.kq.2022.04.022 |
| [3] |
ZHAO QM, YI L, JIANG L, et al. Surface functionalization of titanium with zinc/strontium-doped titanium dioxide microporous coating via microarc oxidation[J]. Nanomed Nanotechnol Biol Med, 2019, 16: 149-161. DOI:10.1016/j.nano.2018.12.006 |
| [4] |
杨帮成, 周学东, 于海洋, 等. 钛种植体表面改性方法[J]. 华西口腔医学杂志, 2019, 37(2) 124-129. DOI: CNKI:SUN:HXKQ.0.2019-02-003.
|
| [5] |
DU Q, WEI DQ, WANG YM, et al. The effect of applied voltages on the structure, apatite-inducing ability and antibacterial ability of micro arc oxidation coating formed on titanium surface[J]. Bioact Mater, 2018, 3(4): 426-433. DOI:10.1016/j.bioactmat.2018.06.001 |
| [6] |
王欢, 刘洋, 戚孟春, 等. 微弧氧化技术制备钛基种植体表面涂层的研究进展[J]. 国际口腔医学杂志, 2020, 47(4): 439-444. DOI:10.7518/gjkq.2020037 |
| [7] |
TONETTI MS, JUNG RE, AVILA-ORTIZ G, et al. Management of the extraction socket and timing of implant placement: consensus report and clinical recommendations of group 3 of the XV European Workshop in Periodontology[J]. J Clin Periodontol, 2019, 46(Suppl 21): 183-194. DOI:10.1111/jcpe.13131 |
| [8] |
IKAR M, GROBECKER-KARL T, KARL M, et al. Mechanical stress during implant surgery and its effects on marginal bone: a literature review[J]. Quintessence Int, 2020, 51(2): 142-150. DOI:10.3290/j.qi.a43664 |
| [9] |
JIMBO R, HALLDIN A, JANDA M, et al. Vertical fracture and marginal bone loss of internal-connection implants: a finite element analysis[J]. Int J Oral Maxillofac Implants, 2013, 28(4): e171-e176. DOI:10.11607/jomi.3052 |
| [10] |
黄硕, 郭芳, 刘宁, 等. 3D打印个性化根形钛合金种植体在下颌磨牙区即刻种植的临床研究[J]. 口腔医学研究, 2021, 37(7): 602-606. DOI:10.13701/j.cnki.kqyxyj.2021.07.006 |
| [11] |
WANG H, LIU JQ, WANG CT, et al. The synergistic effect of 3D-printed microscale roughness surface and nanoscale feature on enhancing osteogenic differentiation and rapid osseointegration[J]. J Mater Sci Technol, 2021, 63: 18-26. DOI:10.1016/j.jmst.2019.12.030 |
| [12] |
SOKOLOWSKI A, KAMMERHOFER J, SOKOLOWSKI A, et al. Accuracy assessment of 3D-printed tooth replicas[J]. Clin Oral Implants Res, 2018, 29: 250. DOI:10.1111/clr.135_13358 |
| [13] |
ANSSARI MOIN D, HASSAN B, WISMEIJER D. A novel approach for custom three-dimensional printing of a zirconia root analogue implant by digital light processing[J]. Clin Oral Implants Res, 2017, 28(6): 668-670. DOI:10.1111/clr.12859 |
| [14] |
LI YD, WANG WQ, LIU HY, et al. Formation and in vitro/in vivo performance of "cortex-like" micro/nano-structured TiO2 coatings on titanium by micro-arc oxidation[J]. Mater Sci Eng C, 2018, 87: 90-103. DOI:10.1016/j.msec.2018.02.023 |
| [15] |
ZHOU WC, HUANG O, GAN YZ, et al. Effect of titanium implants with coatings of different pore sizes on adhesion and osteogenic differentiation of BMSCs[J]. Artif Cells Nanomed Biotechnol, 2019, 47(1): 290-299. DOI:10.1080/21691401.2018.1553784 |
 2023, Vol. 52
2023, Vol. 52