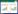文章信息
- 于鹏杰, 才保加, 朱生茂, 蒲永强
- YU Pengjie, CAI Baojia, ZHU Shengmao, PU Yongqiang
- LINC00662通过调控miR-199a-5p/MAP3K1通路对胃癌侵袭、转移的影响
- Influence of LINC00662 on the invasion and metastasis of gastric cancer via miR-199a-5p/MAP3K1 pathway regulation
- 中国医科大学学报, 2023, 52(10): 890-897
- Journal of China Medical University, 2023, 52(10): 890-897
-
文章历史
- 收稿日期:2022-09-01
- 网络出版时间:2023-10-17 08:32:48
胃癌在全球最常见的癌症中排名第5位,每年可致数十万人死亡[1]。随着消化道内镜技术的发展,胃癌患者的生存率得到显著提高[2]。然而,化疗和(或)放疗对转移性胃癌的治疗效果并不理想,胃癌转移是导致患者高死亡率的主要原因[3]。因此,探究胃癌转移的潜在机制具有重要的临床意义。越来越多的证据表明长链非编码RNA(long non-coding RNA,lncRNA)在肿瘤发生发展中起着至关重要的调控作用。LINC00662是一种lncRNA,已有研究[4]表明LINC00662在结肠癌细胞中高表达,并促进细胞的增殖与转移。miR-199a-5p在宫颈癌细胞中低表达,过表达miR-199a-5p可抑制宫颈癌细胞增殖、迁移与侵袭[5]。丝裂原活化蛋白激酶激酶激酶1(mitogen-activated protein kinase kinase kinase 1,MAP3K1)作为MAP3K家族成员之一,其表达下调可抑制食管癌细胞增殖和侵袭[6]。生物信息学分析显示,LINC00662与miR-199a-5p存在结合位点,miR-199a-5p与MAP3K1存在结合位点,但LINC00662能否通过调控miR-199a-5p/MAP3K1来影响胃癌侵袭与转移尚不明确。因此,本研究探讨LINC00662对胃癌细胞侵袭、转移的影响,以及其对miR-199a-5p、MAP3K1的调控机制,旨在为明确胃癌转移的分子机制提供新的理论依据。
1 材料与方法 1.1 临床样本收集及细胞来源收集2018年6月至2020年6月期间我院确诊的105例胃癌患者癌组织以及对应的癌旁组织(距离癌组织3 cm),将所有收集的样本于液氮中冷冻后-80 ℃保存。本研究获得医院伦理委员会批准,所有患者均签署知情同意书。人胃癌SGC-7901细胞购自中国科学院上海细胞库。
1.2 主要试剂与仪器miR-199a-5p模拟物(miR-199a-5p)及其阴性对照(miR-NC)、miR-199a-5p抑制物(anti-miR-199a-5p)及其阴性对照(anti-miR-NC)、LINC00662 siRNA(si-LINC00662)及其阴性对照(si-NC)均购自广州基迪奥生物科技公司;LipofectamineTM2000转染试剂盒购自上海慧颖生物科技有限公司;pcDNA3.1载体购自美国ThermoFisher公司;胎牛血清(FBS)、RPMI 1640培养基均购自美国Gibco公司;反转录及荧光定量试剂盒购自北京百奥莱博科技有限公司;Trizol试剂、BCA试剂盒、ECL化学发光试剂盒购自美国Invitrogen公司;MAP3K1、基质金属蛋白酶(matrix metalloproteinases,MMP)-2、MMP-9、神经型钙黏蛋白(neural cadherin,N-cadherin)、GAPDH兔多克隆抗体(anti-MAP3K1、anti-MMP-2、anti-MMP-9、anti-N-cadherin、anti-GAPDH)、辣根过氧化物酶(HRP)标记的羊抗兔二抗均购自武汉艾美捷科技有限公司;荧光定量PCR仪购自美国应用生物系统公司。
1.3 细胞培养及分组将胃癌细胞SGC-7901置于含有10% FBS的RPMI 1640培养基中,在37 ℃,5% CO2培养箱中培养。每隔1 d换1次培养液,进行常规传代培养。取对数生长期的SGC-7901细胞,利用LipofectamineTM2000转染试剂盒分别将si-NC、si-LINC00662、si-LINC00662与anti-miR-NC、si-LINC00662与anti-miR-199a-5p、si-LINC00662与miR-NC、si-LINC00662与miR-199a-5p、miR-NC、miR-199a-5p、pcDNA3.1、pcDNA3.1-LINC00662、anti-miR-NC、anti-miR-199a-5p转染于SGC-7901细胞,并分别设定为si-NC组、si-LINC00662组、si-LINC00662+anti-miR-NC组、si-LINC00662+anti-miR-199a-5p组、si-LINC00662+miR-NC组、si-LINC00662+miR-199a-5p组、miR-NC组、miR-199a-5p组、空载体组、LINC00662过表达组、anti-miR-NC组、anti-miR-199a-5p组,另取未转染的SGC-7901细胞设定为空白组,细胞转染48 h后用于后续实验。
1.4 实时定量PCR检测SGC-7901细胞中LINC00662、miR-199a-5p、MAP3K1 mRNA的表达使用Trizol试剂从胃癌组织和癌旁组织中提取总RNA。RNA的浓度和纯度用紫外分光光度计测定。使用反转录试剂盒将RNA逆转录成cDNA,并根据荧光定量试剂盒的操作说明书进行PCR扩增反应,U6和GAPDH分别作为miR-199a-5p、LINC00662与MAP3K1内参,以2-ΔΔCt法计算基因的相对表达量。所用引物包括:miR-199a-5p,正向5’-CCGGGATCCGCAAACTCAGCTTTAC-3’,反向5’-CGGAATTCGTGGCGACCGTGATACC-3’;U6,正向5’-GTACAAAATACGTGACGTAGAAAG-3,反向5’-GGTCDTTCGTCCTTTCCAC-3’;LINC00662,正向5’-AGGACAGAATCTCCGTGGAC-3’,反向5’-TTGATCTTTTAGATTTCTGTCACACTC-3’;MAP3K1,正向5’-AACAACCGTATAGAGAAGACA-3’,反向5’-TGAGCCTGATAACAAGAAGA-3’;GADPH,正向5’-GGAGCGAGATCCCTCCAAAAT-3’,反向5’-GGCTGTTGTCATACTTCTCATGG-3’。
1.5 Transwell实验检测细胞侵袭与迁移 1.5.1 细胞侵袭将基质胶涂于Transwell小室中,待自然干燥后收集对数生长期的SGC-7901细胞用胰蛋白酶消化,用PBS洗涤并重悬于无血清RPMI 1640培养基中,并将细胞密度调整为1×105/mL。取200 μL细胞悬浮液接种在上室中,将500 μL含有10%FBS的RPMI 1640培养基加入到下室中,然后将细胞在含有5% CO2的培养箱中37 ℃培养48 h。侵入下室的细胞用95%乙醇固定10 min,0.1%结晶紫染色10 min,PBS去除未染色的细胞。倒置显微镜下观察,随机选取5个视野的细胞进行计数。
1.5.2 细胞迁移Transwell小室中不涂基质胶。收集对数生长期的SGC-7901细胞用胰蛋白酶消化,用PBS洗涤并重悬于无血清RPMI 1640培养基中,并将细胞密度调整为1×105/mL。其他步骤同1.5.1。
1.6 划痕实验检测细胞迁移将各组细胞接种到6孔板中并在培养箱中孵育,当其汇合度约达到100%时用无菌的200 μL枪头尖端垂直水平划线,然后利用PBS洗涤除去漂浮的细胞并在无血清培养基中孵育。使用倒置显微镜观察细胞在0、24 h时迁移情况并拍照。划痕愈合率(%)=(1~24 h的划痕面积/0 h的划痕面积)×100。
1.7 Western blotting检测细胞中MAP3K1、MMP-2、MMP-9、N-cadherin表达将各组细胞用PBS洗涤2次后,置于预冷的RIPA裂解缓冲液中裂解并提取总蛋白。在10%十二烷基硫酸钠-聚丙烯酰胺(SDS/PAGE)凝胶上分离蛋白质,电印迹到聚偏二氟乙烯膜上,将膜用5%脱脂牛奶封闭1 h后加入一抗anti-MAP3K1、anti-MMP-2、anti-MMP-9、anti-N-cadherin、anti-GAPDH于4 ℃下孵育过夜,第2天用TBST洗涤3次后,加入HRP标记的羊抗兔二抗于室温下孵育2 h,使用ECL发光试剂盒检测蛋白质的显色情况,利用Image-J软件分析蛋白质的灰度值。
1.8 双荧光素酶报告基因实验使用Starbase网站(http://starbase.sysu.edu.cn/)预测LINC00662与miR-199a-5p、miR-199a-5p与MAP3K1的结合位点。分别构建LINC00662、MAP3K1 3’-UTR区的野生型(WT)和突变型(MUT)质粒,记为WT-LINC00662、MUT-LINC00662、WT-MAP3K1、MUT-MAP3K1,利用LipofectamineTM2000转染试剂盒分别将WT-LINC00662、MUT-LINC00662、WT-MAP3K1、MUT-MAP3K1与miR-NC、miR-199a-5p共转染于SGC-7901细胞,转染后24 h收获细胞,使用双荧光素酶报告基因检测系统检测双荧光素酶活性。
1.9 统计学分析使用SPSS 21.0软件进行统计分析,计量资料采用x±s表示。2组间比较采用t检验,多组间比较采用单因素方差分析,进一步两组间比较采用snk-q检验,P < 0.05为差异有统计学意义。
2 结果 2.1 LINC00662、miR-199a-5p、MAP3K1在胃癌组织中的表达与癌旁组织比较,胃癌组织中LINC00662、MAP3K1 mRNA表达水平显著升高,miR-199a-5p表达水平显著降低(均P < 0.001),见表 1。
| Group | LINC00662 | miR-199a-5p | MAP3K1 mRNA |
| Paracancerous tissue | 1.02±0.11 | 1.01±0.12 | 1.04±0.13 |
| Gastric cancer tissue | 2.23±0.35 | 0.27±0.03 | 1.89±0.26 |
| t | 33.795 | 61.303 | 29.963 |
| P | < 0.001 | < 0.001 | < 0.001 |
2.2 LINC00662抑制对胃癌SGC-7901细胞侵袭、迁移的影响
结果显示,与空白组(1.03±0.12)和si-NC组(1.05± 0.14)比较,si-LINC00662组(0.35±0.06)SGC-7901细胞中LINC00662表达水平显著降低(均P < 0.05)。与空白组和si-NC组比较,si-LINC00662组SGC-7901细胞侵袭、迁移细胞数目显著减少,划痕愈合率显著降低,MMP-2、MMP-9、N-cadherin、MAP3K1蛋白表达显著降低(P < 0.05),见图 1。
|
| A, the effect of si-LINC00662 on the invasion and migration of SGC-7901 cells (crystal violet stain × 200);B, the effect of si-LINC00662 on the scratch healing of SGC-7901 cells; C, the protein expression of MMP-2, MMP-9, N-cadherin, and MAP3K1. *P < 0.05 compared with the blank group; #P < 0.05 compared with the si-NC group. 图 1 LINC00662抑制对胃癌SGC-7901细胞侵袭、迁移的影响 Fig.1 Effect of LINC00662 inhibition on the invasion and migration of gastric cancer SGC-7901 cells |
2.3 各转染组SGC-7901细胞中miR-199a-5p表达比较
结果显示,空白组、si-NC组、si-LINC00662组、si-LINC00662+anti-miR-NC组、si-LINC00662+anti-miR-199a-5p组、si-LINC00662+miR-NC组、si-LINC00662+ miR-199a-5p组miR-199a-5p表达分别为1.02±0.14、1.03±0.15、2.21±0.24、1.03±0.13、0.39±0.05、1.06± 0.12、2.89±0.32。与空白组和si-NC组比较,si-LINC00662组SGC-7901细胞中miR-199a-5p表达显著升高(P < 0.05);与si-LINC00662组和si-LINC00662+anti-miR-NC组比较,si-LINC00662+anti-miR-199a-5p组SGC-7901细胞中miR-199a-5p表达显著降低(P < 0.05);与si-LINC 00662组和si-LINC00662+miR-NC组比较,si-LINC00662+ miR-199a-5p组SGC-7901细胞中miR-199a-5p表达显著升高(均P < 0.05)。
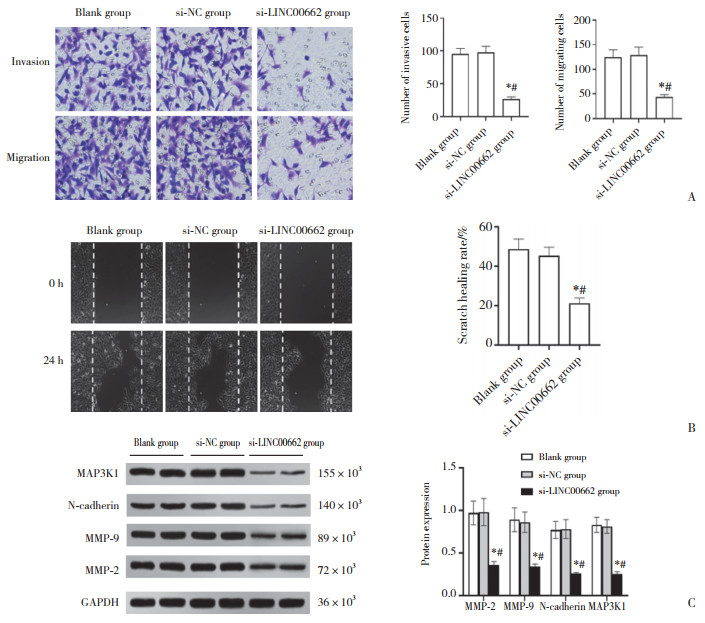
2.4 抑制miR-199a-5p可减弱LINC00662抑制对胃癌SGC-7901细胞侵袭、迁移的影响(图 2)
|
| A, cell invasion and migration in each group (crystal violet staining × 200);B, the wound healing of each group of cells; C, the protein expression of MMP-2, MMP-9, N-cadherin, and MAP3K1 in each group. *P < 0.05 compared with si-LINC00662 group; #P < 0.05 compared with si-LINC00662+anti-miR-NC group. 图 2 抑制miR-199a-5p可减弱LINC00662抑制对胃癌SGC-7901细胞侵袭、迁移的影响 Fig.2 Inhibition of miR-199a-5p could attenuate the effect of LINC00662 inhibition on the invasion and migration of gastric cancer SGC-7901 cells |
与si-LINC00662组和si-LINC00662+anti-miR-NC组比较,si-LINC00662+anti-miR -199a-5p组SGC-7901细胞中MAP3K1蛋白表达显著升高,侵袭、迁移细胞数目显著升高,划痕愈合率显著升高,MMP-2、MMP-9、N-cadherin蛋白表达显著升高(P < 0.05),见图 2。
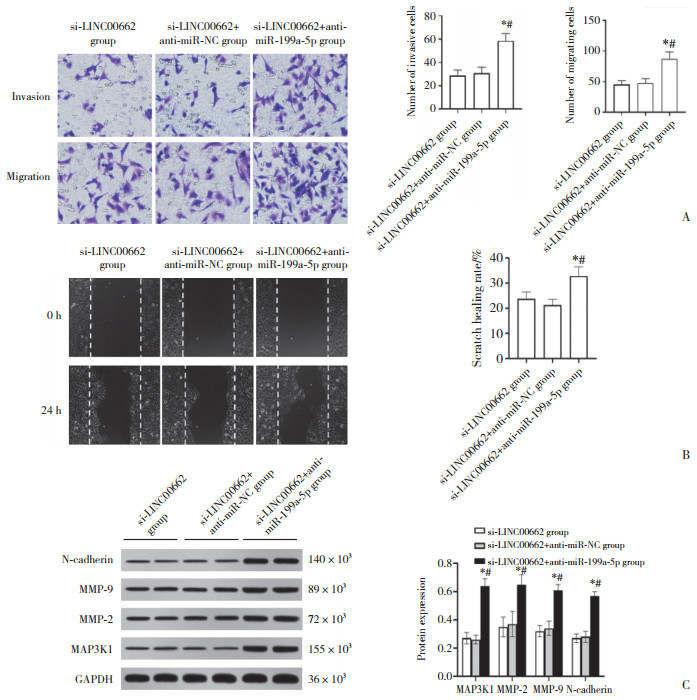
2.5 上调miR-199a-5p表达可增强LINC00662抑制对胃癌SGC-7901细胞侵袭、迁移的影响与si-LINC00662组和si-LINC00662+miR-NC组比较,si-LINC00662+miR-199a-5p组SGC-7901细胞中MAP3K1蛋白表达显著降低,侵袭、迁移细胞数目显著降低,划痕愈合率显著降低,MMP-2、MMP-9、N-cadherin蛋白表达显著降低(P < 0.05),见图 3。
|
| A, cell invasion and migration in each group (crystal violet staining × 200);B, the wound healing of each group of cells; C, the protein expression of MMP-2, MMP-9, N-cadherin, and MAP3K1 in each group of cells. *P < 0.05 compared with si-LINC00662 group; #P < 0.05 compared with si-LINC00662+miR-NC group. 图 3 上调miR-199a-5p表达可增强LINC00662抑制对胃癌SGC-7901细胞侵袭、迁移的影响 Fig.3 Upregulation of miR-199a-5p expression could enhance the effect of LINC00662 inhibitory on the invasion and migration of gastric cancer SGC-7901 cells |
2.6 LINC00662与miR-199a-5p、miR-199a-5p与MAP3K1靶向关系的验证
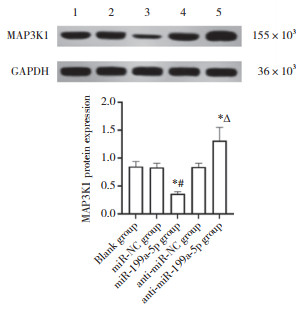
结果显示,LINC00662与miR-199a-5p存在结合位点,miR-199a-5p与MAP3K1存在结合位点,见图 4。与miR-NC组比较,miR-199a-5p组WT-LINC00662胃癌SGC-7901细胞的荧光素酶相对活性降低(P < 0.05),而miR-199a-5p组MUT-LINC00662胃癌SGC-7901细胞的荧光素酶相对活性无统计学差异(P > 0.05),见表 2。与miR-NC组比较,miR-199a-5p组WT-MAP3K1胃癌SGC-7901细胞的荧光素酶相对活性降低(P < 0.05),而miR-199a-5p组MUT-MAP3K1胃癌SGC-7901细胞的荧光素酶相对活性无统计学差异(P > 0.05),见表 2。与空白组(1.01±0.11)和空载体组(1.04±0.12)比较,LINC00662过表达组(0.41±0.05)中miR-199a-5p表达水平显著降低(均P < 0.05)。与空白组和miR-NC组比较,miR-199a-5p组中MAP3K1蛋白表达水平显著降低(P < 0.05);与空白组和anti-miR-NC组比较,anti-miR-199a-5p组中MAP3K1蛋白表达显著升高(P < 0.05),见图 5。

|
| A,LINC00662 to miR-199a-5p;B,miR-199a-5p to MAP3K1. 图 4 Starbase网站预测LINC00662与miR-199a-5p、miR-199a-5p与MAP3K1的结合位点 Fig.4 Binding sites of LINC00662 to miR-199a-5p and those of miR-199a-5p to MAP3K1 were predicted using Starbase website |
| Group | WT-LINC00662 | MUT-LINC00662 | WT-MAP3K1 | MUT-MAP3K1 |
| miR-NC group | 1.05±0.12 | 1.06±0.11 | 1.01±0.10 | 1.04±0.12 |
| miR-199a-5p group | 0.36±0.07 | 1.02±0.10 | 0.29±0.05 | 1.03±0.11 |
| t | 12.166 | 0.659 | 15.774 | 0.150 |
| P | < 0.001 | 0.525 | < 0.001 | 0.883 |
|
| 1,blank group;,2,miR-NC group;3,miR-199a-5p group;4,anti-miR-NC group;5,anti-miR-199a-5p group. *P < 0.05 compared with the blank group;#P < 0.05 compared with miR-NC group;∆ P < 0.05 compared with anti-miR NC group. 图 5 Western blotting检测各组细胞中MAP3K1蛋白表达 Fig.5 Expression of MAP3K1 protein in each group by Western blotting |
3 讨论
尽管目前胃癌的诊治已取得突破性进展,但胃癌患者的5年生存率依然很低[7]。由于胃癌的死亡率与胃癌的转移密切相关,因此,迫切需要寻找肿瘤转移新的生物标志物,以便靶向治疗来提高患者生存率。
研究[8]证实,lncRNA在调控多种癌细胞的增殖、凋亡和转移中发挥重要作用。相关研究表明,LINC00662在前列腺癌组织及细胞中呈相对高表达,敲低其表达可抑制前列腺癌细胞增殖、侵袭和迁移,并促进其凋亡[9];LINC00662在肝癌组织中上调并与肝癌患者肿瘤大小、侵袭和较差的存活率相关[10];LINC00662过表达通过激活ERK信号通路促进结肠癌增殖、侵袭和迁移[11]。本研究结果显示,LINC00662在胃癌组织中高表达,下调LINC00662表达可抑制胃癌SGC-7901细胞的侵袭与迁移,提示LINC00662在胃癌中发挥着促癌基因的作用。相关研究指出MMP-2和MMP-9是MMPs家族中与肿瘤转移关系最为密切的两个成员,其可以通过降解细胞外基质中的Ⅳ型胶原酶促进肿瘤转移[12];N-cadherin是上皮间质转化的重要标志分子,其在肿瘤细胞中高表达可导致上皮间质转化,进而促进细胞迁移和侵袭[13]。本研究结果显示,下调LINC00662表达可抑制胃癌SGC-7901细胞中MMP-2、MMP-9、N-cadherin蛋白表达,提示沉默LINC00662可能通过下调MMP-2、MMP-9、N-cadherin表达抑制SGC-7901细胞的侵袭与迁移。
miR-199a-5p在多种肿瘤细胞中异常表达,参与调控肿瘤细胞的增殖代谢、侵袭转移等过程[14]。研究显示,过表达miR-199a-5p能够下调DDR1表达,抑制人脑胶质瘤细胞增殖和迁移[15];miR-199a-5p在非小细胞肺癌组织中低表达,其表达上调可抑制非小细胞肺癌细胞的增殖[16];miR-199a-5p在喉癌组织中的表达明显低于癌旁组织,过表达miR-199a-5p可显著抑制喉癌细胞的增殖、侵袭和迁移,同时诱导细胞凋亡[17]。本研究结果显示,miR-199a-5p在胃癌组织中低表达,抑制miR-199a-5p可减弱抑制LINC00662对胃癌SGC-7901细胞侵袭、迁移的影响,上调miR-199a-5p表达可增强抑制LINC00662对胃癌SGC-7901细胞侵袭、迁移的影响,提示抑制LINC00662可能通过上调miR-199a-5p的表达抑制SGC-7901细胞侵袭、迁移。MAP3K1是广泛存在于人体内的一种重要激酶,具有调控细胞迁移的作用[18]。有研究表明,过表达miR-196b通过下调MAP3K1来抑制人绒毛膜癌细胞的增殖、迁移和侵袭[19];miR-451可以通过抑制MAP3K1来抑制食管癌细胞增殖[20]。本研究结果显示,MAP3K1 mRNA在胃癌组织中高表达,沉默LINC00662后胃癌SGC-7901细胞中miR-199a-5p表达上调,MAP3K1蛋白表达下调,提示抑制LINC00662可能通过调控miR-199a-5p/MAP3K1来抑制胃癌细胞的侵袭与迁移。同时本研究还证实了LINC00662可靶向负调控miR-199a-5p的表达,miR-199a-5p可靶向负调控MAP3K1的表达,提示抑制LINC00662可通过靶向上调miR-199a-5p的表达进而间接下调MAP3K1的表达来发挥对胃癌细胞侵袭与迁移的抑制作用。
综上所述,抑制LINC00662可通过调控miR-199a-5p/MAP3K1抑制胃癌细胞侵袭与迁移。本研究为胃癌的早期诊断及靶向治疗提供了参考依据。
| [1] |
SIEGEL RL, MILLER KD, JEMAL A. Cancer statistics, 2019[J]. CA A Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [2] |
MILLER KD, NOGUEIRA L, MARIOTTO AB, et al. Cancer treatment and survivorship statistics, 2019[J]. CA A Cancer J Clin, 2019, 69(5): 363-385. DOI:10.3322/caac.21565 |
| [3] |
CHEN LT, OH DY, RYU MH, et al. Anti-angiogenic therapy in patients with advanced gastric and gastroesophageal junction cancer: a systematic review[J]. Cancer Res Treat, 2017, 49(4): 851-868. DOI:10.4143/crt.2016.176 |
| [4] |
WANG HM, YU MY, HU WX, et al. Linc00662 promotes tumorigenesis and progression by regulating miR-497-5p/AVL9 axis in colorectal cancer[J]. Front Genet, 2020, 10: 1385. DOI:10.3389/fgene.2019.01385 |
| [5] |
张明川, 张玲, 马一鸣, 等. MiR-199a-5p下调NF-κB信号通路激活水平抑制宫颈癌细胞恶性生物学行为[J]. 中国医药生物技术, 2019, 14(4): 329-334. DOI:10.3969/j.issn.1673-713X.2019.04.007 |
| [6] |
ZONG MZ, FENG WT, WAN L, et al. MiR-203 affects esophageal cancer cell proliferation, apoptosis and invasion by targeting MAP3K1[J]. Oncol Lett, 2020, 20(1): 751-757. DOI:10.3892/ol.2020.11610 |
| [7] |
MANKANEY G, MACARON C, BURKE CA. Refining risk factors for gastric cancer in patients with lynch syndrome to optimize surveillance esophagogastroduodenoscopy[J]. Clin Gastroenterol Hepatol, 2020, 18(4): 780-782. DOI:10.1016/j.cgh.2019.10.003 |
| [8] |
CHEN PX, FANG XL, XIA B, et al. Long noncoding RNA LINC00152 promotes cell proliferation through competitively binding endogenous miR-125b with MCL-1 by regulating mitochondrial apoptosis pathways in ovarian cancer[J]. Cancer Med, 2018, 7(9): 4530-4541. DOI:10.1002/cam4.1547 |
| [9] |
姚志峰, 潘志尧, 姚毅文, 等. 长链非编码RNA Linc00662促进前列腺癌细胞生长的研究[J]. 中华男科学杂志, 2020, 26(7): 588-594. DOI:10.13263/j.cnki.nja.2020.07.002 |
| [10] |
TIAN XH, WU YY, YANG YT, et al. Long noncoding RNA LINC00662 promotes M2 macrophage polarization and hepatocellular carcinoma progression via activating Wnt/β-catenin signaling[J]. Mol Oncol, 2020, 14(2): 462-483. DOI:10.1002/1878-0261.12606 |
| [11] |
CHENG B, RONG AM, ZHOU QB, et al. LncRNA LINC00662 promotes colon cancer tumor growth and metastasis by competitively binding with miR-340-5p to regulate CLDN8/IL22 co-expression and activating ERK signaling pathway[J]. J Exp Clin Cancer Res, 2020, 39(1): 5. DOI:10.1186/s13046-019-1510-7 |
| [12] |
王刚, 杨涛, 彭克楠, 等. Twist对膀胱癌细胞迁移、侵袭及MMP-2、MMP-9表达的影响[J]. 中国老年学杂志, 2018, 38(10): 2439-2442. DOI:10.3969/j.issn.1005-9202.2018.10.055 |
| [13] |
薛栋, 舒孟良, 张建, 等. 肝细胞癌组织中TRIM59、Akt及N-cadherin表达及其临床意义[J]. 中国老年学杂志, 2020, 40(22): 4740-4743. DOI:10.3969/j.issn.1005-9202.2020.22.012 |
| [14] |
MA S, JIA W, NI S. MiR-199a-5p inhibits the progression of papillary thyroid carcinoma by targeting SNAI1[J]. Biochem Biophys Res Commun, 2018, 497(1): 181-186. DOI:10.1016/j.bbrc.2018.02.051 |
| [15] |
闫兆月, 高玉帅, 贾玉龙, 等. MiR-199a-5p调控DDR1抑制人脑胶质瘤细胞增殖和迁移[J]. 中国药理学通报, 2021, 37(5): 687-692. DOI:10.3969/j.issn.1001-1978.2021.05.017 |
| [16] |
LI YL, WANG DT, LI X, et al. MiR-199a-5p suppresses non-small cell lung cancer via targeting MAP3K11[J]. J Cancer, 2019, 10(11): 2472-2479. DOI:10.7150/jca.29426 |
| [17] |
LI DJ, WANG X, YIN WH, et al. MiR-199a-5p suppresses proliferation and invasion of human laryngeal cancer cells[J]. Eur Rev Med Pharmacol Sci, 2020, 24(23): 12200-12207. |
| [18] |
黄萍, 周露. 浅谈MAP3K1的特点及其与乳腺癌的关系[J]. 现代养生(下半月版), 2018(1): 63-64. DOI:10.3969/j.issn.1671-0223(x).2018.01.049 |
| [19] |
GUO Z, SUI L, QI J, et al. MiR-196b inhibits cell migration and invasion through targeting MAP3K1 in hydatidiform mole[J]. Biomed Pharmacother, 2019, 113(1): 108760. DOI:10.1016/j.biopha.2019.108760 |
| [20] |
ZANG WQ, YANG X, WANG T, et al. MiR-451 inhibits proliferation of esophageal carcinoma cell line EC9706 by targeting CDKN2D and MAP3K1[J]. World J Gastroenterol, 2015, 21(19): 5867-5876. DOI:10.3748/wjg.v21.i19.5867 |
 2023, Vol. 52
2023, Vol. 52