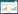文章信息
- 张诗敏, 王敏
- ZHANG Shimin, WANG Min
- 不同检验方法在HPV阳性患者分流中的效能
- Performance of different assays in the triage of human papilloma virus-positive patients
- 中国医科大学学报, 2023, 52(1): 18-23, 29
- Journal of China Medical University, 2023, 52(1): 18-23, 29
-
文章历史
- 收稿日期:2022-11-07
- 网络出版时间:2023-01-18 08:31:48
宫颈癌是女性常见的癌症之一。据统计2020年全球约有604 000例新发宫颈癌病例[1]。近年来,因宫颈癌筛查的推广及应用,宫颈癌的发病率及死亡率较前明显下降。人乳头瘤病毒(human papilloma virus,HPV)已经被明确为导致宫颈癌的主要原因[2]。HPV检测因具有灵敏度较高、受检测人员主观因素影响小的特点,被广泛应用于宫颈癌的初筛中。但是,与细胞学检测相比,HPV检测对宫颈癌及癌前病变早期筛查的特异度较低。为避免过度检查与治疗,目前急需一种可以用于HPV阳性患者分流的检测方法[3]。
DNA甲基化作为一种癌症检测的生物标志物,目前被广泛应用于多种癌症的的筛查[4-5]。有研究表明,PAX1甲基化与口腔癌、宫颈癌、结直肠癌、甲状旁腺癌相关,锌指蛋白582(zinc finger protein 582,ZNF582)甲基化可应用于口腔癌、鼻咽癌的检测。本研究将PAX1、ZNF582甲基化检测、HPV定量检测、HPV16/18分型检测、液基细胞学检测用于HPV筛查阳性患者的分流,探讨不同检测方法对HPV阳性患者分流的能力以及对宫颈癌及癌前病变的诊断效能。
1 材料与方法 1.1 研究对象选择2018年12月至2021年10月就诊于中国医科大学附属盛京医院门诊,且自愿要求行宫颈癌机会性筛查的女性作为研究对象。纳入标准:(1)年龄19~69岁,有过性生活史的女性;(2)无临床可疑的怀孕症状;(3)HPV分型检测结果为阳性;(4)废弃的液基细胞学检测剩余样本有足够的残留量用于DNA甲基化检测及HPV定量检测。排除标准:(1)宫颈病变治疗史(如子宫切除术等);(2)恶性肿瘤病史或其他严重疾病史。
对有异常宫颈癌初筛结果的患者行阴道镜检测,由有经验的阴道镜医师判断患者是否需要进一步于阴道镜下行宫颈活检。由2名有经验的病理医师对宫颈活检的病理结果进行诊断,以宫颈活检的病理结果作为本研究的诊断标准。对患者的液基细胞学检测后废弃样本行PAX1和ZNF582甲基化检测及HPV定量检测。最终共计有110例HPV阳性患者纳入研究。病理组织活检结果如下:良性/慢性子宫颈炎(n = 31),宫颈上皮内瘤样病变(cervical intraepithelial neoplasia,CIN)1(n = 41),CIN2(n = 17),CIN3(n = 15),宫颈恶性肿瘤(n = 6)。本研究获得医院伦理委员会批准,所有患者均签署知情同意书。
1.2 研究方法 1.2.1 HPV分型检测采用HPV核酸扩增分型检测试剂盒(21种HPV核酸分型检测,广东凯普生物科技股份有限公司),通过快速导流杂交技术对样本进行HPV基因分型检测。
1.2.2 液基细胞学检测利用全自动新柏氏液基细胞学制片仪将样本制成薄层细胞涂片,按照2014版The Bethesda System分类法作为诊断标准,由2名以上有经验的医师进行细胞学检测结果的诊断。
1.2.3 HPV定量检测(DH3检测)采用杂交捕获-化学发光法(DH3系统,杭州德同生物技术有限公司)进行高危型HPV检测。结果判定标准:相对光单位/截断值(relative light unit/cut-off,RLU/CO) > 1 μg/mL为阳性。
1.2.4 DNA甲基化检测按照试剂盒(PAX1及ZNF582甲基化检测试剂盒,湖南宏雅基因技术有限公司)说明书进行操作。实验完成后导出数据,并进行结果分析。DNA甲基化水平评估指数(M-index)=10 000×2-ΔCp。ΔCp≤9为高度甲基化,ΔCP > 9为低度甲基化。
1.3 统计学分析采用SPSS 26.0软件进行数据的统计分析。将病理为良性/慢性宫颈炎及CIN1设为CIN1-组,CIN2、CIN3、宫颈恶性肿瘤设为CIN2+组。将病理为良性/慢性宫颈炎、CIN1及CIN2设为CIN2-组,将CIN3、宫颈恶性肿瘤列为CIN3+组。分别采用χ2和两样本秩和检验分析不同检测方法对CIN1-组和CIN2+组以及对CIN2-组和CIN3+组的检测效能。同时绘制受试者操作特征(receiver operating characteristic,ROC)曲线计算不同检验方法的截断值,采用Spearman相关分析探讨不同分流方法与宫颈病变之间的相关性。P < 0.05为差异有统计学意义。
2 结果 2.1 患者的基本特征本研究共纳入HPV阳性患者110例,平均年龄(43.66±1.16)岁,平均初次怀孕年龄(24.48±3.16)岁。按照活检病理结果,CIN1-组72例,CIN2+组38例,2组患者在初次怀孕年龄方面存在统计学差异(Z = 2.038,P = 0.042),CIN1-组与CIN2+组患者在文化程度、性生活开始年龄、接触性出血史、妊娠次数、宫颈癌筛查史、吸烟史方面均不存在统计学差异。见表 1。
| Variable | Total | CIN1- | CIN2+ | Z/χ2 | P |
| Education degree | 0.570 | 0.569 | |||
| Primary school and below | 11(10.0) | 7(9.7) | 4(10.5) | ||
| Junior high school | 35(31.8) | 20(27.7) | 15(39.5) | ||
| High school or technical secondary school | 23(20.9) | 18(25) | 5(13.1) | ||
| Diploma or undergraduate | 40(36.4) | 27(37.5) | 13(34.2) | ||
| Graduate or above | 1(0.9) | 0(0.0) | 1(2.6) | ||
| Total | 110(100.0) | 72(65.5) | 38(34.5) | ||
| Age of first sexual life | 1.229 | 0.219 | |||
| < 20 years | 6(5.5) | 2(2.7) | 4(10.5) | ||
| 20- < 30 years | 102(92.7) | 69(95.8) | 33(86.8) | ||
| 30- < 40 years | 2(1.8) | 1(1.4) | 1(2.6) | ||
| ≥40 years | 0(0.0) | 0(0.0) | 0(0.0) | ||
| Total | 110(100.0) | 72(65.5) | 38(34.5) | ||
| Contact bleeding | < 0.001 | 0.995 | |||
| Yes | 13(11.8) | 8(11.1) | 5(13.1) | ||
| No | 97(88.2) | 64(88.8) | 33(86.8) | ||
| Total | 110(100.0) | 72(65.5) | 38(34.5) | ||
| Pregnancies times | 0.413 | 0.679 | |||
| 0-1 | 40(36.4) | 26(36.1) | 14(36.8) | ||
| 2-3 | 53(48.2) | 33(45.8) | 20(52.6) | ||
| 4-5 | 14(12.7) | 11(15.3) | 3(7.9) | ||
| ≥6 | 3(2.7) | 2(2.7) | 1(2.6) | ||
| Total | 110(100.0) | 72(65.5) | 38(34.5) | ||
| Age of first pregnancy | 2.038 | 0.042 | |||
| < 20 years | 2(2.0) | 0(0.0) | 2(5.9) | ||
| 20- < 30 years | 89(89.9) | 58(89.2) | 31(91.2) | ||
| 30- < 40 years | 8(8.1) | 7(10.8) | 1(2.9) | ||
| ≥40 years | 0(0.0) | 0(0.0) | 0(0.0) | ||
| Total | 99(100.0) | 65(65.7) | 34(34.3) | ||
| Previous cervical cancer screening | 0.096 | 0.757 | |||
| Yes | 47(42.7) | 30(41.6) | 17(44.7) | ||
| No | 63(57.3) | 42(58.3) | 21(55.2) | ||
| Smoking history | 0.345 | ||||
| Yes | 1(0.9) | 0(0.0) | 1(2.6) | ||
| No | 109(99.1) | 72(100.0) | 37(97.4) |
2.2 不同检测方法对HPV阳性患者的分流效能
将液基细胞学检测结果中未见上皮内病变细胞和恶性细胞(negative for intraepithelial lesion or malig- nancy,NILM)设为检验阴性,结果为无明确诊断意义的不典型鳞状细胞(atypical squamous cell of undetermined significance,ASCUS)设为检验阳性,CIN1- 组与CIN2+组以及CIN2-组与CIN3+组的液基细胞学结果比较,均无统计学差异。CIN1-组和CIN2+组、CIN2-组与CIN3+组PAX1及ZNF582甲基化检测结果比较,均有统计学差异。CIN1-组与CIN2+组以及CIN2-组与CIN3+组PAX1甲基化检测、ZNF582甲基化检测、DH3(16/18)检测、HPV16/18分型检测结果比较,差异有统计学意义(P < 0.05)。见表 2。
| Variable | Total | CIN1- | CIN2+ | P | CIN2- | CIN3+ | P# |
| TCT | 110 | 0.056 | 0.281 | ||||
| NILM [n(%)] | 9(8.2) | 9(12.5) | 0(0.0) | 9(10.1) | 0(0.0) | ||
| ASCUS+ [n(%)] | 101(91.8) | 63(87.5) | 38(100.0) | 80(89.9) | 21(100.0) | ||
| PAX1 | 109 | < 0.001 | < 0.001 | ||||
| ΔCp > 9 [n(%)] | 94(86.2) | 69(97.2) | 25(65.8) | 83(94.3) | 11(52.4) | ||
| ΔCp≤9 [n(%)] | 15(13.8) | 2(2.8) | 13(34.2) | 5(5.7) | 10(47.6) | ||
| M-index | 0.04(0.02-0.18) | 0.03(0.01-0.09) | 0.13(0.04-131.3) | < 0.001 | 0.03(0.01-0.09) | 11.86(0.07-916.49) | < 0.001 |
| ZNF582 | 106 | < 0.001 | < 0.001 | ||||
| ΔCp > 9 [n(%)] | 89(84.0) | 68(97.1) | 21(58.3) | 82(94.3) | 7(36.8) | ||
| ΔCp≤9 [n(%)] | 17(16.0) | 2(2.9) | 15(41.7) | 5(5.7) | 12(63.2) | ||
| M-index | 0.08(0.03-1.14) | 0.05(0.02-0.13) | 2.05(0.09-148.22) | < 0.001 | 0.06(0.02-0.17) | 120.07(0.37-625.00) | < 0.001 |
| PAX1 and ZNF582 | 105 | < 0.001 | < 0.001 | ||||
| ΔCp > 9 [n(%)] | 85(81.0) | 66(94.3) | 19(54.3) | 79(91.9) | 6(31.6) | ||
| ΔCp≤9 [n(%)] | 20(19.0) | 4(5.7) | 16(45.7) | 7(8.1) | 13(68.4) | ||
| HPV 16/18 | 105 | < 0.001 | < 0.001 | ||||
| Negative [n(%)] | 50(45.5) | 41(56.9) | 9(23.7) | 47(52.8) | 3(14.3) | ||
| Positive [n(%)] | 60(54.5) | 31(43.1) | 29(76.3) | 42(47.2) | 18(85.7) | ||
| DH3(16/18) | 110 | 0.013 | 0.002 | ||||
| Negative [n(%)] | 64(58.2) | 48(66.7) | 16(42.1) | 58(65.2) | 6(28.6) | ||
| Positive [n(%)] | 46(41.8) | 24(33.3) | 22(57.9) | 31(34.8) | 15(71.4) | ||
| DH3(12 high-risk HPV) | 110 | 0.708 | 0.863 | ||||
| Negative [n(%)] | 49(44.5) | 33(45.8) | 16(42.1) | 40(44.9) | 9(42.9) | ||
| Positive [n(%)] | 61(55.5) | 39(54.2) | 22(57.9) | 49(55.1) | 12(57.1) | ||
| DH3* | 110 | 0.060 | 0.024 | ||||
| Negative [n(%)] | 26(23.6) | 21(29.2) | 5(13.2) | 25(28.1) | 1(4.8) | ||
| Positive [n(%)] | 84(76.4) | 51(70.8) | 33(86.8) | 64(71.9) | 20(95.2) | ||
| PAX1 and TCT | 109 | 0.078 | 0.332 | ||||
| Negative [n(%)] | 8(7.3) | 8(11.3) | 0(0.0) | 8(9.1) | 0(0.0) | ||
| Positive [n(%)] | 101(92.7) | 63(88.7) | 38(100.0) | 80(90.9) | 21(100.0) | ||
| ZNF582 and TCT | 106 | 0.060 | 0.312 | ||||
| Negative [n(%)] | 9(8.5) | 9(12.9) | 0(0.0) | 9(10.3) | 0(0.0) | ||
| Positive [n(%)] | 97(91.5) | 61(87.1) | 36(100.0) | 78(89.7) | 19(100.0) | ||
| PAX1,ZNF582 and TCT | 105 | 0.064 | 0.307 | ||||
| Negative [n(%)] | 9(8.6) | 9(12.9) | 0(0.0) | 9(10.5) | 0(0.0) | ||
| Positive [n(%)] | 96(91.4) | 61(87.1) | 35(100.0) | 77(89.5) | 19(100.0) | ||
| * refers to the detection of DH3(16/18)test and DH3(other 12 HPV high-risk virus)test;# refers to the statistical analysis between CIN2+ group and CIN3+ group. NILM,negative for intraepithelial lesion or malignancy;ASCUS,atypical squamous cell of undetermined significance;ASC-H,atypical squamous cells can not exclude a high-grade squamous intraepithelial lesion;ISIL,low-grade squamous intraepithelial lesion;HSIL;high-grade squamous intraepithelial lesion;AGC,atypical glandular cell. | |||||||
2.3 不同检测方法对HPV阳性患者的诊断效能
对PAX1和ZNF582甲基化检测行ROC曲线分析,结果显示,PAX1甲基化检测CIN2+曲线下面积为0.735(0.634~0.837),且P < 0.001。ZNF582甲基化检测CIN2+曲线下面积为0.803(0.711~0.895),且P < 0.001。不同检测方法对HPV阳性患者的诊断效能包括诊断的灵敏度、特异度、阳性预测值、阴性预测值、准确性、截断值见图 1、表 3。
|
| 图 1 PAX1和ZNF582的ROC曲线 Fig.1 The receiver operating characteristic curve of PAX1 and ZNF582 methylation |
| Variable | Cut-off | AUC(validity) | Sensitivity(%) | Specificity(%) | PPV(%) | NPV(%) | Accuracy(%) |
| PAX1(CIN2+) | ≥7.68 | 0.735(0.634-0.837) | 34.2 | 97.2 | 86.7 | 73.4 | 75.2 |
| ZNF582(CIN2+) | ≥0.33 | 0.803(0.711-0.895) | 41.7 | 97.1 | 88.2 | 76.4 | 78.3 |
| ZNF582*(CIN2+) | ≥0.96 | 0.803(0.711-0.895) | 41.7 | 97.1 | 88.2 | 76.4 | 78.3 |
| PAX1 and ZNF582(CIN2+) | 45.7 | 94.3 | 80.0 | 77.6 | 78.1 | ||
| TCT(CIN2+) | 100.0 | 12.5 | 37.6 | 100.0 | 42.7 | ||
| HPV16/18(CIN2+) | 76.3 | 56.9 | 48.3 | 82.0 | 66.7 | ||
| DH3 16/18(CIN2+) | 57.9 | 66.7 | 47.8 | 75.0 | 63.6 | ||
| DH3 12 high-risk HPV(CIN2+) | 57.9 | 45.8 | 36.1 | 67.3 | 50.0 | ||
| PAX1(CIN3+) | ≥1.04 | 0.824(0.717-0.930) | 47.6 | 94.3 | 66.7 | 88.3 | 85.3 |
| ZNF582(CIN3+) | ≥0.33 | 0.858(0.761-0.955) | 63.2 | 94.3 | 70.6 | 92.1 | 88.7 |
| PAX1 and ZNF582(CIN3+) | 68.4 | 91.9 | 65.0 | 92.9 | 87.6 | ||
| TCT(CIN3+) | 100.0 | 10.1 | 20.8 | 100.0 | 27.3 | ||
| HPV16/18(CIN2+) | 85.7 | 52.8 | 30.0 | 94.0 | 61.9 | ||
| DH316/18(CIN3+) | 71.4 | 65.2 | 32.6 | 90.6 | 66.4 | ||
| DH3 12 high-risk HPV(CIN3+) | 57.1 | 44.9 | 19.7 | 81.6 | 47.3 | ||
| There are two optimal critical points of ZNF582(CIN2+),which are distinguished by *. NPV,negative predictive value;PPV,positive predictive value. | |||||||
2.4 甲基化检测与宫颈活检病理的Spearman相关分析
Spearman相关分析结果表明,PAX1甲基化检测与宫颈活检病理之间存在相关性(r = 0.451,P < 0.001);ZNF582甲基化检测与宫颈活检病理之间也存在相关性(r = 0.516,P < 0.001)。
2.5 不同宫颈病变患者的PAX1及ZNF582甲基化水平比较结果显示,随着研究对象宫颈病变病理等级的升高,PAX1甲基化水平评估指数及ZNF582甲基化水平评估指数也逐渐升高。病理等级为CIN3+的研究对象的PAX1及ZNF582甲基化水平评估指数较病理等级为CIN2-的研究对象显著升高,见图 2。
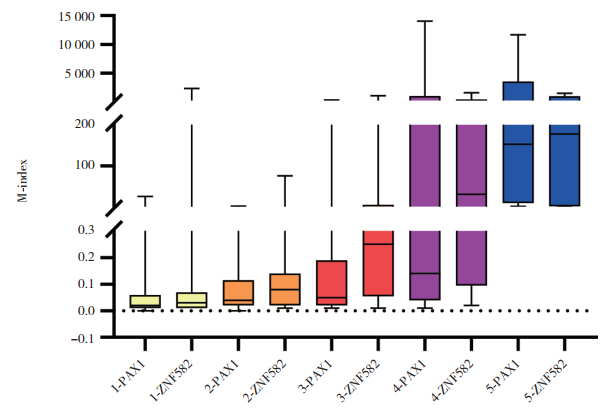
|
| Pathological grade: 1=benign/chronic cervicitis; 2=CIN1;3=CIN2;4=CIN3;5=cervical cancer. 图 2 不同病理等级的甲基化水平指数 Fig.2 Methylation level evaluation index of different pathological grades |
3 讨论
HPV检测因具有较高的灵敏度已逐步取代细胞学检测,成为女性宫颈癌的初筛方法。但相比于细胞学检测,HPV检测也存在特异度低等缺点。多数HPV病毒感染是非致癌性的,且绝大多数HPV感染会在2年内消除[6]。因此,各国学者正在努力寻求分流HPV检测阳性女性的方法。
DNA甲基化是表观遗传学的重要组成部分,目前已经在多种癌症的早期诊断中发挥重要作用[3]。PAX1在脊椎动物胚胎发育过程中有重要作用,PAX1启动子甲基化与多种肿瘤的发生发展和转移相关,并且已在口腔癌、卵巢癌、头颈部鳞状细胞癌等恶性肿瘤的诊断中表现出良好的诊断灵敏度和特异度,逐渐成为癌症早期检测与预测复发的潜在生物学标志物。目前,PAX1甲基化在一些亚洲宫颈癌筛查研究[7-8]中展现出较好的检测效能。但绝大多数研究未探讨PAX1甲基化对HPV阳性人群的分流作用。本研究结果显示,PAX1甲基化检测在HPV阳性患者分流中有一定的作用。研究[9]表明,PAX1甲基化与宫颈病变进展以及宫颈癌的发生相关,宫颈病变越重,PAX1甲基化水平越高。本研究显示,随着HPV检测阳性患者宫颈病变病理等级的升高,PAX1甲基化水平评估指数逐渐升高,与既往研究结果一致。目前也有关于ZNF582甲基化在宫颈癌筛查中作用的研究[10],结果发现,ZNF582甲基化水平随着宫颈病变加重而升高。
本研究结果还发现,PAX1及ZNF582甲基化检测较细胞学(ASCUS+)检测对CIN2+有更好的特异性及阳性预测值,提示PAX1及ZNF582甲基化检测在HPV阳性患者的分流及宫颈病变筛查中可能发挥更好的作用。为日后DNA甲基化检测用于HPV阳性患者的分流及宫颈病变筛查提供了有利的证据。
本研究的不足之处在于样本量较小,本课题组后续将扩大样本量继续相关研究。目前也有关于启动子甲基化与宫颈癌之间相关机制的研究[11-12],为更好地证实PAX1及ZNF582甲基化与宫颈癌及癌前病变的相关性,今后将对相关机制进行研究。此外,未来将对已证实为宫颈癌前病变及宫颈癌患者进行随访,进一步观察患者的后续结局与相应的DNA甲基化水平之间的关系。
| [1] |
SUNG H, FERLAY J, SIEGEL RL, et al. Global cancer statistics 2020:globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
BOSCH FX, LORINCZ A, MUÑOZ N, et al. The causal relation between human papillomavirus and cervical cancer[J]. J Clin Pathol, 2002, 55(4): 244-265. DOI:10.1136/jcp.55.4.244 |
| [3] |
LORINCZ AT. Virtues and weaknesses of DNA methylation as a test for cervical cancer prevention[J]. Acta Cytol, 2016, 60(6): 501-512. DOI:10.1159/000450595 |
| [4] |
CHENG SJ, CHANG CF, KO HH, et al. Hypermethylated ZNF582 and PAX1 genes in mouth rinse samples as biomarkers for oral dysplasia and oral cancer detection[J]. Head Neck, 2018, 40(2): 355-368. DOI:10.1002/hed.24958 |
| [5] |
LIU HF, MENG X, WANG JY. Real time quantitative methylation detection of PAX1 gene in cervical cancer screening[J]. Int J Gynecol Cancer, 2020, 30(10): 1488-1492. DOI:10.1136/ijgc-2019-001144 |
| [6] |
OKUNADE KS. Human papillomavirus and cervical cancer[J]. J Obstet Gynaecol, 2020, 40(5): 602-608. DOI:10.1080/01443615.2019.1634030 |
| [7] |
KREMER WW, STEENBERGEN R, HEIDEMAN D, et al. The use of host cell DNA methylation analysis in the detection and management of women with advanced cervical intraepithelial neoplasia: a review[J]. BJOG, 2021, 128(3): 504-514. DOI:10.1111/1471-0528.16395 |
| [8] |
ZHANG L, YU J, HUANG WX, et al. A sensitive and simplified classifier of cervical lesions based on a methylation-specific PCR assay: a Chinese cohort study[J]. Cancer Manag Res, 2020, 12: 2567-2576. DOI:10.2147/CMAR.S246103 |
| [9] |
LUAN T, HUA Q, LIU X, et al. PAX1 methylation as a potential biomarker to predict the progression of cervical intraepithelial neoplasia: a meta-analysis of related studies[J]. Int J Gynecol Cancer, 2017, 27(7): 1480-1488. DOI:10.1097/IGC.0000000000001011 |
| [10] |
SHEN-GUNTHER J, XIA QQ, STACEY W, et al. Molecular pap smear: validation of HPV genotype and host methylation profiles of ADCY8, CDH8, and ZNF582 as a predictor of cervical cytopathology[J]. Front Microbiol, 2020, 11: 595902. DOI:10.3389/fmicb.2020.595902 |
| [11] |
HAN YX, JI LY, GUAN YF, et al. An epigenomic landscape of cervical intraepithelial neoplasia and cervical cancer using single-base resolution methylome and hydroxymethylome[J]. Clin Transl Med, 2021, 11(7): e498. DOI:10.1002/ctm2.498 |
| [12] |
DU P, ZHI Y, WANG R, et al. Aberrant methylation of the SOX21-AS1 promoter region promotes gene expression and its clinical value in cervical cancer[J]. Reprod Sci, 2021, 28(2): 532-540. DOI:10.1007/s43032-020-00335-y |
 2023, Vol. 52
2023, Vol. 52