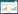文章信息
- 何欣, 刘云鹏, 李冬阳, 车晓芳
- HE Xin, LIU Yunpeng, LI Dongyang, CHE Xiaofang
- 基于网络药理学和分子对接预测大黄治疗胃癌的作用机制
- Molecular mechanism of rheum officinale in gastric cancer treatment based on network pharmacology and molecular docking
- 中国医科大学学报, 2023, 52(1): 6-11,17
- Journal of China Medical University, 2023, 52(1): 6-11,17
-
文章历史
- 收稿日期:2022-05-05
- 网络出版时间:2023-01-17 17:19:45
2. 辽宁省肿瘤药物与生物治疗重点实验室, 沈阳 110001
2. Key Laboratory of Anticancer Drugs and Biotherapy of Liaoning Province, Shenyang 110001, China
胃癌是全世界范围内常见的恶性肿瘤[1],我国胃癌发病率呈逐年递增趋势[2]。由于胃癌本身的特点,大多数患者就诊时已为中晚期,且目前治疗效果欠佳,5年生存率仅为35.1% [3]。胃癌患者普遍营养状态和体能较差,对于手术、放化疗等治疗手段带来的不良反应发生率较高,在治疗过程中联合中药治疗胃癌,能缓解放化疗不良反应、改善患者生活质量。研究[4]表明中药对胃癌的转移和复发有一定的抑制作用。
大黄,味苦性寒,具有沉降之性,以及泻下攻积,凉血解毒,清热泻火,活血祛瘀的功效,适用于癌症的治疗[5]。大黄的化学成分大约有160多个,主要分8个类别,其中大黄酸、大黄素、蒽酮衍生物等具有明显抗肿瘤作用,主要通过抑制肿瘤细胞增殖和促进其凋亡发挥作用[6]。然而,大黄在胃癌中发挥抗肿瘤作用的关键成分和关键作用靶点尚不十分清楚。因此,本研究拟将疾病-药物-成分-靶点联成网络,通过网络药理学和生物信息学的方法,探讨大黄在胃癌中发挥抗肿瘤作用的机制和潜在靶点,以期为其抗肿瘤机制的深入研究及临床应用提供科学依据。
1 材料与方法 1.1 获取大黄活性成分及其靶点通过检索中药系统药理学数据库和分析平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php)数据库[7],在“Herb name”中以“大黄”进行检索,然后以口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-like,DL)≥0.18为标准进一步筛选,最终获得大黄的活性成分。利用TCMSP获取大黄活性成分靶标蛋白,逐一通过UniProtKB数据库(https://www.uniprot.org/)进行检索,将蛋白名称转化为对应的基因名称。
1.2 胃癌靶基因获取从癌症基因组图谱数据库(The Cancer Genome Atlas,TCGA)获取胃癌组织及癌旁组织的mRNA表达信息,使用rawcount格式数据,利用R软件的DESeq2包进行差异分析获得差异基因,以log2 foldchange绝对值> 1且P < 0.05作为标准进一步筛选。利用GeneCards数据库(https://www.genecards.org/)检索关键词“gastric cancer”保留Score > 5分的基因,将2个数据库的检索结果进行合并去重得到胃癌的潜在治疗靶点。
1.3 大黄治疗胃癌的靶基因获取将大黄潜在活性化合物的作用靶点和胃癌的潜在治疗靶点输入TBtools软件,取交集最终获得“大黄-胃癌”的交集靶点,绘制韦恩图。
1.4 疾病-药物-成分-靶点网络建立应用Cytoscape 3.7.2软件[8]将疾病、药物、活性成分、交集基因之间的关系和相互作用绘制成网络图,分别标注不同颜色,用连线表示其之间关联,并进行可视化处理输出图片。
1.5 交集靶基因富集分析利用潜在作用靶点,使用Metascape网站(https://metascape.org/)[9]进行京都基因和基因组数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路、基因本体论(gene ontology,GO)分类富集分析(参数设置为Min Overlap:3;P Value Cutoff:0.01;Min Enrichment:1.5),挖掘大黄治疗胃癌的作用机制。其中,GO富集分析根据生物过程(biological process,BP)、细胞成分(cellular component,CC)和分子功能(molecular function,MF)类别对靶点进行注释和分类。
1.6 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络分析应用Metascape网站进行PPI分析,并根据MCODE算法识别功能密切关联的关键基因簇。
1.7 分子对接从Protein Data Bank数据库(http://www.rcsb.org/pdb)中检索获得关键基因簇中基因编码的蛋白结构文件,通过pubchem网站(https://pubchem.ncbi.nlm.nih.gov/)检索获取关键基因对应的大黄的活性成分的SDF结构文件,利用AutoDock Vina 1.1.2软件进行分子对接。
2 结果 2.1 获取大黄活性成分通过TCMSP数据库共检索到大黄已报道的成分92个,从其中筛选口服生物利用度OB≥30%、类药性DL≥0.18的潜在活性化合物共16个(表 1)。16个活性成分中仅有10个(MOL002235,MOL000471,MOL000096,MOL002268,MOL002281,MOL002288,MOL002280,MOL002259,MOL000358,MOL002297)能够检索到对应的靶点,对10个活性成分的靶点合并去重得到110个最终靶点,将110个靶点的蛋白名称在Uniprot数据库中转化为相应的基因名称,共得到55个基因靶点。
| Mol ID | Molecule name | OB(%) | DL |
| MOL002235 | EUPATIN | 50.80 | 0.41 |
| MOL000471 | Aloe-emodin | 83.38 | 0.24 |
| MOL002293 | Sennoside D_qt | 61.06 | 0.61 |
| MOL002276 | Sennoside E_qt | 50.69 | 0.61 |
| MOL000096 | (-)-catechin | 49.68 | 0.24 |
| MOL002251 | Mutatochrome | 48.64 | 0.61 |
| MOL002268 | Rhein | 47.07 | 0.28 |
| MOL002281 | Toralactone | 46.46 | 0.24 |
| MOL002288 | Emodin-1-O-beta-D-glucopyranoside | 44.81 | 0.80 |
| MOL002280 | Torachrysone-8-O-beta-D-(6’-oxayl)-glucoside | 43.02 | 0.74 |
| MOL002259 | Physciondiglucoside | 41.65 | 0.63 |
| MOL000358 | Beta-sitosterol | 36.91 | 0.75 |
| MOL002297 | Daucosterol_qt | 35.89 | 0.70 |
| MOL002303 | Palmidin A | 32.45 | 0.65 |
| MOL002260 | Procyanidin B-5,3’-O-gallate | 31.99 | 0.32 |
| MOL000554 | Gallic acid-3-O-(6’-O-galloyl)-glucoside | 30.25 | 0.67 |
2.2 大黄治疗胃癌靶基因获取
通过TCGA获得胃癌数据库中癌和癌旁的差异基因5 739个,通过GeneCards网站获得胃癌相关基因2 951个,两者并集合计7 886个基因。将大黄潜在活性成分的作用靶点与胃癌的潜在治疗靶点取交集获得46个基因,利用TBtools软件绘制韦恩图,见图 1。
|
| 图 1 大黄与胃癌交集基因韦恩图 Fig.1 Venn picture of intersecting targets |
2.3 疾病-药物-成分-靶点网络建立
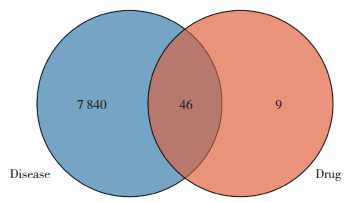
利用Cytoscape软件绘制胃癌-大黄-活性成分-靶点网络图,其中靶点为46个交集基因(图 2)。对应的靶基因数目排名前3位的分别为β-谷甾醇24个、芦荟大黄素19个、泽兰黄醇12个。这一结果提示,β-谷甾醇、芦荟大黄素和泽兰黄醇可能是抑制胃癌的主要成分。
|
| 图 2 胃癌-大黄-活性成分-靶点网络图 Fig.2 Gastric cancer-rheum officinale-active component-targets network |
2.4 交集靶基因富集分析
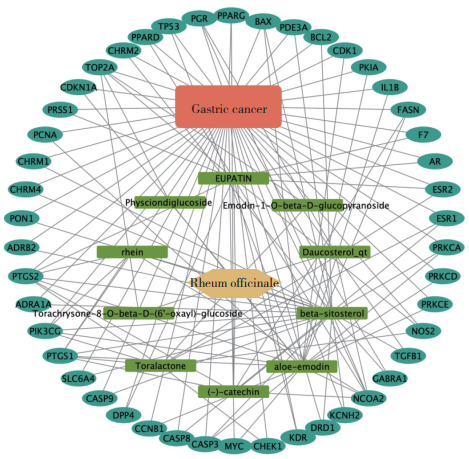
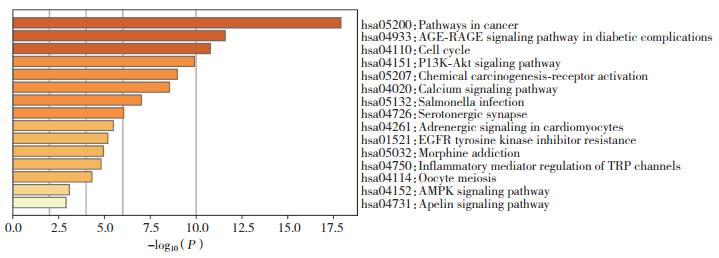
富集分析结果显示,大黄的抗胃癌靶点涉及多种作用途径,分析结果按照P值排序。GO富集分析筛选后发现,主要涉及的生物过程包括凋亡信号通路,对缺氧的反应,程序性细胞死亡的正向调节,MAPK通路调节等(图 3)。KEGG富集分析经过筛选后发现,与胃癌相关的通路包括癌症信号通路,细胞周期通路,PI3K-Akt信号通路等(图 4)。因此,大黄可能通过抑制细胞周期、促进凋亡来抑制胃癌细胞增殖。
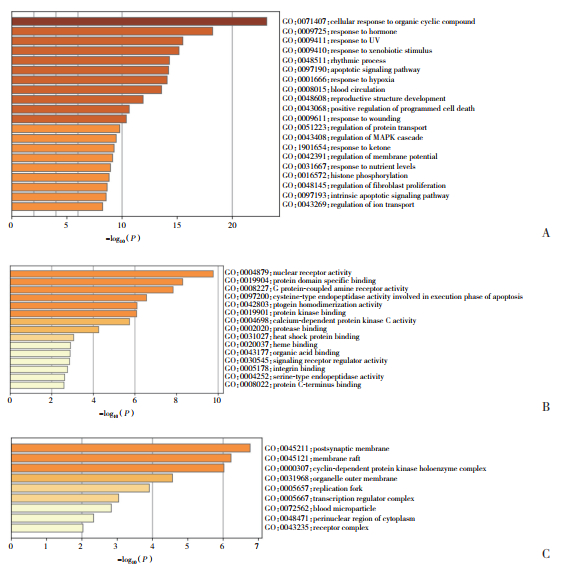
|
| A,biological process;B,molecular function;C,cellular component. 图 3 大黄治疗胃癌靶点的GO富集分析 Fig.3 GO enrichment analysis |
|
| 图 4 大黄治疗胃癌靶点的KEGG富集分析 Fig.4 KEGG enrichment analysis |
2.5 PPI网络分析
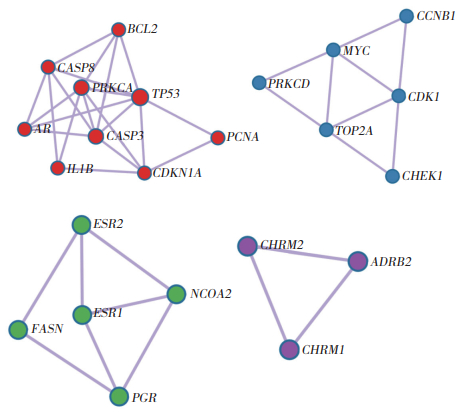
PPI分析结果保留STRING方法中physical score > 0.132的节点,绘制PPI网络图。利用MCODE算法分析得到的4个功能相对集中的子网络基因簇,其中红色标记组分值最高,该基因簇包括BCL2、CASP8、AR、IL1B、CASP3、PRKCA、TP53、CDKN1A、PCNA(图 5)。
|
| 图 5 功能基因组图 Fig.5 Key subnetwork gene clusters |
2.6 分子对接
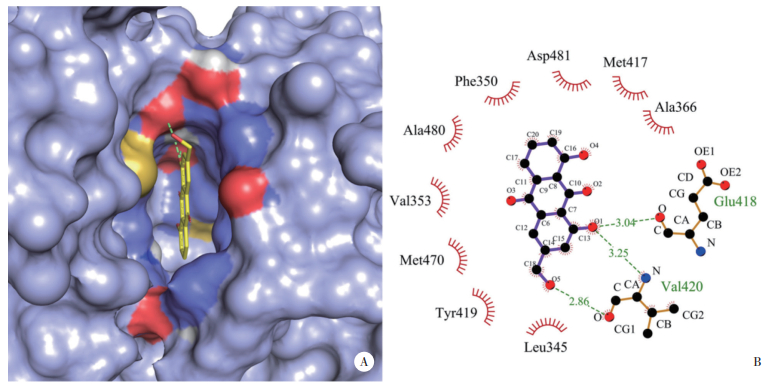
为证明靶点蛋白与大黄活性成分间的结合活性,将关键基因簇中的9个基因BCL2、CASP8、AR、IL1B、CASP3、PRKCA、TP53、CDKN1A、PCNA与其对应的活性成分分别进行分子对接。AutoDock Vina的结果以一种亲和能(Affinity)的形式输出,能值越低,两者的结合效果越好,11组对接结果显示亲和能都较好(表 2),其中PRKCA与芦荟大黄素结合能最大。PRKCA与aloe-emodin之间的结合模式图如图 6A所示,通过计算结果显示,氨基酸残基Glu418、Val420与aloe-emodin分子形成氢键相互作用,氨基酸残基Ala366、Met417、Asp481、Phe350、Ala480、Val353、Met470、Tyr419、Leu345与aloe-emodin分子形成疏水相互作用(图 6B)。上述结果提示,芦荟大黄素靶向PRKCA促进细胞凋亡可能是大黄在胃癌中发挥抗肿瘤作用的最关键机制。
| Gene | Protein | PDB ID | EUPATIN | Beta-sitosterol | Aloe-emodin |
| AR | Androgen receptor | 5V8Q | -8.0 | - | - |
| BCL2 | Apoptosis regulator Bcl-2 | 5JSN | - | -7.7 | - |
| CASP3 | Caspase-3 | 1RHJ | - | -6.3 | -6.1 |
| CASP8 | Caspase-8 | 4PS1 | - | -7.1 | - |
| CDKN1A | Cyclin-dependent kinase inhibitor 1 | 6P8H | - | - | -6.3 |
| IL1B | Interleukin-1 beta | 5R86 | - | - | -6.5 |
| PCNA | Proliferating cell nuclear antigen | 1AXC | - | - | -7.3 |
| PRKCA | Protein kinase C alpha type | 3IW4 | - | -8.1 | -9.3 |
| TP53 | Cellular tumor antigen p53 | 3Q05 | - | - | -7.1 |
|
| A, macromolecular docking pattern diagram; B, binding sites of PRKCA type and aloe-emodin. 图 6 PRKCA与芦荟大黄素的对接图 Fig.6 The docking diagram of PRKCA type and aloe-emodin |
3 讨论
本研究利用网络药理学技术,整体分析评价了大黄与胃癌的可能作用关系,并预测了大黄作用于胃癌的可能分子机制。大黄的活性成分中芦荟大黄素、β-谷甾醇、泽兰黄醇在网络中对应的靶点较多,可能在后续研发抗肿瘤新药的过程中成为先导化合物。刘豪杰等[10-12]研究证明芦荟大黄素可能通过激活p53/AMPK/mTOR信号通路,增强细胞自噬水平,促进SGC-7901细胞凋亡,还可以阻滞SGC-7901细胞在G0/G1期,抑制其增殖能力,降低迁移和侵袭能力,并通过抑制Notch-1/AKT/NF-κB信号通路诱导细胞凋亡,随后又发现芦荟大黄素可能通过抑制肿瘤细胞EMT及改善Cav-1/PTEN/PI3K/PKB信号通路来抑制胃癌SGC-7901细胞迁移及侵袭能力。
通过分析获得大黄治疗胃癌的潜在靶点共46个,GO富集分析结果包括凋亡信号通路,对缺氧的反应,程序性细胞死亡的正向调节,MAPK通路调节等。KEGG富集分析包括癌症信号通路,细胞周期通路,PI3K-Akt信号通路等。进一步进行PPI分析及MCODE算法分析,得到4个功能相对密集的基因簇,其中评分最高一组包含的基因为BCL2、CASP8、AR、IL1B、CASP3、PRKCA、TP53、CDKN1A、PCNA。在这9个基因中,多个基因与凋亡相关,且在凋亡信号通路上起到至关重要的作用。BCL2在许多癌症中高度上调,使其成为癌症治疗的理想靶标,目前也有Bcl-2抑制剂正在进行临床研究,例如,Bcl-2/Bcl-xl抑制剂APG-1252-M1在6种胃癌细胞中均观察到诱导凋亡的作用[13]。CASP8编码的caspase-8是控制细胞凋亡、坏死性凋亡和细胞焦亡的分子开关。CASP8的表达还能触发ASC斑点的形成、caspase-1的激活和白细胞介素-1β(IL1B编码)的分泌[14]。通过对胃癌术后患者的标本进行caspase-3免疫组化,发现胃癌患者中caspase-3的表达与良好的临床病理特征和根治性手术后的积极预后有关[15]。
综上所述,富集分析结果表明大黄可以通过影响凋亡、程序性细胞死亡、MAPK通路调节、细胞周期、PI3K-Akt信号通路等多种生物途径发挥抗胃癌功能,影响胃癌患者预后,其中凋亡通路起到重要作用。因此推测大黄的主要成分之一芦荟大黄素通过靶向PRKCA促进胃癌细胞凋亡是大黄在胃癌中发挥抗肿瘤作用的关键。当然这一推测还需要进一步的细胞模型和动物模型的验证。本研究通过数据挖掘和分子对接对大黄治疗胃癌进行分析,为今后大黄治疗胃癌的进一步研究奠定了基础。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018:globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
曹毛毛, 李贺, 孙殿钦, 等. 2000-2019年中国胃癌流行病学趋势分析[J]. 中华消化外科杂志, 2021, 20(1): 102-109. DOI:10.3760/cma.j.cn115610-20201130-00746 |
| [3] |
ZENG HM, CHEN WQ, ZHENG RS, et al. Changing cancer survival in China during 2003-15:a pooled analysis of 17 population-based cancer registries[J]. Lancet Glob Health, 2018, 6(5): e555-e567. DOI:10.1016/S2214-109X(18)30127-X |
| [4] |
冯颖, 吴成亚, 李杰. 中医药治疗胃癌的优势及可能机制研究进展[J]. 辽宁中医杂志, 2017, 44(1): 200-203. DOI:10.13192/j.issn.1000-1719.2017.01.068 |
| [5] |
袁向飞, 谢俊木子, 谭晓华. 大黄及其有效成分抗肿瘤的研究进展[J]. 中国中西医结合外科杂志, 2018, 24(3): 363-366. DOI:10.3969/j.issn.1007-6948.2018.03.030 |
| [6] |
张珊珊, 林琦雄, 王明. 大黄抗肿瘤研究进展[J]. 中国中医药现代远程教育, 2021, 19(13): 195-201. DOI:10.3969/j.issn.1672-2779.2021.13.073 |
| [7] |
RU JL, LI P, WANG JN, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform, 2014, 6: 13. DOI:10.1186/1758-2946-6-13 |
| [8] |
SHANNON P, MARKIEL A, OZIER O, et al. Cytoscape: a software environment for integrated models of biomolecular interaction networks[J]. Genome Res, 2003, 13(11): 2498-2504. DOI:10.1101/gr.1239303 |
| [9] |
ZHOU YY, ZHOU B, PACHE L, et al. Metascape provides a biologist-oriented resource for the analysis of systems-level datasets[J]. Nat Commun, 2019, 10(1): 1523. DOI:10.1038/s41467-019-09234-6 |
| [10] |
刘豪杰, 陈文礼, 陈雪蕾. 芦荟大黄素对胃癌SGC-7901细胞凋亡、自噬及p53/AMPK/m TOR信号通路的影响[J]. 中国药师, 2019, 22(10): 1829-1834. DOI:10.3969/j.issn.1008-049X.2019.10.014 |
| [11] |
刘豪杰, 陈文礼, 陈雪蕾. 芦荟大黄素调控Notch-1/Akt/NF-κB信号通路对胃癌SGC-7901细胞生物学行为的影响[J]. 中医学报, 2020, 35(4): 831-836. DOI:10.16368/j.issn.1674-8999.2020.04.185 |
| [12] |
刘豪杰, 陈雪蕾. 芦荟大黄素对胃癌SGC-7901细胞Cav-1/PTEN/PI3K/PKB信号通路及侵袭、转移的影响[J]. 湖南中医药大学学报, 2021, 41(6): 827-831. DOI:10.3969/j.issn.1674-070X.2021.06.002 |
| [13] |
YI HJ, QIU MZ, YUAN LP, et al. Bcl-2/Bcl-xl inhibitor APG-1252-M1 is a promising therapeutic strategy for gastric carcinoma[J]. Cancer Med, 2020, 9(12): 4197-4206. DOI:10.1002/cam4.3090 |
| [14] |
FRITSCH M, GÜNTHER SD, SCHWARZER R, et al. Caspase-8 is the molecular switch for apoptosis, necroptosis and pyroptosis[J]. Nature, 2019, 575(7784): 683-687. DOI:10.1038/s41586-019-1770-6 |
| [15] |
HUANG KH, FANG WL, LI AFY, et al. Caspase-3, a key apoptotic protein, as a prognostic marker in gastric cancer after curative surgery[J]. Int J Surg, 2018, 52: 258-263. DOI:10.1016/j.ijsu.2018.02.055 |
 2023, Vol. 52
2023, Vol. 52