文章信息
- 卢萌, 郑阳, 王晓明
- LU Meng, ZHENG Yang, WANG Xiaoming
- 缺氧缺血性损伤对新生猪脑内钠钾ATP酶及CaMKⅡ表达的影响
- Effects of hypoxic ischemic injury on the expression of Na+, K+-ATPase and CaMKⅡ in the brains of newborn piglets
- 中国医科大学学报, 2022, 51(9): 783-787
- Journal of China Medical University, 2022, 51(9): 783-787
-
文章历史
- 收稿日期:2021-09-13
- 网络出版时间:2022-08-15 10:01
缺氧缺血性脑损伤早期可通过自由基的产生激发炎症或氧化应激反应[1]。缺氧缺血后,活性氧(reactive oxygen species,ROS) 迅速增加,过量的ROS直接作用于细胞大分子,导致级联炎症反应和蛋白酶分泌。这些衍生物参与了多种途径(炎症、凋亡、自噬和坏死) 的复杂相互作用,最终导致脑损伤[2]。
神经细胞中钠钾ATP酶是维持细胞功能必不可少的跨膜蛋白,直接调节并维持细胞内外Na+、K+离子浓度,间接影响Ca2+、Cl-等离子浓度以维持膜电位,对神经元的信号转导及调控具有重大意义[3]。钠钾ATP酶活性改变是缺氧的最早反应,对细胞存活至关重要[4]。钠钾ATP酶还作为细胞信号转导的受体,激活多种信号通路(钠钾ATP酶与Src形成的复合物及其关联的下游多种通路[5]) 介导细胞损伤,并与Beclin-1共同介导神经元凋亡[6]。因此,保持钠钾ATP酶活性对于神经元的功能及存活至关重要。有研究[7]表明,CaMKⅡ作为RIP3等的底物介导心肌缺血和氧化应激诱导的心肌坏死。此外CaMKⅡ与瞬时受体电位M7通道、p38、cofflin等共同介导细胞死亡[8];与钠钾ATP酶相似,CaMKⅡ通过Beclin-1介导细胞凋亡[9]。除此之外,研究[10]显示,脑内CaMKⅡ和N-甲基-D天冬氨酸受体、代谢型谷氨酸受体、α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体等共同参与长时程增强效应的过程,影响大脑学习与记忆的功能。因此推测缺氧缺血性脑病中CaMKⅡ对脑内神经元的存活和功能维持发挥重要作用。本研究通过建立新生猪缺氧缺血性脑损伤模型,探讨缺氧缺血损伤对新生猪脑内钠钾ATP酶、CaMKⅡ表达的影响,旨在为阐明新生儿缺氧缺血性脑损伤后离子转运的调节机制提供依据。
1 材料与方法 1.1 实验动物及分组28头3~5日龄雄性约克夏猪由中国医科大学附属盛京医院动物室提供,体质量1~1.5 kg。随机分为对照组(n = 4) 及模型组((n =24)。模型组根据缺血缺氧时间均分成6个亚组:0~2 h组、2~6 h组;6~12 h组、12~24 h组、24~48 h组、48~72 h组,每组4头。本研究获得医院伦理委员会批准。
1.2 动物模型制备动物模型的制备参照本课题组既往研究[11]。
1.2.1 对照组室温保持在28~30 ℃,于新生猪臀大肌缓慢注入速眠新注射液(0.6 mL/kg) 麻醉。麻醉后观察新生猪生理状态,当新生猪活动度明显减低时,以干净棉签轻触角膜外缘,确定角膜反应迟钝后,将新生猪以仰卧位固定。首先,在喉镜引导下以2.5 mm气管插管对新生猪进行机械通气,通入100%氧气,呼吸机通气参数值设置为呼吸比1∶1.5,呼吸频率30次/min。监测新生猪的心率和血氧饱和度。固定气管插管,对新生猪颈前区及周围皮肤进行消毒,取颈正中切口,逐层分离,将双侧颈总动脉与毗邻的颈内静脉、迷走神经分离,40 min后缝合切口。
1.2.2 模型组麻醉、机械通气及颈总动脉分离操作与对照组相同。随后进行缺氧缺血损伤建立:小动脉夹夹闭双侧颈总动脉(注意避开颈动脉窦),阻断双侧颈动脉血流,与此同时机械通入6%氮氧混合气,持续40 min。随后撤去动脉夹,恢复双侧颈动脉血流,机械通气改为100%氧气,缝合切口。在新生猪恢复自主呼吸后停止机械通气,拔出气管插管。缺氧缺血损伤建立过程中密切监控新生猪生命状态(血氧、心率等)。若术中发现心率明显降低或抽搐等预示新生猪生命状况不良状况应暂时中断手术,及时处理。术后将新生猪转移至35 ℃恒温箱内。
1.3 免疫荧光染色及图像处理对照组在缝合切口后即处死新生猪,模型组各亚组按照缺氧缺血时间(> 0 ~2 h、> 2 ~6 h、> 6~ 12 h、> 12~24 h、> 24~48 h、> 48~72 h) 分别处死新生猪,然后立即取出完整脑组织,置于4%多聚甲醛中固定48 h。将固定后的脑组织冠状切片(4 mm),然后经脱水、二甲苯透明,石腊包埋后切片(4 μm)。随后对切片进行钠钾ATP酶及CaMKⅡ免疫荧光染色,切片脱蜡后对切片进行3次PBS溶液洗涤,每次5 min,随后将切片置入微波炉中柠檬酸盐修复(高火7.5 min,静置30 min),取出切片自然冷却至室温,再次进行5 min×3次PBS溶液洗涤。擦干切片后山羊血清封闭40 min,完成后甩去多余血清。一抗使用PBS稀释;切片分组滴加一抗,完成后4 ℃过夜(16 h);次日取出切片放置30 min使切片恢复至室温。使用PBS溶液洗涤5 min×3次。避光条件下滴加荧光二抗(1∶100),室温状态下孵育4 h。PBS溶液洗涤切片5 min×3次。避光条件下滴加含DAPI的封片液,室温孵育5 min后封片。
每张切片光镜下(400倍) 随机取相互不重叠的4~6个视野,采用NIKON图像采集系统照相。细胞染色呈绿色、DAPI核染色为阳性表达(除外血管内血细胞染色),应用Image J进行免疫荧光染色分析,钠钾ATP酶、CaMKⅡ的表达采用图片阳性面积/图片总面积×100%来表示。表达结果由2位主治医师共同判定。
1.4 统计学分析采用SPSS 22.0软件进行统计学分析,计量资料采用x±s表示。多组间均数比较采用单因素方差分析,组间两两比较采用LSD-t检验,P < 0.05为差异有统计学意义。
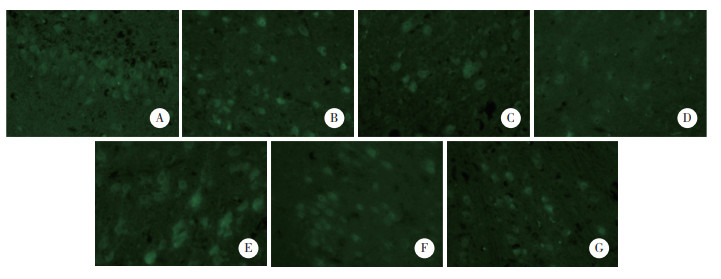
2 结果 2.1 各组钠钾ATP酶表达比较结果显示,各组均见钠钾ATP酶阳性表达,6~12 h组表达水平最低。相邻各组两两比较结果显示,0~2 h组与2~6 h组(P = 0.015)、2~6 h组与6~12 h组(P = 0.008)、6~12 h组与12~24 h组(P < 0.001)、12~24 h组与24~48 h组(P = 0.014) 钠钾ATP酶表达水平比较均有统计学差异。随着时间的推移,缺氧缺血损伤模型新生猪钠钾ATP酶表达呈现先下降后上升然后继续下降的“横S型”趋势。见图 1、表 1。
|
| A, control group; B, 0-2 h group; C, 2-6 h group; D, 6-12 h group; E, 12-24 h group; F, 24-48 h group; G, 48-72 h group. 图 1 各组钠钾ATP酶免疫荧光染色结果×400 Fig.1 Results of Na+, K-+ATPase expression in each group by immunofluorescent staining ×400 |
| Group | Na+,K-+ATPase | CaMKⅡ |
| Control | 11.800±4.403 | 14.471±2.990 |
| 0-2 h group | 11.109±1.511 | 13.245±1.718 |
| 2-6 h group | 7.845±2.053 | 16.517±2.117 |
| 6-12 h group | 3.855±1.024 | 7.553±2.038 |
| 12-24 h group | 13.094±1.803 | 12.636±1.216 |
| 24-48 h group | 9.810±1.146 | 14.033±0.553 |
| 48-72 h group | 7.872±1.016 | 10.720±1.998 |
2.2 各组CaMKⅡ表达水平比较
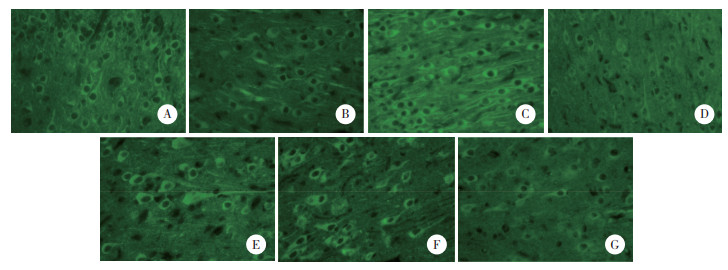
结果显示,各组均见CaMKⅡ阳性表达,6~12 h组降至最低水平。0~2 h组与2~6 h组(P = 0.012)、2~6 h组与6~12 h组(P < 0.001)、6~12 h组与12~24 h组(P < 0.001)、24~48 h组与48~72 h组(P = 0.009) CaMKⅡ表达水平比较均有统计学差异。随着时间的推移,缺氧缺血模型新生猪CaMKⅡ表达呈“双谷双峰”改变,见表 1、图 2。
|
| A, control group; B, 0-2 h group; C, 2-6 h group; D, 6-12 h group; E, 12-24 h group; F, 24-48 h group; G, 48-72 h group. 图 2 各组CaMKⅡ免疫荧光染色结果×400 Fig.2 Results of CaMKⅡ expression in each group by immunofluorescent staining ×400 |
钠钾ATP酶及CaMKⅡ表达水平均在6~12 h组最低,提示在此段时间内脑损伤最重。
3 讨论研究[12]显示,神经系统中神经元膜电位的维持至关重要。钠钾ATP酶失活则离子转运失调[13],可引起膜电位紊乱、细胞肿胀,从而造成神经元功能维持障碍,甚至不可逆地触发细胞凋亡。本研究结果显示,缺氧缺血后钠钾ATP酶表达不是立即下降至最低,而是在缺氧缺血后6~12 h达到最低。目前脑缺氧缺血损伤治疗大多要求在出现缺氧缺血后6 h内进行亚低温治疗[14],但在脑组织开始出现缺氧缺血到机体表现出缺氧缺血症状尚且需要一定时间。本研究结果表明钠钾ATP酶表达在缺氧缺血早期未出现明显下降,如果能在这段时间内发现缺氧缺血并实施治疗,则能更好保护神经元功能。因此需要对如何在更细微的层面上做出诊断进行深入研究[15]。
本研究结果显示,缺氧缺血损伤后12~24 h组钠钾ATP酶表达水平较6~12 h组明显增高(P < 0.05),与对照组钠钾ATP酶表达水平未见明显差异(P > 0.05),提示此时细胞功能恢复,其原因可能是此时血氧再灌注、细胞内蛋白质合成增加所致。而后钠钾ATP酶表达降低,可能是能量不足以支持高水平的物质合成所致,具体原因尚待进一步研究。钠钾ATP酶表达越高则表明细胞活性越高,但是本研究并未区分神经元与神经胶质细胞,无法判断钠钾ATP酶表达升高来自于神经元抑或是胶质细胞,需进一步研究论证。中枢神经系统中可通过不同亚型来区分钠钾ATP酶,α2亚型主要在胶质细胞中表达,α3则具有神经特异性[16]。
本研究结果显示,随着时间的推移,缺氧缺血脑损伤的新生猪CaMKⅡ表达呈“双谷双峰”改变。与对照组比较,缺氧缺血2~6 h组CaMKⅡ表达增高。CaMKⅡ是多个程序性死亡的节点信号[17],缺氧缺血损伤后ROS作为损伤因子之一,在Ca2+激活CaMKⅡ之后进一步增加了CaMKⅡ的活性[18];但同时有研究[19]表明,在缺血再灌注的过程中CaMKⅡ δ亚基的过表达促进了神经元的存活,2~6 h组CaMKⅡ表达呈现出高值,推测是神经元自我保护的表现,可以作为较佳的干预节点。此外,本研究结果显示,12~48 h 2组CaMKⅡ表达逐渐增加,而在48~72 h组CaMKⅡ表达下降,分析其原因可能是新生猪的喂养条件有限,使新生猪糖分、盐分及水分摄入不足所致。
有研究[20]表明,不同时段出生(早产、正常) 的新生儿血管成熟程度、线粒体功能状态不同,意味着缺氧缺血时早产儿的血管调节功能不良,同时早产儿和正常新生儿脑血管分布状况不同,提示应对早产儿进行深入研究。
综上所述,本研究利用免疫荧光来分析新生猪缺氧缺血脑损伤后不同时间钠钾ATP酶及CaMKⅡ的表达,发现钠钾ATP酶表达在缺氧缺血脑损伤后6~12 h内最低,随着时间的推移钠钾ATP酶表达呈“横S型”;CaMKⅡ表达在缺氧缺血脑损伤后2~6 h最高,随着时间的推移CaMKⅡ表达呈“双谷双峰”样改变。本研究对明确缺氧缺血性中枢神经损伤后病理改变具有一定意义,但本研究未对新生猪脑进行分区,且样本量较小,今后应进一步研究论证。
| [1] |
SOLEVÅG AL, SCHMÖLZER GM, CHEUNG PY. Novel interventions to reduce oxidative-stress related brain injury in neonatal asphyxia[J]. Free Radic Biol Med, 2019, 142: 113-122. DOI:10.1016/j.freeradbiomed.2019.04.028 |
| [2] |
ZHAO MY, ZHU P, FUJINO M, et al. Oxidative stress in hypoxic- ischemic encephalopathy: molecular mechanisms and therapeutic strategies[J]. Int J Mol Sci, 2016, 17(12): 2078. DOI:10.3390/ijms17122078 |
| [3] |
CUI XY, XIE ZJ. Protein interaction and Na/K-ATPase-mediated signal transduction[J]. Molecules, 2017, 22(6): 990. DOI:10.3390/molecules22060990 |
| [4] |
LAKUNINA VA, BURNYSHEVA KM, MITKEVICH VA, et al. Changes in the receptor function of Na, K-ATPase during hypoxia and ischemia[J]. Mol Biol (Mosk), 2017, 51(1): 172-179. DOI:10.7868/S0026898417010104 |
| [5] |
NIE Y, BAI F, CHAUDHRY MA, et al. The Na/K-ATPase α1 and c-Src form signaling complex under native condition: a crosslinking approach[J]. Sci Rep, 2020, 10(1): 6006. DOI:10.1038/s41598-020-61920-4 |
| [6] |
FERNÁNDEZ ÁF, LIU Y, GINET V, et al. Interaction between the autophagy protein beclin 1 and Na+, K+-ATPase during starvation, exercise, and ischemia[J]. JCI Insight, 2020, 5(1): e133282. DOI:10.1172/jci.insight.133282 |
| [7] |
ZHANG T, ZHANG Y, CUI MY, et al. CaMKⅡ is a RIP3 substrate mediating ischemia-and oxidative stress-induced myocardial necroptosis[J]. Nat Med, 2016, 22(2): 175-182. DOI:10.1038/nm.4017 |
| [8] |
TURLOVA E, WONG R, XU BF, et al. TRPM7 mediates neuronal cell death upstream of calcium/calmodulin-dependent protein kinase Ⅱ and calcineurin mechanism in neonatal hypoxic-ischemic brain injury[J]. Transl Stroke Res, 2021, 12(1): 164-184. DOI:10.1007/s12975-020-00810-3 |
| [9] |
LI X, WU XQ, DENG R, et al. CaMKⅡ-mediated Beclin 1 phosphorylation regulates autophagy that promotes degradation of Id and neuroblastoma cell differentiation[J]. Nat Commun, 2017, 8(1): 1159. DOI:10.1038/s41467-017-01272-2 |
| [10] |
INCONTRO S, DÍAZ-ALONSO J, IAFRATI J, et al. The CaMKⅡ/NMDA receptor complex controls hippocampal synaptic transmission by kinase-dependent and independent mechanisms[J]. Nat Commun, 2018, 9(1): 2069. DOI:10.1038/s41467-018-04439-7 |
| [11] |
ZHENG Y, WANG XM. Measurement of lactate content and amide proton transfer values in the basal Ganglia of a neonatal piglet hypoxic-ischemic brain injury model using MRI[J]. AJNR Am J Neuroradiol, 2017, 38(4): 827-834. DOI:10.3174/ajnr.A5066 |
| [12] |
GRIDER MH, JESSU R, GLAUBENSKLEE CS. Physiology, action potential[M]. Treasure Island (FL): StatPearls Publishing, 2021.
|
| [13] |
PIVOVAROV AS, CALAHORRO F, WALKER RJ. Na +/K +-pump and neurotransmitter membrane receptors[J]. Invert Neurosci, 2018, 19(1): 1. DOI:10.1007/s10158-018-0221-7 |
| [14] |
LAPTOOK AR, SHANKARAN S, TYSON JE, et al. Effect of therapeutic hypothermia initiated after 6 hours of age on death or disability among newborns with hypoxic-ischemic encephalopathy: a randomized clinical trial[J]. JAMA, 2017, 318(16): 1550-1560. DOI:10.1001/jama.2017.14972 |
| [15] |
FINESCHI V, VIOLA RV, LA RUSSA R, et al. A controversial medicolegal issue: timing the onset of perinatal hypoxic-ischemic brain injury[J]. Mediators Inflamm, 2017, 2017: 6024959. DOI:10.1155/2017/6024959 |
| [16] |
HOLM TH, LYKKE-HARTMANN K. Insights into the pathology of the α3 Na+/K+-ATPase ion pump in neurological disorders; lessons from animal models[J]. Front Physiol, 2016, 7: 209. DOI:10.3389/fphys.2016.00209 |
| [17] |
FENG N, ANDERSON ME. CaMKⅡ is a nodal signal for multiple programmed cell death pathways in heart[J]. J Mol Cell Cardiol, 2017, 103: 102-109. DOI:10.1016/j.yjmcc.2016.12.007 |
| [18] |
KRYLATOV AV, MASLOV LN, VORONKOV NS, et al. Reactive oxygen species as intracellular signaling molecules in the cardiovascular system[J]. Curr Cardiol Rev, 2018, 14(4): 290-300. DOI:10.2174/1573403X14666180702152436 |
| [19] |
YE J, DAS S, ROY A, et al. Ischemic injury-induced CaMKⅡδ and CaMKⅡγ confer neuroprotection through the NF-κB signaling pathway[J]. Mol Neurobiol, 2019, 56(3): 2123-2136. DOI:10.1007/s12035-018-1198-2 |
| [20] |
ODORCYK FK, RIBEIRO RT, ROGINSKI AC, et al. Differential age-dependent mitochondrial dysfunction, oxidative stress, and apoptosis induced by neonatal hypoxia-ischemia in the immature rat brain[J]. Mol Neurobiol, 2021, 58(5): 2297-2308. DOI:10.1007/s12035-020-02261-1 |
 2022, Vol. 51
2022, Vol. 51