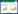文章信息
- 赵楠, 邹丽娟, 苏晗, 薛晖
- ZHAO Nan, ZOU Lijuan, SU Han, XUE Hui
- UBE2T基因对卵巢癌细胞增殖的调控作用及其机制
- Regulation mechanism of UBE2T gene on the proliferation of ovarian cancer cells
- 中国医科大学学报, 2022, 51(8): 725-729
- Journal of China Medical University, 2022, 51(8): 725-729
-
文章历史
- 收稿日期:2022-04-08
- 网络出版时间:2022-07-13 15:09
2. 中国医科大学附属第四医院检验科, 沈阳 110032;
3. 中国医科大学附属盛京医院设备科, 沈阳 110004
2. Clinical Laboratory, The Fourth Affiliated Hospital of China Medical University, Shenyang 110032, China;
3. Equipment Section, Shengjing Hospital of China Medical University, Shenyang 110004, China
卵巢癌是最致命的女性生殖系统恶性肿瘤[1],尽管手术技术、化疗和免疫疗法取得了重大进展,但目前的治疗效果仍不理想[2]。由于卵巢癌缺乏特定的早期症状和有效的早期检测策略,只有不到一半的女性在诊断后存活时间超过5年[3]。因此,迫切需要发现高灵敏度和特异度的生物标志物并阐明其在卵巢癌中的作用。
肿瘤微环境由多种与肿瘤生长相关的细胞和非细胞成分组成,其在肿瘤进展中的作用以及与癌症免疫治疗的相关性已被广泛证明[4]。泛素化相关酶是肿瘤微环境的重要组成部分,这些酶包括泛素激活酶E1、泛素结合酶E2(ubiquitin binding enzyme E2,UBE2)和泛素连接酶E3,它们促进肿瘤细胞泛素化并导致蛋白酶体介导的蛋白质降解[5]。UBE2家族由40个成员组成,它们被认为是泛素化级联反应的关键,并参与各种促肿瘤过程。研究[6]表明,UBE2家族成员可以作为肿瘤诊断和治疗标志物。
肿瘤微环境中,UBE2失调会影响患者的预后和化疗耐药性。最近的研究[7]结果表明,UBE2A、UBE2B和UBE2C上调与卵巢癌患者的不良预后相关。此外,UBE2F、UBE2M和UBE2N的异常表达与卵巢癌中紫杉醇化学抗性有关[8]。同时有研究[9]表明,UBE2S和UBE2V2参与妇科肿瘤的发生和发展,包括乳腺癌。UBE2T是UBE2家族的成员,多项研究证实UBE2T在肝细胞癌、肺癌、乳腺癌、胃癌等多种癌症中具有致癌作用,但其在卵巢癌中的表达水平和调控机制仍不清楚。本研究检测了UBE2T在卵巢癌组织和癌旁组织中的表达,并通过细胞实验探讨其作用机制,从而为卵巢癌的诊断和治疗提供新思路。
1 材料与方法 1.1 材料 1.1.1 标本收集收集2010年1月至2020年12月于中国医科大学附属第一医院妇科行卵巢切除术的52例卵巢癌患者的卵巢癌组织和癌旁组织样本。患者年龄35~73岁,平均61.4岁;临床分期按1997年国际抗癌联盟TNM分期,Ⅰ期20例,Ⅱ期32例;有淋巴结转移29例,无淋巴结转移23例。所有患者术前均未接受放化疗。本研究获得中国医科大学附属第一医院伦理委员会批准。
1.1.2 细胞系人卵巢癌细胞SKOV3购自中国科学院上海生命科学研究院细胞资源中心。
1.1.3 主要试剂McCoy’s 5A培养基(美国Gibco公司);胎牛血清(天津市灏洋生物制品科技有限责任公司);TRIzol试剂、Lipofectamine2000、cDNA-UBE2T和阴性对照(美国Invitrogen公司);PrimeScript逆转录试剂盒、SYBR PCR Master Mix(宝生物工程有限公司);MTT试剂(美国Sigma公司);RIPA裂解液、BCA蛋白浓度测定试剂盒、化学发光试剂盒(上海碧云天生物技术有限公司);PVDF膜(美国Millipore公司);UBE2T、GAPDH抗体、HRP标记二抗(武汉博士德生物工程有限公司)。
1.2 方法 1.2.1 生物信息学分析基因表达谱交互分析(Gene Expression Profiling Interactive Analysis,GEPIA)是来自癌症基因组图谱(The Cancer Genome Atlas,TCGA)和基因型-组织表达数据库(Genotype-tissue Expre- ssion dataset,GTEx)的RNA测序表达数据的数据库,包括33种肿瘤类型、9 736个肿瘤样本和超过8 726个正常样本。检索GEPIA数据库,获得426例卵巢癌组织和88例正常组织的生物学信息,在mRNA水平比较UBE2T在癌组织和正常组织中的表达差异。
1.2.2 细胞培养和转染采用10% FACS的McCoy’s 5A完全培养基进行SKOV3细胞培养,在37 ℃、5%CO2培养箱内进行培养和传代。参照Lipofectamine 2000说明书转染cDNA-UBE2T,诱导UBE2T过表达。
1.2.3 细胞分组将SKOV3细胞分为阴性转染组(NC组)和UBE2T过表达转染组(cDNA-UBE2T组),分别转染阴性质粒和cDNA-UBE2T质粒。
1.2.4 实时荧光定量PCR(real-time fluorescent quantitative PCR,qRT-PCR)采用TRIzol试剂提取细胞内总RNA,逆转录获取cDNA后进行qRT-PCR,定量分析采用2-ΔΔCt法,选取GAPDH为内参,目的基因和内参扩增产物荧光强度比值代表目的基因相对表达水平,实验重复3次,H2O作为阴性对照。根据试剂盒说明书要求的体系(5 µL 2× SYBR,0.2 µL上游引物,0.2 µL下游引物,0.2 µL ROX,1 µL cDNA,3.4 µL DEPC水),进行PCR检测。扩增条件:95 ℃预变性15 min,94 ℃变性30 s,退火30 s,72 ℃延伸30 s,40个循环。引物序列:UBE2T,正向5’- GGCAAGATAAAGAC CAAATGGA-3’,反向5’-CCTACTAGCTGACTGGCC TT-3’;GAPDH,正向5’-ATCACTGCCACCCAGAAG ACT-3’,反向5’-CTGTTGAAGTCAGAGGAGACCA C-3’。
1.2.5 Western blotting将转染和未转染UBE2T的细胞培养48 h后,使用RIPA裂解液充分裂解细胞,高速低温离心后收集上清液,并用BCA蛋白浓度测定试剂盒测定蛋白浓度。配置10% SDS-PAGE凝胶,取45 μg变性蛋白样品上样,于110 V电压下电泳75 min。利用湿转法将蛋白转印在PVDF膜上,将膜置于3%牛血清白蛋白中室温下封闭60 min。随后,4 ℃下与一抗(1∶1 000稀释)孵育16 h,TBST清洗3次后,再与二抗(1∶10 000稀释)室温孵育1 h,发光显色以检测目标蛋白的表达。
1.2.6 MTT法检测细胞增殖细胞以6×103/孔密度在96孔板中铺板,培养24、48、72、96 h后,加入MTT(5 mg/mL),随后溶于DMSO(100 μL/孔),酶标仪检测吸光度值,波长490 nm,实验重复3次。
1.2.7 彗星实验(单细胞凝胶电泳)测定细胞DNA损伤断裂情况破坏细胞膜、细胞核后,将细胞与低熔点琼脂糖充分混合,铺于载玻片上。凝固后裂解、解螺旋、电泳。2.5 mmol/L碘化丙啶染色后,荧光显微镜下观察并拍照,用CASP1.01软件分析处理。
1.3 统计学分析采用GraphPad 7.0软件进行统计分析。计量资料以x±s表示,2组比较采用Student t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 UBE2T在卵巢癌组织中的表达通过GEPIA网站分析TCGA和GTEx两个数据库中卵巢癌组织和正常组织的基因表达(|log2FC| > 1,卵巢癌组织426例,正常组织88例),结果显示,卵巢癌组织中UBE2T mRNA的表达量明显高于正常组织(P < 0.01)。见图 1。
|
| A, UBE2T expression profile across all tumor and normal tissues, and each dot represents the expression level of the gene in the sample; B, the boxplots indicate UBE2T expression level in 426 ovarian cancer tissues and 88 normal tissues. *P < 0.01. 图 1 GEPIA网站分析卵巢癌组织和正常组织中UBE2T的表达水平 Fig.1 UBE2T expression in ovarian cancer and normal tissues analyzed in the GEPIA website |
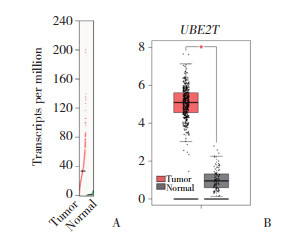
通过qRT-PCR检测UBE2T在52对卵巢癌组织和癌旁组织的差异表达,结果显示,卵巢癌组织中UBE2T mRNA的表达水平明显高于癌旁组织(P < 0.05)。见图 2。
|
| *P < 0.05 vs adjacent tissues. 图 2 qRT-PCR检测卵巢癌组织和癌旁组织中UBE2T的表达水平 Fig.2 UBE2T expression in ovarian cancer and adjacent tissues detected by qRT-PCR |
2.2 UBE2T过表达后SKOV3细胞增殖能力增加
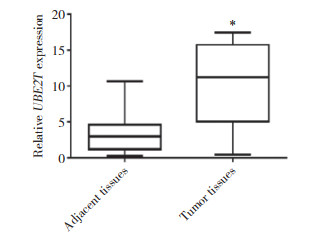
上述结果提示,UBE2T可能具有癌基因作用,因此进行体外细胞实验确认。将cDNA-UBE2T质粒转染入SKOV3细胞中,Western blotting结果显示,与阴性对照组比较,细胞转染cDNA-UBE2T后,UBE2T表达明显增加(图 3A),表明UBE2T高表达细胞模型成功建立。采用MTT法检测卵巢癌细胞增殖水平的变化,结果表明,UBE2T基因过表达可使SKOV3细胞增殖活性增加(图 3B),提示UBE2T促卵巢癌作用与其对细胞增殖的影响有关。
|
| A, expression of UBE2T protein detected by Western blotting; B, cell proliferation detected by MTT assay. * P < 0.05 vs NC group. 图 3 UBE2T过表达对SKOV3细胞增殖的影响 Fig.3 Effect of UBE2T overexpression on the proliferation of SKOV3 cells |
2.3 UBE2T过表达后可抑制SKOV3细胞FA/BRCA通路活化
UBE2T可作为FA/BRCA通路重要成员参与DNA损伤修复,为了初步探讨UBE2T促进卵巢癌细胞增殖的分子机制,采用Western blotting检测FA/BRCA通路关键蛋白FANCF和FANCD2表达的变化。结果发现,UBE2T过表达后,SKOV3细胞中FANCF和FANCD2蛋白表达均增加(图 4),提示UBE2T可能通过影响FA/BRCA通路活性表达调控细胞增殖。

|
| A, expression of FANCF and FANCD2 proteins detected by Western blotting; B, statistical analysis of the results of Western blotting. * P < 0.05 vs NC group. 图 4 UBE2T过表达对SKOV3细胞中FANCF和FANCD2蛋白表达的影响 Fig.4 Effect of UBE2T overexpression on the expression of FANCF and FANCD2 proteins in SKOV3 cells |
2.4 UBE2T过表达后可抑制SKOV3细胞DNA损伤
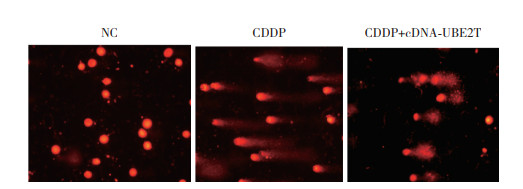
上述结果提示,UBE2T过表达后可促进SKOV3细胞FA/BRCA通路活化,进一步给予化疗药物顺铂(CDDP组)处理SKOV3细胞,通过彗星实验检测DNA损伤。与阴性对照组(NC组)相比,CDDP组拖尾长度增加,UBE2T过表达后(CDDP+cDNA-UBE2T组)SKOV3细胞拖尾长度明显减少。见图 5。
|
| 图 5 彗星实验检测UBE2T过表达对卵巢癌细胞DNA损伤情况的影响 Fig.5 Effect of UBE2T overexpression on DNA fragmentation in ovarian cancer cells detected by comet assay |
3 讨论
在全世界范围内,卵巢癌是每年死亡人数最多的妇科癌症。尽管在过去几十年中,卵巢癌的治疗取得了重大进展,但其复发率仍然很高。目前,卵巢癌的治疗旨在延缓疾病进展,并延长每次化疗间的时间间隔,使患者推迟并避免与进一步化疗相关的毒性反应。因此,越来越多的研究人员致力于寻找与卵巢癌相关的生物标志物,进而探索潜在的治疗靶点。
研究[10]表明,UBE2T(又称HSPC150)是泛素-蛋白酶体途径的E2家族成员,位于染色体1q32.1,UBE2T泛素化FANCD2并诱导DNA损伤反应,DNA损伤反应在范科尼贫血通路中起重要作用。UBE2结合酶在各种肿瘤的形成和进展中起核心作用。研究[11]表明,UBE2T在肝癌、结直肠癌等癌症中表达显著上调,UBE2T通过p53泛素化促进肝癌和结直肠癌细胞生长。UBE2T通过诱导上皮-间质转化和泛素化介导的FOXO1降解,促进非小细胞肺癌的抗辐射能力[12],但其在卵巢癌中的作用尚不清楚。本研究结果提示,UBE2T在卵巢癌组织中的表达水平明显高于癌旁组织,并通过细胞实验进一步验证了卵巢癌细胞过表达UBE2T后细胞增殖活性增加,提示其可能发挥促癌作用。
UBE2T发挥促癌作用的分子机制目前尚未完全阐明。最新的研究[13]发现,一种新的UBE2T抑制剂通过阻断RACK1泛素化,抑制Wnt/β-catenin信号通路的过度激活和胃癌进展。研究[14]报道,UBE2T可作为FA/BRCA通路重要成员参与DNA损伤修复,正常情况下DNA损伤后可激活FA/BRCA通路,泛素激活酶E1将泛素分子传递UBE2T,UBE2T将泛素分子传递给FA/BRCA通路核心复合体(FANCA、FANCB、FANCC、FANCE、FANCF、FANCG、FANCL和FANCM);核心复合体将泛素分子传递给FANCD2,诱导FANCD2单泛素化,进而向细胞核DNA损伤点聚集,促进DNA损伤修复,维持基因组完整性。本研究发现,UBE2T过表达可诱导DNA损伤修复FA/BRCA通路关键蛋白FANCF和FANCD2表达增加,提示FA/BRCA通路途径可能是UBE2T在卵巢癌中发挥促癌作用的重要机制之一。本课题组后续将开展该靶点的药物设计,为卵巢癌的治疗提供新的化合物。
综上所述,本研究结果表明,UBE2T是调控卵巢癌细胞增殖的重要基因,其作用机制可能与对DNA损伤修复通路FA/BRCA的调控作用有关。
| [1] |
SIEGEL RL, MILLER KD, FUCHS HE, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. DOI:10.3322/caac.21654 |
| [2] |
ROTTMANN M, BURGES A, MAHNER S, et al. Cancer of the ovary, fallopian tube, and peritoneum: a population-based comparison of the prognostic factors and outcomes[J]. J Cancer Res Clin Oncol, 2017, 143(9): 1833-1844. DOI:10.1007/s00432-017-2422-6 |
| [3] |
TORRE LA, TRABERT B, DESANTIS CE, et al. Ovarian cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(4): 284-296. DOI:10.3322/caac.21456 |
| [4] |
HINSHAW DC, SHEVDE LA. The tumor microenvironment innately modulates cancer progression[J]. Cancer Res, 2019, 79(18): 4557-4566. DOI:10.1158/0008-5472.CAN-18-3962 |
| [5] |
CLAGUE MJ, HERIDE C, URBÉ S. The demographics of the ubi- quitin system[J]. Trends Cell Biol, 2015, 25(7): 417-426. DOI:10.1016/j.tcb.2015.03.002 |
| [6] |
HOSSEINI SM, OKOYE I, CHALESHTARI MG, et al. E2 ubiquitin- conjugating enzymes in cancer: implications for immunotherapeutic interventions[J]. Clin Chim Acta, 2019, 498: 126-134. DOI:10.1016/j.cca.2019.08.020 |
| [7] |
GONG Y, WANG D, LIN L, et al. The expression of ubiquitin-conjugating enzyme E2C and KAI1 in ovarian carcinoma and their clinical significance[J]. Medicine, 2019, 98(46): e17896. DOI:10.1097/MD.0000000000017896 |
| [8] |
ZHANG X, FENG Y, WANG XY, et al. The inhibition of UBC13 expression and blockage of the DNMT1-CHFR-Aurora A pathway contribute to paclitaxel resistance in ovarian cancer[J]. Cell Death Dis, 2018, 9(2): 93. DOI:10.1038/s41419-017-0137-x |
| [9] |
AYESHA AK, HYODO T, ASANO E, et al. UBE2S is associated with malignant characteristics of breast cancer cells[J]. Tumour Biol, 2016, 37(1): 763-772. DOI:10.1007/s13277-015-3863-7 |
| [10] |
魏震, 苌婉梅, 郭小雨, 等. UBE2C在结直肠癌中的研究现状与进展[J]. 现代肿瘤医学, 2019, 27(4): 677-680. DOI:10.3969/j.issn.1672-4992.2019.04.037 |
| [11] |
WU M, LI X, HUANG W, et al. Ubiquitin-conjugating enzyme E2T (UBE2T) promotes colorectal cancer progression by facilitating ubiquitination and degradation of p53[J]. Clin Res Hepatol Gastroenterol, 2021, 45(2): 101493. DOI:10.1016/j.clinre.2020.06.018 |
| [12] |
YIN H, WANG X, ZHANG X, et al. UBE2T promotes radiation resistance in non-small cell lung cancer via inducing epithelial- mesenchymal transition and the ubiquitination-mediated FOXO1 degradation[J]. Cancer Lett, 2020, 494: 121-131. DOI:10.1016/j.canlet.2020.06.005 |
| [13] |
YU Z, JIANG X, QIN L, et al. A novel UBE2T inhibitor suppresses Wnt/β-catenin signaling hyperactivation and gastric cancer progression by blocking RACK1 ubiquitination[J]. Oncogene, 2021, 40(5): 1027-1042. DOI:10.1038/s41388-020-01572-w |
| [14] |
CAI MY, DUNN CE, CHEN W, et al. Cooperation of the ATM and Fanconi anemia/BRCA pathways in double-strand break end resection[J]. Cell Rep, 2020, 30(7): 2402-2415.e5. DOI:10.1016/j.celrep.2020.01.052 |
 2022, Vol. 51
2022, Vol. 51