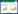文章信息
- 王鑫磊, 冯博
- WANG Xinlei, FENG Bo
- 喜树碱在肝动脉化疗栓塞术中的作用及其机制
- Effect and mechanism of camptothecin on hepatic arterial chemoembolization
- 中国医科大学学报, 2022, 51(8): 716-720
- Journal of China Medical University, 2022, 51(8): 716-720
-
文章历史
- 收稿日期:2021-12-18
- 网络出版时间:2022-07-13 13:27
肝动脉化疗栓塞术是无法手术切除的Ⅰb~Ⅲa期肝癌患者的首选治疗方案。但术中注入的化疗药物耐药问题一直未能解决,导致患者多次行肝动脉化疗栓塞术后疗效不佳。因此,寻找化疗药物增敏剂成为目前研究的热点。以往研究[1]已经证明喜树碱可以作为有效的化疗增敏剂来增强肝癌对化疗的敏感性。喜树碱在肝动脉化疗栓塞术中的应用情况鲜有报道。NRF2是评价肿瘤细胞化疗敏感性指标,与肿瘤细胞对化疗的敏感性呈负相关;Ki-67是评价肿瘤细胞增殖活跃程度指标,与肿瘤细胞增殖活性正相关[1]。本研究在建立兔VX2肝癌模型并进行肝动脉化疗栓塞术的基础上,检测其肝功能及NRF2、Ki-67的表达情况,探讨喜树碱在肝动脉化疗栓塞术中的作用及其机制。
1 材料与方法 1.1 实验动物及试剂家兔,雌雄不限,体质量约2.5 kg,购自辽宁长生生物技术股份有限公司。兔VX2瘤株购自通派(上海)生物科技有限公司,喜树碱(20 mg/支)购自上海阿拉丁生化科技股份有限公司,阿霉素购自辉瑞制药有限公司,NRF2、ki-67免疫组化试剂盒均购自碧云天生物科技有限公司。
1.2 兔VX2肝癌模型建立及分组将储存于-80 ℃冰箱中的兔VX2瘤株水浴箱中解冻,然后使用眼科剪、刀片等器械将瘤株切成约1 mm3体积,使用注射器将切好的瘤株与少量生理盐水混合后,注射于家兔后腿肌群中,10 d后肿瘤生长至1 cm3左右时处死家兔,将肿瘤整体取出并去除多余筋膜等组织。使用眼科剪、刀片等手术器械切取肿瘤活性部分,并将活性肿瘤切成直径约2~3 mm瘤块。家兔使用速眠新及戊巴比妥钠全身麻醉后腹白线开腹,直视条件下将处理好的瘤块种植于肝脏内约1 cm深处,使用组织胶封堵肝脏创口,缝合开腹部位。3 d后MRI(1.5T,日本西门子公司)扫描确认肿瘤种植成功即模型建立成功。将肿瘤种植成功的家兔随机分为4组:单纯栓塞组(A组)、栓塞联合喜树碱组(B组)、栓塞联合阿霉素组(C组)、栓塞联合喜树碱与阿霉素组(D组),每组6只。
1.3 肝动脉栓塞术家兔静脉注射苯巴比妥(30 mg/kg)进行全身麻醉。5%硫化钠涂抹于右腹股沟区脱毛后将兔四肢外展固定于手术台上,在右侧腹股沟区股动脉搏动最强处使用柳叶刀片纵行切开(约2~3 mm),钝性分离出股动脉。直视下使用20G动脉穿刺针及穿刺鞘沿股动脉走形方向逆行穿刺进股动脉。见针尾有鲜红动脉血喷出后推进穿刺鞘拔出穿刺针。从穿刺鞘内送入0.018微导管及微导丝,于动物专用数字减影血管造影系统(日本西门子公司)下经股动脉、髂动脉进入腹主动脉胸腰椎交界处水平,见“嵌入”现象即为兔腹腔动脉开口处。在数字减影血管造影系统透视下沿微导管注入造影剂进行造影,可清晰显示肝内血管走形及微弱肿瘤染色。尽可能将微导管超选择进入肿瘤供血血管,对各组家兔进行肿瘤供血动脉碘油栓塞(栓塞终点为再次造影提示靶血管血流中断且肿瘤染色消失)及药物灌注。A组仅进行肿瘤供血动脉栓塞;B组在肿瘤供血动脉栓塞时进行喜树碱(2 mg/kg)灌注;C组在肿瘤供血动脉栓塞时进行阿霉素(1 mg/kg)灌注,D组在肿瘤供血动脉栓塞时进行喜树碱(2 mg/kg)、阿霉素(1 mg/kg)灌注。手术完成后拔管并用明胶海绵条填塞穿刺点周围,压迫止血5~10 min,无明显大出血后缝合切口。家兔均肌肉注射青霉素(80万U)预防感染并加强清洁护理。
1.4 肝功能及肿瘤生长检测分别于肝动脉栓塞术术前1 d、术后3、7 d获取家兔血清,利用日立7600系列全自动生化分析仪检测肝功能指标[谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)]。分别于术前1 d、术后7 d使用1.5T MRI检查肝肿瘤体积,测量肿瘤最大截面的长径(L)和短径(W),计算肿瘤体积(V):V= π/6×L×W2。肿瘤生长率=术后肿瘤体积/术前肿瘤体积×100%。
1.5 HE染色于术后7 d处死家兔,取出肝脏组织,切成1 cm3左右的组织块,4%多聚甲醛固定,石蜡包埋后切片(4 μm)。将石蜡切片进行HE染色,在光学显微镜下观察肿瘤的细胞形态。
1.6 免疫组化检测ki-67、NRF2表达将固定好的肿瘤石蜡标本切片脱蜡、水化后,PBS冲洗3次,每次3 min,根据抗体要求修复组织抗原,固定切片,切片滴加过氧化酶,室温下孵育10 min。PBS冲洗后加入免疫染色封闭液封闭60 min。吸尽封闭液后立即加入一抗(1∶200),室温孵育1 h。加入免疫染色洗涤液洗涤3次。加入二抗(1∶500)室温孵育1 h。然后加入免疫染色洗涤液洗涤3次。复染后显微镜观察。利用IHC Profiler插件对染色情况进行自动化评分;Trainable Weka Segmentation插件分别计数阳性细胞和阴性细胞。利用ImageJ采集图像并分析。
1.7 统计学分析利用SPSS 20.0软件对数据进行统计分析。计量资料采用x±s表示,组间比较采用t检验或方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 各组肝动脉栓塞术术前及术后肝功能指标比较结果显示,4组术前ALT及AST均约为50 U/L(正常参考值上限)。A组术后3 d、7 d时ALT及AST水平与术前比较无统计学差异(P > 0.05)。B组术后3 d、7 d时ALT及AST水平高于术前(P < 0.05)。C组、D组术后3 d时ALT及AST水平均升高(约参考值上限的2~3倍),术后7 d下降(约参考值上限2倍以下),与术前比较均有统计学差异(均P < 0.05)。见图 1。
|
| A, ALT; B, AST. *P < 0.05 compared with the same group before operation. 图 1 各组肝动脉栓塞术术前及术后ALT、AST水平比较 Fig.1 Comparison of ALT and AST levels before and after hepatic artery embolization |
2.2 各组肿瘤生长率
结果显示,A、B、C、D组肿瘤生长率分别为(599.29 ±196.85)%、(421.66±267.38)%、(208.54± 131.42)%、(93.04±60.40)%。与A组比较,C、D组肿瘤生长率均降低(P < 0.01),而D组降低更显著(P < 0.001)。
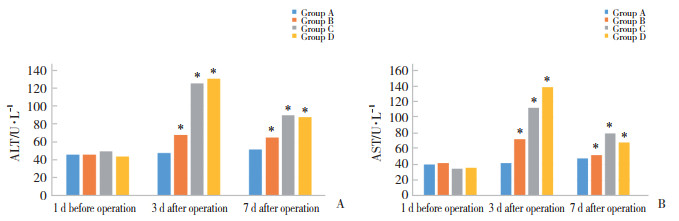
2.3 各组HE染色结果结果显示,A组肿瘤细胞核质比高,核分裂易见,细胞增殖旺盛;B组肿瘤细胞核质比高,核分裂易见,伴有弥散的淋巴细胞浸润;C组肿瘤细胞全部坏死,周围可见大面积增生的结缔组织,伴有较少的淋巴细胞浸润,并可见局部有胆管增生;D组肿瘤细胞核质比高,局部可见大量肿瘤细胞坏死,组织中可见大面积结缔组织增生,伴有弥散的淋巴细胞浸润,见图 2。
|
| A, group A; B, group B; C, group C; D, group D. 图 2 各组HE染色结果×200 Fig.2 The results of HE staining in each group ×200 |
2.4 各组Ki-67、NRF2蛋白表达比较
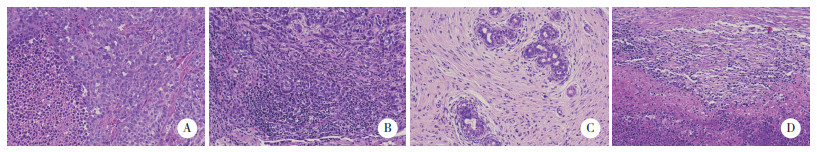
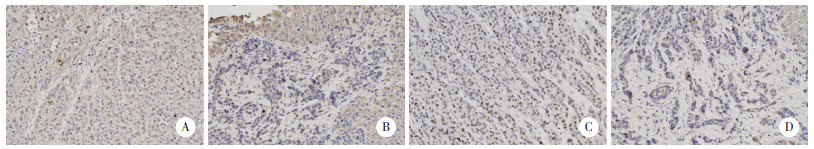
结果显示,与A组比较,B、C、D组Ki-67表达均降低(P < 0.01);与B、C组比较,D组Ki-67表达明显降低(P < 0.001)。与A组、C组比较,B组、D组NRF2表达显著降低(P < 0.001),而其他组间比较差异无统计学意义(均P > 0.05)。见表 1、图 3、图 4。
| Group | Ki-67(%) | NRF2 |
| A | 118.33±10.08 | 123.83±17.54 |
| B | 95.83±3.441) | 31.33±6.872) |
| C | 67.00±8.291) | 97.67±6.29 |
| D | 16.00±7.922),3) | 23.83±6.362),4) |
| 1)P < 0.01 vs group A;2) P < 0.001 vs group A;3)P < 0.001 vs groups B and C;4)P < 0.001 vs group C. | ||
|
| A, group A; B, group B; C, group C; D, group D. 图 3 各组ki-67蛋白表达水平比较 ×200 Fig.3 Comparison of ki-67 protein expression in each group ×200 |
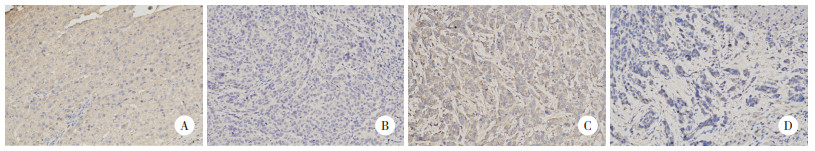
|
| A, group A; B, group B; C, group C; D, group D. 图 4 各组NRF2蛋白表达比较 ×200 Fig.4 Comparison of NRF2 protein expression in each group ×200 |
3 讨论
化疗药物的耐药问题一直是肿瘤治疗的主要障碍。目前已经确定了多种机制,包括药物代谢、DNA修复增强和癌细胞凋亡减少等[2-5],研究[6]显示大部分机制中均有NRF2参与。根据全外显子组测序研究[7-9]显示,NFE2L2(NRF2,6.4%)或KEAP1(8%)基因在人类肝癌中发生突变;这些突变改变KEAP1和NRF2之间的相互作用,并导致NRF2处于持续激活状态[10-11]。此外,这些突变往往发生在晚期肝癌中,表明NRF2过度激活可能会导致肝细胞性肝癌进展[9, 12]。除了KEAP1和NFE2L2突变,p62增加与肝癌中NRF2激活增强呈正相关[13-14]。已有研究[15]证实,p62引起的NRF2持续激活参与了人类肝癌对索拉非尼和顺铂的耐药。因此,NRF2是解决癌症治疗中化疗药物耐药的重要标靶。
喜树碱是从中药植物喜树碱中分离出来的天然生物碱,是新型的NRF2-ARE激活抑制剂,与其他已知的NRF2-ARE抑制剂(异烟肼、乙酰胺)比较,喜树碱具有在较低浓度下即有效的优势。因此被认为是一种有效的抗肿瘤药物,已应用于治疗多种肿瘤(结肠癌、胃癌等)[16]。临床应用中喜树碱一直受到溶解性差(水中为3.122 mmol/L)、腹泻、出血性膀胱炎和骨髓抑制等不良反应的限制[17]。目前研究[1]表明,喜树碱是有效的NRF2抑制剂,在肝动脉化疗栓塞术中使用时的浓度远低于作为直接抗肿瘤药物的浓度。药物剂量更小且直接作用于肿瘤瘤体内,不但能显著降低不良反应,而且增加肿瘤对化疗药物的敏感性。与传统肝动脉化疗栓塞术比较,加入喜树碱时治疗效果更佳。
本研究结果显示,A组术后ALT、AST未出现明显升高,B组、C组、D组术后ALT、AST升高之后随后下降,4组均未出现严重不可逆的肝功能异常。HE染色结果显示,D组肿瘤细胞不仅大量坏死,且伴有弥漫淋巴细胞浸润,B组肿瘤细胞也伴有大量淋巴细胞浸润,B组与D组在术中均使用喜树碱,2组均出现大量的淋巴细胞浸润,可能与喜树碱增加了细胞毒性T淋巴细胞反应,从而增强机体对肿瘤的免疫反应相关[18]。本研究结果显示D组肿瘤生长率最低;而且Ki-67表达也最低,这说明在传统的栓塞联合阿霉素的治疗中加入喜树碱可以更好抑制肿瘤生长。另外发现使用喜树碱的B组、D组NRF2表达与A组比较明显降低(P < 0.001),说明喜树碱对肿瘤的抑制与NRF2表达相关。
综上所述,喜树碱可明显提高兔VX2肝癌模型肝动脉化疗栓塞术的治疗效果,其作用可能是通过抑制NRF2表达来实现的。本研究仅为动物实验,将喜树碱作为解决肝癌化疗药物耐药的新的治疗方法仍需要进一步研究。
| [1] |
CHEN F, WANG HH, ZHU JY, et al. Camptothecin suppresses NRF2-ARE activity and sensitises hepatocellular carcinoma cells to anticancer drugs[J]. Br J Cancer, 2017, 117: 1495-1506. DOI:10.1038/bjc.2017.317 |
| [2] |
BUKOWSKI K, KCIUK M, KONTEK R. Mechanisms of multidrug resistance in cancer chemotherapy[J]. Int J Mol Sci, 2020, 21(9): 3233. DOI:10.3390/ijms21093233 |
| [3] |
ASSARAF YG, BROZOVIC A, GONÇALVES AC, et al. The multifactorial nature of clinical multidrug resistance in cancer[J]. Drug Resist Updat, 2019, 46: 100645. DOI:10.1016/j.drup.2019.100645 |
| [4] |
GAO AM, KE ZP, SHI F, et al. Chrysin enhances sensitivity of BEL-7402/ADM cells to doxorubicin by suppressing PI3K/Akt/Nrf2 and ERK/Nrf2 pathway[J]. Chem Biol Interact, 2013, 206(1): 100-108. DOI:10.1016/j.cbi.2013.08.008 |
| [5] |
TEBAY LE, ROBERTSON H, DURANT ST, et al. Mechanisms of activation of the transcription factor Nrf2 by redox stressors, nutrient cues, and energy status and the pathways through which it attenuates degenerative disease[J]. Free Radic Biol Med, 2015, 88(Pt B): 108-146. DOI:10.1016/j.freeradbiomed.2015.06.021 |
| [6] |
HU XF, YAO J, GAO SG, et al. Nrf2 overexpression predicts prognosis and 5-FU resistance in gastric cancer[J]. Asian Pac J Cancer Prev, 2013, 14(9): 5231-5235. DOI:10.7314/apjcp.2013.14.9.5231 |
| [7] |
GUICHARD C, AMADDEO G, IMBEAUD S, et al. Integrated analysis of somatic mutations and focal copy-number changes identifies key genes and pathways in hepatocellular carcinoma[J]. Nat Genet, 2012, 44(6): 694-698. DOI:10.1038/ng.2256 |
| [8] |
CLEARY SP, JECK WR, ZHAO XB, et al. Identification of driver genes in hepatocellular carcinoma by exome sequencing[J]. Hepatology, 2013, 58(5): 1693-1702. DOI:10.1002/hep.26540 |
| [9] |
SCHULZE K, IMBEAUD S, LETOUZÉ E, et al. Exome sequencing of hepatocellular carcinomas identifies new mutational signatures and potential therapeutic targets[J]. Nat Genet, 2015, 47(5): 505-511. DOI:10.1038/ng.3252 |
| [10] |
SPORN MB, LIBY KT. NRF2 and cancer: the good, the bad and the importance of context[J]. Nat Rev Cancer, 2012, 12(8): 564-571. DOI:10.1038/nrc3278 |
| [11] |
GAÑÁN-GÓMEZ I, WEI Y, YANG H, et al. Oncogenic functions of the transcription factor Nrf2[J]. Free Radic Biol Med, 2013, 65: 750-764. DOI:10.1016/j.freeradbiomed.2013.06.041 |
| [12] |
NAULT JC, CALDERARO J, DI TOMMASO L, et al. Telomerase reverse transcriptase promoter mutation is an early somatic genetic alteration in the transformation of premalignant nodules in hepatocellular carcinoma on cirrhosis[J]. Hepatology, 2014, 60(6): 1983-1992. DOI:10.1002/hep.27372 |
| [13] |
INAMI Y, WAGURI S, SAKAMOTO A, et al. Persistent activation of Nrf2 through p62 in hepatocellular carcinoma cells[J]. J Cell Biol, 2011, 193(2): 275-284. DOI:10.1083/jcb.201102031 |
| [14] |
ICHIMURA Y, WAGURI S, SOU YS, et al. Phosphorylation of p62 activates the Keap1-Nrf2 pathway during selective autophagy[J]. Mol Cell, 2013, 51(5): 618-631. DOI:10.1016/j.molcel.2013.08.003 |
| [15] |
SAITO T, ICHIMURA Y, TAGUCHI K, et al. p62/Sqstm1 promotes malignancy of HCV-positive hepatocellular carcinoma through Nrf2-dependent metabolic reprogramming[J]. Nat Commun, 2016, 7: 12030. DOI:10.1038/ncomms12030 |
| [16] |
KOBAYASHI K, MORITA M, FUKUI S, et al. S-1 and CPT-11 plus ramucirumab (IRIS+Rmab) as second-line chemotherapy for patients with oxaliplatin-refractory metastatic colorectal cancer (mCRC): a multicenter phase II study in Japan (N-DOCC-F-C-1701)[J]. Kurume Med J, 2020, 66(1): 43-47. DOI:10.2739/kurumemedj.MS661007 |
| [17] |
TANG XJ, HAN M, YANG B, et al. Nanocarrier improves the bioavailability, stability and antitumor activity of camptothecin[J]. Int J Pharm, 2014, 477(1-2): 536-545. DOI:10.1016/j.ijpharm.2014.10.054 |
| [18] |
CHEN YF, WANG YH, LEI CS, et al. Host immune response to anticancer camptothecin conjugated cyclodextrin-based polymers[J]. J Biomed Sci, 2019, 26(1): 85. DOI:10.1186/s12929-019-0583-0 |
 2022, Vol. 51
2022, Vol. 51