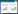文章信息
- 刘力源, 徐雁龙
- LIU Liyuan, XU Yanlong
- 己糖激酶-3在乳头状肾细胞癌组织中的表达及其预后的影响
- Expression of hexokinase 3 in papillary renal cell carcinoma and its effect on prognosis
- 中国医科大学学报, 2022, 51(7): 617-621
- Journal of China Medical University, 2022, 51(7): 617-621
-
文章历史
- 收稿日期:2022-04-02
- 网络出版时间:2022-06-21 15:36
肾细胞癌(renal cell carcinoma,RCC) 是泌尿系统常见的恶性肿瘤。RCC的发病率和死亡率逐年上升,预计到2040年将有超过30万人因该病死亡[1]。乳头状肾细胞癌(papillary renal cell carcinoma,pRCC) 是RCC第二大亚型,仅次于肾透明细胞癌,约占RCC的15%~20%[2]。pRCC的治疗一直以肾透明细胞癌为参考,然而,肾癌的每个亚型在预后和治疗方面都有其特异性[3],因此,研究pRCC患者肿瘤标志物具有重要的临床意义。
己糖激酶(hexokinase,HK) 家族催化葡萄糖转化为葡萄糖-6-磷酸是细胞代谢的第一步,也是限速步骤,哺乳动物组织中有4种HK,分别为HK1、HK2、HK3和HK4[4]。研究[5]表明,HK1和HK2在乳腺癌、甲状腺癌、肾癌等多种恶性肿瘤组织中显著上调,参与调节肿瘤细胞的糖酵解途径,最终导致肿瘤患者预后不良。HK3的失活显著影响结直肠癌糖酵解的激活,进而激活结直肠癌细胞的凋亡、内质网应激等下游信号通路,在癌症的进展中发挥重要作用[6]。迄今为止,尚未有关于HK3在pRCC中的表达差异与临床预后的报道,本研究通过观察和分析pRCC癌组织中HK3的表达情况,旨在探讨其与pRCC患者的临床特征及预后的关系。
1 材料与方法 1.1 公共数据库TCGA数据库(https://tcgadata.nci.nih.gov/tcga/)是用于从GDC数据门户检索和处理数据的程序。从pRCC基因表达芯片中筛选出癌组织290例,健康组织32例。比较HK3在癌组织与健康组织、不同分期及不同淋巴结转移的表达水平。
1.2 临床标本选取2017年1月1日至2021年12月31日于我院就诊的pRCC患者癌组织和癌旁组织样本蜡块共46例,其中,男22例,女24例。纳入标准:(1) 经肾癌病理组专家确诊为pRCC;(2) 诊断标准符合2012年国际泌尿病理协会对该病的定义;(3) 年龄 > 18周岁。排除标准:(1) 合并其他恶性肿瘤;(2) 术前接受过其他方式治疗;(3) 严重心肺功能不全。本研究获得中国医科大学附属第一医院伦理委员会批准,所有患者签署知情同意书。
1.3 主要试剂石蜡包埋组织蛋白提取试剂盒(北京英文特生物技术有限公司),细胞裂解液(RIPA,上海碧云天生物技术有限公司);蛋白酶抑制剂(PSMF,上海碧云天生物技术有限公司);BCA试剂盒(上海碧云天生物技术有限公司);HK3抗体(英国Abcam公司,货号:ab126217);GAPDH抗体(美国CST公司,货号:5174);辣根酶标记山羊抗兔(北京中杉金桥生物技术有限公司)。
1.4 Western blotting用组织切片机从石蜡中切取适量厚度的组织(约10~20 μm),按照试剂盒说明书步骤获取组织蜡块总蛋白,离心后加入组织裂解液(RIPA∶PSMF=100∶1)。随后使用BCA法测定蛋白质浓度。制备12% SDS-PAGE凝胶,经电泳后转膜,5%脱脂奶粉封闭1 h。按照抗体说明书将一抗稀释相应倍数,将膜与抗体置于4 ℃下孵育过夜。TBST洗膜3次,每次10 min,室温下二抗孵育1 h后暗室内曝光显影。用Image J软件处理蛋白图像,GAPDH作为标准化对照。
1.5 统计学分析采用GraphPad Prism Version 7.0进行数据分析;组间比较采用student-t检验;计数资料比较采用χ2检验;采用Kaplan-Meier法及log-rank检验绘制生存曲线并比较生存差异。P < 0.05为差异有统计学意义。
2 结果 2.1 HK3在pRCC患者癌组织及癌旁组织中的表达情况TCGA基因表达芯片数据中,HK3在癌组织中的mRNA表达水平明显高于癌旁组织(P < 0.001) (图 1A)。此外,分析了HK3的mRNA表达水平与肿瘤分期、淋巴结转移的关系,结果显示,HK3的转录水平在Stage 1~3期,以及N0~1期均明显高于正常组织的表达水平(图 1B、1C),差异有统计学意义(P < 0.01)。而正常组织与Stage 4期、N2期无统计学差异,这可能与数据库中Stage 4期、N2期患者数量较少有关。
|
| A, mRNA expression of HK3 in pRCC and normal renal tissue; B, mRNA expression of HK3 in pRCC based on tumor stage; C, mRNA expression of HK3 in pRCC based on lymphatic metastasis. ** P < 0. 01;*** P < 0. 001. 图 1 TCGA数据库中pRCC组织及正常肾组织中HK3 mRNA的表达 Fig.1 Expression of HK3 mRNA in pRCC and normal renal tissue from the TCGA database |
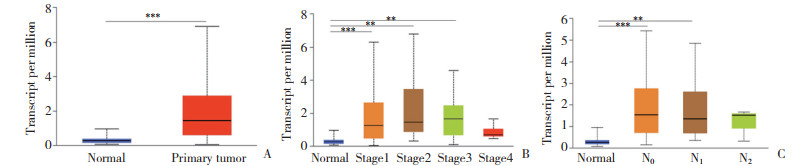
考虑到基因的转录调控、翻译后修饰等涉及到许多生物信息学过程,因此,HK3的转录水平并不能代表蛋白水平。随后通过Western blotting检测了HK3蛋白在癌组织与癌旁组织中的表达差异,结果进一步证实,HK3的蛋白水平在癌组织中表达明显高于癌旁组织(P < 0. 001),见图 2。
|
| A, protein expression of HK3 in pRCC and normal renal tissue; B, paired analysis of HK3 protein in pRCC and normal renal tissue; C, overall analysis of HK3 protein in pRCC and normal renal tissue. *** P < 0. 001. 图 2 HK3在pRCC组织及正常肾组织中的蛋白表达情况 Fig.2 Protein expression of HK3 in pRCC and normal renal tissue |
2.2 HK3表达与pRCC患者临床病理特征的关系
根据HK3蛋白表达的中位数将临床癌组织样本分为高表达组与低表达组。结果显示,pRCC癌组织中HK3的表达水平与该肿瘤的T分期、Fuhrman核分级明显相关(P < 0.01);而与患者的性别、年龄、淋巴结转移无关(P > 0.05),见表 1。
| Clinical pathological features | HK3 | χ2 | P | |
| Low expression group (n = 23) | High expression group (n = 23) | |||
| Age (year) | 1.415 | 0.234 | ||
| ≥60 | 15(32.61) | 11(23.91) | ||
| < 60 | 8(17.39) | 12(26.09) | ||
| Sex | 1.394 | 0.238 | ||
| Male | 13(28.26) | 9(19.57) | ||
| Female | 10(21.74) | 14(30.43) | ||
| T stage | 8.712 | 0.003 | ||
| T1-T2 | 16(34.78) | 6(13.04) | ||
| T3-T4 | 7(15.22) | 17(36.96) | ||
| Fuhrman grade | 9.127 | 0.003 | ||
| 1-2 | 14(30.43) | 4(8.70) | ||
| 3-4 | 9(19.57) | 19(41.30) | ||
| Lymphatic metastasis | 1.241 | 0.457 | ||
| Negative | 20(43.48) | 17(36.96) | ||
| Positive | 3(6.52) | 6(13.04) | ||
2.3 HK3在pRCC组织中的表达与生存预后的关系
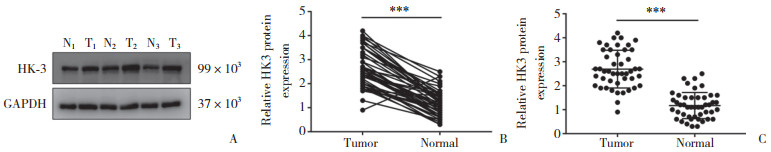
通过电话随访和我院复查资料汇总等方式获得患者复发、转移及生存的信息。截至2022年3月1日,疾病进展患者14例,死亡患者12例,存活29例,失访5例。Kaplan-Meier曲线提示HK3高表达组的无病生存期(disease-free survival,DFS) 及总体生存期(overall survival,OS) 均低于低表达组(P < 0.05),见图 3。
|
| A, DFS; B, OS. 图 3 不同HK3表达水平的患者的生存曲线 Fig.3 Survival curves for patients with different HK3 expression levels |
3 讨论
糖酵解是正常组织在低氧条件下发生的自然过程。在氧气充足的恶性肿瘤区域也可以观察到糖酵解。这种现象称为“有氧糖酵解”或“沃伯格效应[7]。糖酵解可以为癌细胞提供ATP,从而促进其生长和代谢。因此,糖酵解可能是恶性肿瘤的一个潜在的预后指标[8]。
HK的功能主要是催化葡萄糖代谢的第一步,使葡萄糖磷酸化成葡萄糖-6-磷酸[9]。HK在肿瘤细胞糖酵解等多种生物过程中发挥着关键作用。然而,对HK家族基因在不同类型癌症中的作用仍缺乏系统的认识[10]。HK3是糖酵解的关键基因,主要分布于骨髓、肺和脾脏[11]。HK3和环加氧酶-2可能通过糖酵解和花生四烯酸代谢在小儿急性淋巴细胞白血病及其预后中发挥重要作用,可能成为治疗该病的潜在靶点[12]。此外,HK3表达下调会导致中性粒细胞分化和活性显著降低[13]。
研究[14]报道,HK3在肾透明细胞癌组织中呈现高表达,并且参与调节肾透明细胞癌细胞免疫微环境与免疫逃逸。另有研究[15]显示在非小细胞肺癌中,HK3与免疫浸润相关,并可以作为预测非小细胞肺癌免疫治疗的反应程度。本研究结果显示,通过TCGA数据库分析与蛋白免疫印迹实验,发现在pRCC患者中,HK3的转录水平与蛋白水平明显高表达于癌旁健康组织,提示HK3可能促进pRCC的发生发展。此结果与HK3在结肠癌中高表达结果一致[16]。为进一步明确HK3的表达对pRCC的影响,本研究分析了肿瘤患者HK3的表达与其临床特征的关系,结果表明HK3的表达水平与肿瘤的T分期、Fuhrman核分级明显相关,差异有统计学意义(P < 0.01);而与患者的性别、年龄、淋巴结转移无关,差异无统计学意义(P > 0.05)。随后,根据随访结果分析显示,HK3高表达组的DFS及OS均低于低表达组(P < 0.05)。这一结果提示HK3的高表达可能与pRCC的发展有关,可以作为pRCC的辅助指标。
综上所述,pRCC患者肿瘤组织中HK3蛋白水平高表达可能会促进患者的病程发展。HK3可能成为pRCC的鉴别诊断及预后评价指标,是潜在的肿瘤标志物。为进一步研究HK3在pRCC的生物学功能提供依据,对指导临床治疗及预后预测有一定的参考意义。
| [1] |
PONTES O, OLIVEIRA-PINTO S, BALTAZAR F, et al. Renal cell carcinoma therapy: current and new drug candidates[J]. Drug Discov Today, 2022, 27(1): 304-314. DOI:10.1016/j.drudis.2021.07.009 |
| [2] |
YAMAMOTO T, GULANBAR A, HAYASHI K, et al. Is hypervascular papillary renal cell carcinoma present?[J]. Abdom Radiol(NY), 2021, 46(4): 1687-1693. DOI:10.1007/s00261-020-02809-8 |
| [3] |
MUGLIA VF, PRANDO A. Renal cell carcinoma: histological classification and correlation with imaging findings[J]. Radiol Bras, 2015, 48(3): 166-174. DOI:10.1590/0100-3984.2013.1927 |
| [4] |
LIU XS, LIU JM, CHEN YJ, et al. Comprehensive analysis of hexokinase 2 immune infiltrates and m6A related genes in human esophageal carcinoma[J]. Front Cell Dev Biol, 2021, 9: 715883. DOI:10.3389/fcell.2021.715883 |
| [5] |
MCDONALD AJ, CURT KM, PATEL RP, et al. Targeting mitochondrial hexokinases increases efficacy of histone deacetylase inhibitors in solid tumor models[J]. Exp Cell Res, 2019, 375(2): 106-112. DOI:10.1016/j.yexcr.2018.12.012 |
| [6] |
KUDRYAVTSEVA AV, FEDOROVA MS, ZHAVORONKOV A, et al. Effect of Lentivirus-mediated shRNA inactivation of HK1, HK2, and HK3 genes in colorectal cancer and melanoma cells[J]. BMC Genet, 2016, 17(Suppl 3): 156. DOI:10.1186/s12863-016-0459-1 |
| [7] |
ZHANG Y, CHEN MY, LIU MH, et al. Glycolysis-related genes serve as potential prognostic biomarkers in clear cell renal cell carcinoma[J]. Oxid Med Cell Longev, 2021, 2021: 6699808. DOI:10.1155/2021/6699808 |
| [8] |
GANAPATHY-KANNIAPPAN S, GESCHWIND JFH. Tumor glycolysis as a target for cancer therapy: progress and prospects[J]. Mol Cancer, 2013, 12: 152. DOI:10.1186/1476-4598-12-152 |
| [9] |
惠培培, 徐子迪, 曾俏, 等. 己糖激酶基因突变相关的先天性高胰岛素血症一例并文献复习[J]. 中华糖尿病杂志, 2020, 12(2): 108-112. |
| [10] |
XU SL, HERSCHMAN HR. A tumor agnostic therapeutic strategy for hexokinase 1-null/hexokinase 2-positive cancers[J]. Cancer Res, 2019, 79(23): 5907-5914. DOI:10.1158/0008-5472.CAN-19-1789 |
| [11] |
JIANG MZ, LIU SJ, LIN JX, et al. A pan-cancer analysis of molecular characteristics and oncogenic role of hexokinase family genes in human tumors[J]. Life Sci, 2021, 264: 118669. DOI:10.1016/j.lfs.2020.118669 |
| [12] |
GAO HY, LUO XG, CHEN X, et al. Identification of key genes affecting disease free survival time of pediatric acute lymphoblastic leukemia based on bioinformatic analysis[J]. Blood Cells Mol Dis, 2015, 54(1): 38-43. DOI:10.1016/j.bcmd.2014.08.002 |
| [13] |
FEDERZONI EA, VALK PJM, TORBETT BE, et al. PU.1 is linking the glycolytic enzyme HK3 in neutrophil differentiation and survival of APL cells[J]. Blood, 2012, 119(21): 4963-4970. DOI:10.1182/blood-2011-09-378117 |
| [14] |
XU WH, LIU WR, XU Y, et al. Hexokinase 3 dysfunction promotes tumorigenesis and immune escape by upregulating monocyte/macrophage infiltration into the clear cell renal cell carcinoma microenvironment[J]. Int J Biol Sci, 2021, 17(9): 2205-2222. DOI:10.7150/ijbs.58295 |
| [15] |
TUO Z, ZHENG X, ZONG Y, et al. HK3 is correlated with immune infiltrates and predicts response to immunotherapy in non-small cell lung cancer[J]. Clin Transl Med, 2020, 10(1): 319-330. DOI:10.1002/ctm2.6 |
| [16] |
PUDOVA EA, KUDRYAVTSEVA AV, FEDOROVA MS, et al. HK3 overexpression associated with epithelial-mesenchymal transition in colorectal cancer[J]. BMC Genomics, 2018, 19(Suppl 3): 113. DOI:10.1186/s12864-018-4477-4 |
 2022, Vol. 51
2022, Vol. 51