文章信息
- 王宏宇, 付茜, 苏福祥
- WANG1 Hongyu, FU Xi, SU Fuxiang
- 载脂蛋白B/载脂蛋白A1比值与急性冠脉综合征患者冠状动脉多支病变及斑块易损性的相关性
- Correlation between the apolipoprotein B/apolipoprotein A1 ratio and coronary multivessel disease and plaque vulnerability in patients with acute coronary syndrome
- 中国医科大学学报, 2022, 51(7): 577-582
- Journal of China Medical University, 2022, 51(7): 577-582
-
文章历史
- 收稿日期:2022-04-23
- 网络出版时间:2022-06-21 15:08
2. 中国医科大学附属盛京医院第四心血管内科,沈阳 110022
2. The Fourth Department of Cardiology, Shengjing Hospital of China Medical University, Shenyang 110022, China
急性冠脉综合征(acute coronary syndrome,ACS)包括急性ST段抬高心肌梗死、急性非ST段抬高心肌梗死和不稳定型心绞痛,是由于不稳定的冠状动脉斑块引起的冠状动脉严重狭窄或闭塞进而引发的临床综合征。易损斑块通常被定义为高危斑块,其极易发生破裂而导致冠状动脉血栓形成,是ACS的主要病因[1]。通过冠状动脉造影很难发现易损斑块,而使用冠状动脉腔内成像技术如冠状动脉血管内超声(intravascular ultrasound,IVUS)、近红外光谱或光学相干断层扫描,可以明确冠状动脉病变的形态特征,进而识别易损斑块[2]。但这些影像学检查方法为有创性且价格昂贵,普及率较低。因此,寻找能够预测冠状动脉斑块易损性的非侵入性检查的生物标志物具有重要的临床意义。
已有研究[3]表明,载脂蛋白B/载脂蛋白A1(apolipoprotein B/apolipoprotein A1,ApoB/ApoA1)比值对预测ACS患者冠状动脉病变严重程度以及预后有重要作用。但ApoB/ApoA1比值与ACS患者冠状动脉斑块易损性是否相关尚不明确。本研究以接受冠状动脉造影和冠状动脉IVUS检查的ACS患者为研究对象,探讨ApoB/ApoA1比值与ACS患者冠状动脉病变斑块形态的相关性。
1 材料与方法 1.1 研究对象和分组收集2017年10月至2021年6月于我院确诊为ACS并接受IVUS检查的488例患者的临床资料。排除标准:既往应用降脂药物者,严重贫血者,肾功能衰竭(估算肾小球滤过率 < 60 mL/min)者,肝功能衰竭者,存在严重感染、风湿、免疫性疾病者,既往行经皮冠状动脉介入治疗或冠状动脉旁路移植术者,冠状动脉慢性闭塞者,病历资料不全者。最终314例患者(405条冠状动脉病变血管)被纳入研究。
将314例患者根据ApoB/ApoA1比值的中位数,分为低ApoB/ApoA1组(ApoB/ApoA1比值< 0.708,包括157例患者、201条冠状动脉病变血管)和高ApoB/ApoA1组(ApoB/ApoA1比值≥0.708,包括157例患者、204条冠状动脉病变血管)。
1.2 方法 1.2.1 收集患者基线资料记录所有患者的人口统计学数据(年龄、性别、收缩压、舒张压)、冠状动脉粥样硬化性心脏病危险因素(高血压病史、糖尿病病史、吸烟史、卒中病史、冠状动脉粥样硬化性心脏病家族史)和实验室检查数据(入院后24 h内采集空腹血样,检测血清血脂、空腹血糖、糖化血红蛋白、肝功能、肾功能)。
1.2.2 冠状动脉造影检查所有患者均通过桡动脉通路或股动脉通路进行多体位冠状动脉造影,记录冠状动脉造影结果,明确发生冠状动脉狭窄的位置,定量分析冠状动脉狭窄程度,将狭窄程度 > 50%的血管定义为病变血管,根据病变血管数分为冠状动脉单支病变和冠状动脉多支病变(病变血管数≥2),比较冠状动脉多支病变和冠状动脉左主干病变的发生率。
1.2.3 冠状动脉IVUS检查应用美国波士顿科学公司的Opticross(40 MHz,3.0 F)血管内超声导管行冠状动脉IVUS检查,将一根导管推送至病变远端,并以0.5 mm/s的速度进行自动拉回,直至到达冠状动脉口。由2名熟悉IVUS影像学的医生在不知晓患者临床数据和血管造影结果的情况下分析IVUS图像。IVUS定量参数包括斑块负荷(plaque burden,PB)、病变处最小管腔面积(minimum lumen area,MLA)、病变最严重处血管外弹性膜(extravascular elastic membrane,EEM)的管腔横截面积。冠状动脉病变定义为至少连续3帧内PB > 50%的节段。IVUS定性参数包括斑块破裂(存在一个腔与血管腔相通,有一个覆盖的残余纤维帽)、血栓(管腔内肿块,常有分层、分叶状或有蒂外观)、钙化(斑块比外膜亮,有声影)。将钙化分为点状钙化、成角钙化,测量成角钙化的角度[4]。
1.3 统计学分析采用SPSS 22.0软件进行统计学分析。正态分布的计量资料以x ± s表示,2组比较采用独立样本t检验;计数资料以率或构成比表示,组间比较采用χ2检验。采用逐步二元logistic回归分析影响冠状动脉多支病变、冠状动脉斑块破裂和冠状动脉血栓形成的危险因素。采用受试者操作特征(receiver operating characteristic,ROC)曲线分析ApoB/ApoA1比值对冠状动脉斑块形态和冠状动脉多支病变的诊断价值。P < 0.05为差异有统计学意义。
2 结果 2.1 2组患者基线资料的比较2组患者比较,人口统计学资料(包括年龄、性别、收缩压、舒张压)和冠状动脉粥样硬化性心脏病危险因素(包括高血压病史、糖尿病病史、吸烟史、卒中病史、冠状动脉粥样硬化性心脏病家族史)均无统计学差异(P > 0.05)。比较2组患者的实验室检查结果,尿素氮、肌酐、胱抑素C、尿酸、糖化血红蛋白水平无统计学差异(P > 0.05);高ApoB/ApoA1组患者的空腹血糖、总胆固醇、甘油三酯、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、ApoB水平明显高于低ApoB/ApoA1组,而高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和ApoA1水平明显低于低ApoB/ApoA1组(均P < 0.05)。2组比较,临床诊断存在差异(P < 0.05),高ApoB/ApoA1组患者心肌梗死占比更高,不稳定型心绞痛的占比更低。见表 1。
| Item | Total(n = 314) | Low ApoB/ApoA1 group(n = 157) | High ApoB/ApoA1 group(n = 157) | P |
| Demographics | ||||
| Age(year) | 64.05±9.78 | 65.00±8.46 | 63.11±10.86 | 0.086 |
| Male [n(%)] | 227(72.3) | 116(73.9) | 111(70.7) | 0.614 |
| SBP(mmHg) | 136.75±26.97 | 137.97±21.01 | 135.54±26.61 | 0.368 |
| DBP(mmHg) | 80.01±13.34 | 79.51±12.61 | 80.51±14.00 | 0.507 |
| Risk factors of CHD | ||||
| Hypertension [n(%)] | 165(52.5) | 76(48.4) | 89(56.7) | 0.175 |
| Diabetes mellitus [n(%)] | 100(31.8) | 47(29.9) | 53(33.8) | 0.545 |
| Current smoker [n(%)] | 145(46.2) | 70(44.6) | 75(47.8) | 0.651 |
| Family history of CHD [n(%)] | 42(13.4) | 21(13.4) | 21(13.4) | 0.999 |
| Previous stroke [n(%)] | 48(15.3) | 30(19.1) | 18(11.5) | 0.085 |
| Previous MI [n(%)] | 73(23.2) | 31(19.7) | 42(19.8) | 0.182 |
| Clinical diagnosis | 0.012 | |||
| UA [n(%)] | 221(70.4) | 122(77.7) | 99(63.1) | |
| NSTEMI [n(%)] | 61(19.4) | 25(15.9) | 36(22.9) | |
| STEMI [n(%)] | 32(10.2) | 10(6.4) | 22(14.0) | |
| Laboratory results | ||||
| Chol-T(mmol/L) | 4.48±1.15 | 3.87±0.90 | 5.10±1.04 | < 0.001 |
| TC(mmol/L) | 1.64±0.99 | 1.31±0.71 | 1.97±1.13 | 0.012 |
| HDL-C(mmol/L) | 1.01±0.27 | 1.08±0.30 | 0.93±0.22 | < 0.001 |
| LDL-C(mmol/L) | 2.84±1.06 | 2.24±0.76 | 3.44±0.97 | < 0.001 |
| ApoA1(mmol/L) | 1.22±0.23 | 1.31±0.23 | 1.12±0.19 | < 0.001 |
| ApoB(mmol/L) | 0.88±0.28 | 0.69±0.17 | 1.07±0.24 | < 0.001 |
| Blood urea nitrogen(mmol/L) | 5.96±2.32 | 5.93±2.43 | 6.00±2.20 | 0.794 |
| Cystatin C(mmol/L) | 1.06±0.34 | 1.04±0.29 | 1.09±0.39 | 0.246 |
| Creatinine(μmol/L) | 74.23±23.80 | 72.31±19.28 | 76.13±27.49 | 0.155 |
| Uric acid(μmol/L) | 348.90±114.68 | 340.22±111.86 | 358.20±117.35 | 0.203 |
| Fasting blood sugar(mmol/L) | 6.44±2.41 | 6.15±1.94 | 6.72±2.76 | 0.040 |
| HbA1C | 6.48±1.48 | 6.32±1.38 | 6.63±1.57 | 0.074 |
| SBP,systolic blood pressure;DBP,diastolic blood pressure;CHD,coronary heart disease;MI,myocardial infarction;UA,unstable angina;STEMI,ST-segment elevation myo-cardial infarction;NSTEMI,non-ST-segment elevation myocardial infarction;Chol-T,total cholesterol;TC,triglyceride;HDL-C,high-density lipoprotein cholesterol;LDL-C,low-density lipoprotein cholesterol;HbA1C,glycosylated hemoglobin. | ||||
2.2 2组患者冠状动脉造影结果的比较
低ApoB/ApoA1组和高ApoB/ApoA1组冠状动脉多支病变的患病率分别为69.4%(83/157)和52.9%(109/157),高ApoB/ApoA1组明显高于低ApoB/ApoA1组(P = 0.004)。低ApoB/ApoA1组和高ApoB/ApoA1组冠状动脉左主干病变发生率分别为11.5%(18/157)和17.8%(28/157),2组比较无统计学差异(P > 0.05)。
2.3 2组患者IVUS定性和定量结果的比较2组患者的病变血管中,左前降支、左回旋支、右冠状动脉和其他血管所占比例无统计学差异(P > 0.05)。测量罪犯病变处的MLA、MLA测量处的EEM面积和PB,2组比较均无统计学差异(P > 0.05)。
利用IVUS进一步对罪犯病变处的斑块性质进行定性分析。总体上,冠状动脉软斑块占54.6%,纤维斑块占21.2%,钙化病变占13.6%。2组比较,冠状动脉软斑块、纤维斑块、钙化病变的比例无统计学差异(P > 0.05),冠状动脉钙化结节发生率、成角钙化发生率、成角钙化的最大钙化角度也无统计学差异(P > 0.05)。高ApoB/ApoA1组的斑块破裂发生率(P = 0.012)和冠状动脉血栓形成的发生率(P = 0.025)均明显高于低ApoB/ApoA1组。见表 2。
| Item | The overall(n = 405) | Low ApoB/ApoA1 group(n = 201) | High ApoB/ApoA1 group(n = 204) | P |
| Culprit related artery | 0.234 | |||
| LAD [n(%)] | 219(54.1) | 106(52.7) | 113(55.4) | |
| LCX [n(%)] | 61(18.4) | 37(11.8) | 24(15.1) | |
| LCX [n(%)] | 75(18.5) | 37(18.4) | 38(18.6) | |
| Others [n(%)] | 50(12.3) | 21(10.4) | 29(14.2) | |
| Quantitative parameter | ||||
| MLA(mm2) | 2.96±1.10 | 2.96±1.03 | 2.95±1.16 | 0.971 |
| EEM(mm2) | 15.14±7.80 | 14.93±7.53 | 15.35±8.08 | 0.591 |
| PB(%) | 77.99±8.09 | 77.63±8.38 | 78.34±7.81 | 0.374 |
| Qualitative assessment and parameter | ||||
| Culprit plaque type | 0.167 | |||
| Soft [n(%)] | 221(54.6) | 120(59.7) | 101(49.5) | |
| Fibrous [n(%)] | 86(21.2) | 36(17.9) | 50(24.5) | |
| Calcified [n(%)] | 55(13.6) | 27(13.4) | 28(13.7) | |
| Mixed [n(%)] | 43(10.6) | 18(9.0) | 25(12.3) | |
| Plaque rupture [n(%)] | 55(13.6) | 18(9.0) | 37(18.1) | 0.012 |
| Thrombosis [n(%)] | 30(7.4) | 9(4.5) | 21(10.3) | 0.025 |
| Calcified nodule [n(%)] | 37(9.1) | 16(8.0) | 21(10.3) | 0.520 |
| Annular calcification [n(%)] | 120(29.6) | 52(25.9) | 68(33.3) | 0.125 |
| Maximum calcium angle(°) | 201.34±90.78 | 212.75±95.54 | 192.29±85.93 | 0.245 |
| LAD,left anterior descending;LCX,left circumflex;RCA,right coronary artery. | ||||
2.4 ApoB/ApoA1比值与冠状动脉多支病变、斑块破裂及血栓形成的相关性
单因素回归分析结果表明,ApoB/ApoA1比值与冠状动脉多支病变、冠状动脉斑块破裂、冠状动脉血栓形成存在独立相关性。纳入冠状动脉粥样硬化性心脏病的危险因素(包括年龄、性别、吸烟史、高血压病史、糖尿病病史、卒中病史、冠状动脉粥样硬化性心脏病家族史、既往心肌梗死病史)以及表 1中有统计学差异的临床指标后进行多因素回归分析,结果提示,ApoB/ApoA1比值与冠状动脉多支病变、冠状动脉斑块破裂、冠状动脉血栓形成依然存在相关性。
与低ApoB/ApoA1组相比,高ApoB/ApoA1组冠状动脉多支病变的发生率更高(OR = 6.46,95%CI:4.40~9.46,P < 0.001),斑块破裂(OR = 2.24,95%CI:1.13~4.38,P = 0.005)和冠状动脉血栓形成的风险越大(OR = 3.81,95%CI:2.55~7.69,P = 0.018)。再将ApoB/ApoA1比值作为连续变量进行单因素和多因素回归分析,结果发现ApoB/ApoA1比值与冠状动脉多支病变、冠状动脉斑块破裂、冠状动脉血栓形成仍存在独立相关性。
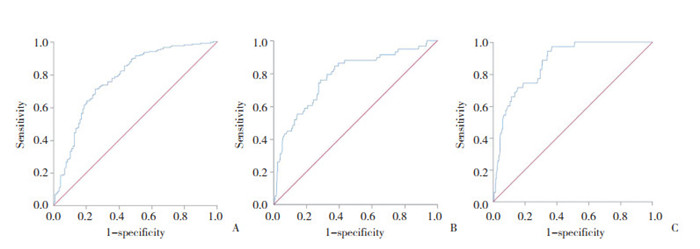
利用ROC曲线的约登指数,确定ApoB/ApoA1比值预测冠状动脉多支病变的最佳界值为0.826,灵敏度为70.9%,特异度为74.6%(曲线下面积=0.778,95%CI:0.722~0.832);ApoB/ApoA1比值预测冠状动脉斑块破裂的最佳界值为0.812,灵敏度为75.9%,特异度为71.5%(曲线下面积=0.782,95%CI:0.714~0.850);ApoB/ApoA1比值预测冠状动脉血栓形成的最佳界值为0.772,灵敏度为74.3%,特异度为63.2%(曲线下面积=0.871,95%CI:0.822~0.920)。见图 1。
|
| A, coronary multivessel disease; B, plaque rupture; C, coronary thrombosis. 图 1 ApoB/ApoA1比值对冠状动脉多支病变、斑块破裂、血栓形成预测价值的ROC曲线 Fig.1 ROC curve of the predictive value of the ApoB/ApoA1 ratio for coronary multivessel disease, plaque rupture, and coronary thrombosis |
| Item | Univariate analysis OR (95%CI) | P | Multivariate analysis OR (95%CI) | P |
| Coronary multivessel disease | ||||
| Low ApoB/ApoA1 group | 1 | 1 | ||
| High ApoB/ApoA1 group | 6.19 (3.69-10.38) | <0.001 | 6.46 (4.40-9.46) | <0.001 |
| ApoB/ApoA1 | 5.62 ( 2.51-9.61) | <0.001 | 6.82 (4.62-10.07) | <0.001 |
| Plaque rupture | ||||
| Low ApoB/ApoA1 group | 1 | 1 | ||
| High ApoB/ApoA1 group | 2.33 (1.28-4.24) | 0.006 | 2.24 (1.13-4.38) | 0.005 |
| ApoB/ApoA1 | 1.66 (1.22-3.43) | 0.016 | 2.01 (1.36-3.94) | 0.009 |
| Coronary thrombosis | ||||
| Low ApoB/ApoA1 group | 1 | 1 | ||
| High ApoB/ApoA1 group | 2.45 (1.09-5.49) | 0.030 | 3.81 (2.55-7.69) | 0.018 |
| ApoB/ApoA1 | 4.67 (3.46-10.33) | <0.001 | 3.88 (3.20-9.38) | 0.009 |
3 讨论
冠状动脉斑块形态是ACS临床进展和预后的重要决定因素,薄纤维帽的富含脂质的斑块是斑块易损性的组织学标志物,钙化结节、斑块侵蚀同样是高危斑块,这些易损斑块即使仅引起冠状动脉轻中度狭窄,也极易发生突然破裂,并引发急性闭塞性血栓形成。既往的IVUS研究[5]发现,在ACS患者的罪犯病变中易损斑块发生率高达66%,表明应用IVUS更易发现冠状动脉易损斑块。IVUS具有穿透血管壁的能力,并且不需要使用额外的造影剂,其穿透深度约为4~8 mm,能够显示冠状动脉的所有层(包括外部弹性膜和周围组织)以及与斑块不稳定性相关的血管正性重构的存在。IVUS的应用对改善经皮冠状动脉介入治疗后ACS患者的预后有重要作用,可以减少术后死亡、再发心肌梗死以及靶血管重建的发生率[6]。
血脂异常在ACS中起着至关重要的作用。LDL-C是公认的冠状动脉粥样硬化性心脏病的危险因素,是一级和二级预防的主要治疗目标。但LDL-C达到目标值的患者中仍有一部分出现冠状动脉斑块进展,这与极低密度脂蛋白、中间密度脂蛋白、脂蛋白a的参与有关。同时,冠状动脉粥样硬化进展过程中,HDL-C的动脉保护作用降低也被认为是重要的影响因素。越来越多的证据表明,非HDL-C和ApoB在预测冠状动脉粥样硬化性心脏病风险方面优于LDL-C,并且一些治疗指南已将其指定为次要目标[7]。根据氨基酸组成的差异可以将ApoB分为2种亚型:ApoB48和ApoB100,其中ApoB48是乳糜微粒的载脂蛋白之一,APOB100主要参与极低密度脂蛋白和LDL-C的转运及代谢。LDL-C、极低密度脂蛋白、中间密度脂蛋白及脂蛋白a均包含ApoB,在动脉粥样硬化形成过程中,ApoB可以促进富含胆固醇的脂蛋白沉积在动脉壁的血管内膜中,从而引起辅助性T细胞的自身免疫反应,CD4+辅助性T细胞的自身免疫反应,CD4+辅助性T细胞可以识别ApoB的自身肽B,进行克隆性扩张,并促进炎症细胞浸润,从而诱导动脉斑块变得不稳定[8]。ApoB还可以加重冠状动脉内皮的氧化应激与炎症反应,引起冠状动脉病变进展[9]。ApoA1是HDL颗粒中的主要蛋白质部分,被认为与ApoB具有相反的作用,即动脉粥样硬化保护作用。虽然在临床研究中增加ApoA1的表达未观察到预期的心血管保护作用,但基础研究[10]表明,ApoA1可以促进巨噬细胞向抗炎巨噬细胞分化,抑制炎症反应,同时可以调节淋巴管脂质吸收、抗血小板聚集、改善营养物质代谢,从而起到稳定动脉斑块的作用。
ApoB/ApoA1比值检测操作简单,成本低,可以在临床中普遍使用。越来越多的研究[11]发现,ApoB/ApoA1比值在动脉粥样硬化性疾病进展中具有重要的临床价值,其不受他汀治疗等因素影响,能够更好地反映血脂异常对心血管的影响,预测ACS患者的冠状动脉病变严重程度和预后。本研究首次通过IVUS发现接受经皮冠状动脉介入治疗的ACS患者的ApoB/ApoA1比值与罪犯病变处冠状动脉斑块形态特征之间的关系。本研究结果表明,高ApoB/ApoA1比值与更严重的冠状动脉病变、冠状动脉斑块破裂以及冠状动脉血栓形成相关,是预测斑块易损性及冠状动脉多支病变的一个可靠的生物学指标。在临床工作中,可以根据生物学标志物对ACS进行冠状动脉病变严重程度和预后评估,并更准确地指导治疗。此外,在对ACS的药物治疗过程中,定期监测ApoB/ApoA1比值非常必要。
本研究为单中心、回顾性研究,可能存在研究样本不足,不能排除潜在的混杂因素和选择偏倚。今后应进行大样本、多中心前瞻性研究,进一步验证ApoB/ApoA1比值与ACS患者冠状动脉多支病变、斑块易损性的关系。
| [1] |
TOMANIAK M, KATAGIRI Y, MODOLO R, et al. Vulnerable plaques and patients: state-of-the-art[J]. Eur Heart J, 2020, 41(31): 2997-3004. DOI:10.1093/eurheartj/ehaa227 |
| [2] |
VAN VEELEN A, VAN DER SANGEN NMR, DELEWI R, et al. Detection of vulnerable coronary plaques using invasive and non- invasive imaging modalities[J]. J Clin Med, 2022, 11(5): 1361. DOI:10.3390/jcm11051361 |
| [3] |
DENG F, LI D, LEI L, et al. Association between apolipoprotein B/A1 ratio and coronary plaque vulnerability in patients with atherosclerotic cardiovascular disease: an intravascular optical coherence tomography study[J]. Cardiovasc Diabetol, 2021, 20(1): 188. DOI:10.1186/s12933-021-01381-9 |
| [4] |
血管内超声在冠状动脉疾病中应用的中国专家共识专家组. 血管内超声在冠状动脉疾病中应用的中国专家共识(2018)[J]. 中华心血管病杂志, 2018, 46(5): 344-351. DOI:10.3760/cma.j.issn.0253-3758.2018.05.005 |
| [5] |
ZHU KF, WANG YM, WANG YQ, et al. The relationship between serum levels of total bilirubin and coronary plaque vulnerability[J]. Coron Artery Dis, 2016, 27(1): 52-58. DOI:10.1097/MCA.0000000000000309 |
| [6] |
MENTIAS A, SARRAZIN MV, SAAD M, et al. Long-term outcomes of coronary stenting with and without use of intravascular ultrasound[J]. JACC Cardiovasc Interv, 2020, 13(16): 1880-1890. DOI:10.1016/j.jcin.2020.04.052 |
| [7] |
CARR SS, HOOPER AJ, SULLIVAN DR, et al. Non-HDL-cholesterol and apolipoprotein B compared with LDL-cholesterol in atherosclerotic cardiovascular disease risk assessment[J]. Pathology, 2019, 51(2): 148-154. DOI:10.1016/j.pathol.2018.11.006 |
| [8] |
MARCHINI T, HANSEN S, WOLF D. ApoB-specific CD4+ T cells in mouse and human atherosclerosis[J]. Cells, 2021, 10(2): 446. DOI:10.3390/cells10020446 |
| [9] |
TALEB A, WITZTUM JL, TSIMIKAS S. Oxidized phospholipids on apoB-100-containing lipoproteins: a biomarker predicting cardiovascular disease and cardiovascular events[J]. Biomark Med, 2011, 5(5): 673-694. DOI:10.2217/bmm.11.60 |
| [10] |
COCHRAN BJ, ONG KL, MANANDHAR B, et al. APOA1:a protein with multiple therapeutic functions[J]. Curr Atheroscler Rep, 2021, 23(3): 11. DOI:10.1007/s11883-021-00906-7 |
| [11] |
HUA R, LI Y, LI W, et al. Apolipoprotein B/A1 ratio is associated with severity of coronary artery stenosis in CAD patients but not in non-CAD patients undergoing percutaneous coronary intervention[J]. Dis Markers, 2021, 2021: 8959019. DOI:10.1155/2021/8959019 |
 2022, Vol. 51
2022, Vol. 51