文章信息
- 邵凌杰, 林文达, 韩向军, 李东奇, 窦怀豹, 张曦彤
- 介入栓塞治疗肾动脉造影阴性医源性肾出血的疗效评价
- Embolization for treating iatrogenic renal hemorrhage without positive angiographic findings
- 中国医科大学学报, 2022, 51(6): 570-573
- Journal of China Medical University, 2022, 51(6): 570-573
-
文章历史
- 收稿日期:2021-03-15
- 网络出版时间:2022-06-01 16:36
2. 中国医科大学附属第一医院介入治疗科,沈阳 110001;
3. 中国医科大学塔城医院普通外科,新疆 塔城 834700
医源性肾出血是临床常见的泌尿系统疾病,其主要表现为肾脏经医源性损伤后出现肉眼血尿,严重者伴有失血性休克,如不及时诊断和治疗,可能危及患者生命。常见的原因多为经皮肾镜取石后肾损伤,此外还有经皮肾穿刺活检、肾脏手术后出血等[1-2]。急性肾出血的治疗主要有内科保守治疗、介入栓塞治疗和外科切除治疗。介入栓塞治疗以其微创、高效的特点得到越来越多的认可[3-4]。对于肾动脉造影发现肾出血的患者,通过超选择性肾动脉栓塞,绝大多数患者可以达到快速止血的目的[5]。然而对于肾动脉造影阴性的患者,肾动脉栓塞的疗效还有待进一步研究。本研究回顾性分析我院32例肾动脉造影阴性的医源性肾出血患者的临床资料,总结介入栓塞治疗对肾动脉造影阴性的医源性肾出血的治疗价值。
1 材料与方法 1.1 研究对象选择2013年1月至2020年11月中国医科大学附属第一医院介入治疗科收治的92例医源性肾出血的患者,均行肾动脉造影,其中,32例患者造影过程中未发现阳性出血征象,包括造影剂外溢、动静脉瘘、假性动脉瘤。收集患者的年龄、性别、诊断、出血原因、损伤发生至肾出血的时间、发现出血至肾动脉造影的时间、造影后出血停止的时间。同时收集患者造影前的实验室血液检查指标,包括白细胞、红细胞、血小板、凝血酶原时间、肌酐、尿素氮,以及治疗后1周的肌酐水平。
1.2 治疗方案所有患者均有明确的肾出血临床表现,包括肉眼血尿、肾周血肿、血压下降等。确诊后患者制动、卧床休息、常规建立静脉通路、止血、补液、导尿和膀胱冲洗。出血速度快者积极输血,并立即准备肾动脉造影。持续出血经保守治疗无效者,亦行肾动脉造影。向患者及其家属交代肾动脉造影和栓塞的获益和手术风险,知情同意后进行肾动脉造影。
肾动脉造影和栓塞治疗:患者平卧于数字剪影血管造影机检查床(德国西门子公司),右侧腹股沟区消毒铺巾后,以右侧股动脉入路,送入5F导管鞘及猪尾导管(日本泰尔茂株式会社)行腹主动脉造影,明确肾动脉走形及变异血管后,改用Cobra导管(日本泰尔茂株式会社)行选择性肾动脉造影,明确出血血管、出血部位后,再用微导管(美国波士顿科学公司)超选择插管后,用微弹簧圈或明胶海绵进行栓塞。栓塞区域的依据:经皮肾镜取石术中置入的引流管在肾脏的投影区,或泌尿外科术者判断的出血区域。栓塞完全后再次造影,确认无出血后终止手术。术后患者继续接受内科止血治疗,直至尿液转清、出血停止。
泌尿外科和介入治疗科医生共同商议后,对32例肾动脉造影阴性患者中11例患者的医源性肾损伤区域血管进行栓塞(图 1),21例患者未行栓塞,继续保守治疗。所有患者出院后均进行电话随访。
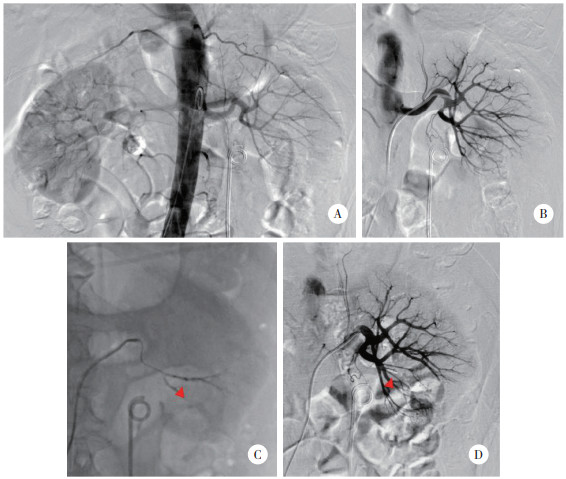
|
| A,腹主动脉非选择造影,明确肾动脉走形及有无副肾动脉;B,Cobra导管行选择性左肾动脉造影,未发现造影剂外溢和假性动脉瘤等表现;C,微导管超选择插管至穿刺道区域的肾内血管进行栓塞;D,再次行肾动脉造影,评价栓塞效果和肾脏受累体积. 图 1 肾出血介入栓塞治疗的操作流程 |
1.3 统计学分析
采用SPSS 20.0软件进行统计学分析。正态分布的计量资料以x±s表示,组间比较采用独立样本t检验;计数资料用率表示,组间比较采用χ2检验、Fisher精确概率法。P < 0.05为差异有统计学意义。
2 结果 2.1 患者一般资料92例患者诊断为医源性肾出血并进行了肾动脉造影,其中32例(34.8%)未发现明确的出血征象。32例肾动脉造影阴性患者中,平均年龄为(50.7±15.3)岁(23~74岁),男24例(75.0%);诊断为肾结石22例(68.8%),输尿管结石5例(15.6%),肾炎5例(15.6%),合并高血压14例(43.8%),糖尿病4例(12.5%);经皮肾镜取石27例(84.4%),经皮穿刺肾活检5例(15.6%);左侧肾出血12例(37.5%),右侧肾出血20例(62.5%);肾损伤后发生出血的时间为(3.6±3.8)d,最短时间为损伤后即刻出血;出血确诊后(2.5±3.6)d开始肾动脉造影,造影后(3.3±2.8)d出血停止,最短止血时间为术后即刻止血成功;21例(65.6%)患者继续采用保守治疗,11例(34.4%)患者采用介入栓塞治疗。
2.2 肾动脉造影阴性患者的介入栓塞治疗11例采用介入栓塞治疗的肾动脉造影阴性患者中,2例使用2 mm弹簧圈各1枚联合100~300 μm明胶海绵少许,9例单独使用100~300 μm明胶海绵少许。
2.3 保守治疗与介入栓塞治疗的对比32例肾动脉造影阴性的患者中,21例采用保守治疗,11例采用介入栓塞治疗,所有患者住院期间均止血成功。保守治疗组和介入栓塞治疗组比较,患者年龄、性别、出血原因、出血部位、医源性损伤至出血时间、出血至肾动脉造影时间、肾动脉造影前白细胞、红细胞、血小板、凝血酶原时间、血浆尿素氮和血清肌酐方面无统计学差异(P > 0.05),介入栓塞治疗组止血时间更为迅速(P < 0.01)。所有患者均电话随访,随访时间为6~12个月,均未再发生肾出血。见表 1。
| 参数 | 保守治疗组(n=21) | 介入栓塞治疗组(n=11) | P |
| 年龄(岁 | 47.9±16.3 | 56.0±12.2 | 0.16 |
| 男/女 | 14/7 | 10/1 | 0.21 |
| 出血原因 | 0.14 | ||
| 经皮肾镜取石 | 16 | 11 | |
| 经皮肾穿活检 | 5 | 0 | |
| 出血部位(左侧肾/右侧肾 | 7/14 | 5/6 | 0.70 |
| 损伤至出血时间(d) | 3.8±3.4 | 3.4±4.4 | 0.78 |
| 出血至造影时间(d) | 1.7±2.5 | 3.6±4.6 | 0.18 |
| 白细胞(×109/L) | 9.0±4.8 | 9.2±3.2 | 0.91 |
| 红细胞(×1012/L) | 4.3±0.6 | 4.1±0.7 | 0.30 |
| 血小板(×109/L) | 264.4±60.4 | 214.9±55.6 | 0.16 |
| 凝血酶原时间(s) | 13.3±0.5 | 13.7±0.5 | 0.14 |
| 血浆尿素氮(mmol/L) | 6.2±2.9 | 5.2±1.1 | 0.48 |
| 血清肌酐(μmol/L) | 69.4±25.6 | 63.4±13.9 | 0.64 |
| 出血停止时间(d) | 4.6±2.5 | 0.6±0.5 | < 0.01 |
2.4 介入栓塞治疗对肌酐的影响
介入栓塞治疗组患者在栓塞结束1周后检测血清肌酐水平,与栓塞前比较无统计学差异[分别为(63.0±11.9)μmol/L和(63.4±13.9)μmol/L,P = 0.96]。肾动脉造影后,介入栓塞治疗组与保守治疗组比较,肌酐水平无统计学差异[分别为(63.0±11.9)μmol/L和(70.5±11.4)μmol/L,P = 0.17]。
3 讨论急性肾出血是临床常见的泌尿外科疾病[6-7],究其原因医源性损伤占绝大部分,特别是随着经皮肾穿刺活检和经皮肾镜取石等技术在临床广泛应用,医源性肾损伤概率明显升高[8-10]。出血类型可以分为3类:急性出血型、间歇性出血型和缓慢出血型。内科止血治疗、外科手术均能发挥止血作用。介入栓塞治疗以其微创、快速、高效的特点,越来越成为临床医生的一线选择[11-13]。然而,针对肾动脉造影过程中未发现阳性出血征象的患者,临床中大多采用内科保守治疗。本研究总结了我院32例肾动脉造影阴性医源性肾出血患者手术前后的资料,通过比较发现介入栓塞能够快速止血的特点,为临床快速处理医源性肾出血提供了参考。
本组患者均为急性肾出血,其出血发生时间在肾损伤后的(3.6±3.8)d。分析这一结果的原因:一是经皮肾镜取石大量开展,用于治疗肾和输尿管结石,在穿刺、扩张、取石的过程中对血管的损伤都有可能造成急性肾出血;二是经皮肾穿刺活检的开展,穿刺切割针对肾脏小血管的损伤也会增加出血的风险[14-15]。因此,进行肾脏穿刺后,建议观察3 d以上,且术后2周内要注意迟发性出血的可能。
基于医源性肾出血的特点,绝大多数的血管损伤位于穿刺通道走形区,因此在选择性肾动脉造影过程中,要特别注意穿刺道走形区的血管损伤情况[6]。然而,临床中血管活性药物的应用、引流管的压迫、血管轻微损伤,均可能产生肾动脉造影阴性的结果。针对肾动脉造影阳性出血征象的患者,可以有的放矢的进行介入栓塞治疗。针对肾动脉造影阴性的患者,进行栓塞时要以肾损伤区域血管为靶病变,经皮肾镜取石术中置入的引流管在肾脏的投影有利于出血区域的判断,泌尿外科术者对出血区域的判断也很有价值。明确医源性操作导致的肾损伤位置,再进行栓塞操作。为了避免肾功能损伤,栓塞材料以中期栓塞材料明胶海绵为主,少部分患者使用弹簧圈,此方法能快速达到止血的目的,治疗时间较保守治疗快4 d。通过分析介入栓塞治疗前后的肌酐水平,以及对比肾动脉造影后介入栓塞治疗组与保守治疗组的肌酐水平,证实介入栓塞治疗肾动脉造影阴性的医源性肾出血相对安全。
本研究的局限性:本研究是一项回顾性研究,存在患者选择性偏倚,尤其在介入栓塞治疗上。本研究缺乏长期肌酐水平的监测,以判断对肾脏的影响。本研究样本量较小,今后需要进行多中心和大样本研究,进一步证实结论。
综上所述,急性肾出血是临床中较常见的疾病,医源性肾损伤是主要原因。对于肾动脉造影未发现阳性出血征象的患者,针对损伤区域的血管进行介入栓塞治疗,可以达到快速止血的目的,可作为治疗医源性肾出血的选择方案。
| [1] |
TURO R, HORSU S, BROOME J, et al. Complications of percutaneous nephrostomy in a district general hospital[J]. Turk J Urol, 2018, 44(6): 478-483. DOI:10.5152/tud.2018.37336 |
| [2] |
HAOCHEN W, JIAN W, LI S, et al. Superselective renal artery embolization for bleeding complications after percutaneous renal biopsy: a single-center experience[J]. J Int Med Res, 2019, 47(4): 1649-1659. DOI:10.1177/0300060519828528 |
| [3] |
刘凤永, 王茂强, 段峰, 等. 医源性肾血管损伤的急诊血管内栓塞治疗[J]. 介入放射学杂志, 2007, 16(12): 807-810. DOI:10.3969/j.issn.1008-794X.2007.12.005 |
| [4] |
DU N, MA JQ, LUO JJ, et al. The efficacy and safety of transcatheter arterial embolization to treat renal hemorrhage after percutaneous nephrolithotomy[J]. Biomed Res Int, 2019, 2019: 6265183. DOI:10.1155/2019/6265183 |
| [5] |
LIMTRAKUL T, ROMPSAITHONG U, AHOOJA A, et al. Renal artery embolization for acute renal hemorrhage: a single-center experience[J]. Res Rep Urol, 2020, 12: 315-319. DOI:10.2147/RRU.S263012 |
| [6] |
WANG C, MAO Q, TAN F, et al. Superselective renal artery embolization in the treatment of renal hemorrhage[J]. Ir J Med Sci, 2014, 183(1): 59-63. DOI:10.1007/s11845-013-0972-4 |
| [7] |
RAN R, ZHANG R, XIE Y, et al. Decreased hemoglobin as a quantifiable indicator of renal arterial embolization in post-percutaneous nephrolithotomy hemorrhage[J]. Urolithiasis, 2021, 49(2): 137-143. DOI:10.1007/s00240-020-01206-6 |
| [8] |
DONG X, REN Y, HAN P, et al. Superselective renal artery embolization management of post-percutaneous nephrolithotomy hemorrhage and its methods[J]. Front Surg, 2020, 7: 582261. DOI:10.3389/fsurg.2020.582261 |
| [9] |
任建庄, 梁惠民, 吴汉平, 等. 肾出血的血管造影诊断及经导管栓塞治疗[J]. 介入放射学杂志, 2008, 17(9): 630-633. DOI:10.3969/j.issn.1008-794X.2008.09.006 |
| [10] |
张乃文, 张祥宇, 刘炀, 等. 经皮肾镜碎石术术中及术后出血的影响因素分析[J]. 中国医科大学学报, 2012, 41(3): 275-277. DOI:10.3969/j.issn.0258-4646.2012.03.024 |
| [11] |
CONTEGIACOMO A, AMODEO EM, CINA A, et al. Renal artery embolization for iatrogenic renal vascular injuries management: 5 years' experience[J]. Br J Radiol, 2020, 93(1106): 20190256. DOI:10.1259/bjr.20190256 |
| [12] |
QIN C, ZHI X, WANG F, et al. Imaging and surgical predictive factors for postoperative hemorrhage after partial nephrectomy and clinical results of trans-arterial embolization[J]. Medicine, 2021, 100(3): e23581. DOI:10.1097/MD.0000000000023581 |
| [13] |
王充, 刘贤奎, 李鼎, 等. 经皮肾镜碎石术后迟发性大出血的介入治疗[J]. 中国医科大学学报, 2013, 42(7): 664-665. DOI:10.3969/j.issn.0258-4646.2013.07.024 |
| [14] |
PAPPAS P, CONSTANTINIDES C, LEONARDOU P, et al. Biopsyrelated hemorrhage of renal allografts treated by percutaneous superselective segmental renal artery embolization[J]. Transplant Proc, 2006, 38(5): 1375-1378. DOI:10.1016/j.transproceed.2006.02.124 |
| [15] |
IDIL SOYLU A, UZUNKAYA, BELET Ü, et al. Selective transarterial embolization of acute renal hemorrhage: a retrospective study[J]. Minim Invasive Ther Allied Technol, 2020, 29(6): 326-333. DOI:10.1080/13645706.2019.1655063 |
 2022, Vol. 51
2022, Vol. 51




