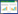文章信息
- 邵杨, 安丹蔷, 杨杨, 戴奇, 姜曼玉, 孙永新, 徐爱华
- SHAO Yang, AN Danqiang, YANG Yang, DAI Qi, JIANG Manyu, SUN Yongxin, XU Aihua
- 脊髓损伤小鼠中甘草苷通过抑制MAPK通路抑制炎症和神经元凋亡
- Liquiritin suppresses inflammation and apoptosis in a mouse model of spinal cord injury via inhibiting the MAPK signaling pathway
- 中国医科大学学报, 2022, 51(6): 518-523
- Journal of China Medical University, 2022, 51(6): 518-523
-
文章历史
- 收稿日期:2022-02-28
- 网络出版时间:2022-06-01 16:24
2. 北京市红十字会和平骨科医院康复医学科,北京 100161
2. Department of Rehabilitation Medicine, Heping Orthopaedic Hospital, Beijing Red Cross Society of China Beijing Branch, Beijing 10016, China
脊髓损伤非常常见且预后不良,据报道创伤性脊髓损伤的患病率为236/100万~4 187/100万[1]。脊髓损伤轻者丧失劳动力,重者肢体瘫痪,大小便失禁,丧失日常生活自理能力,严重影响患者的生活质量[2]。研究[3]揭示,脊髓损伤的病理生理机制主要分为两大连续阶段,第一阶段包括最初的机械损伤,随之继发的缺血缺氧损伤、电解质紊乱、神经递质蓄积、细胞坏死和凋亡、神经炎症等一系列级联瀑布反应为脊髓损伤的第二阶段。然而,目前尚无有效的治疗策略控制脊髓损伤的进展。因此,有必要寻找和开发新的治疗方法和药物,以减轻脊髓损伤。
甘草苷是从传统中药甘草中提取的一种黄酮类化合物,具有多种药理活性和潜在的应用前景,如预防炎症、缓解疼痛、营养神经和保护神经等[4]。先前的研究[5]报道,甘草苷对大脑中动脉闭塞所致的局灶性脑缺血再灌注有神经保护作用。近期研究[4]发现,甘草苷对小鼠坐骨神经慢性缩窄性损伤导致的神经性疼痛有保护作用,并且这种作用可能与甘草苷对受损神经的直接保护作用和在脊髓水平的抗炎作用有关。然而,甘草苷对脊髓损伤的神经保护作用尚未见报道。
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK) 家族包括胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、p38丝裂原活化蛋白激酶(p38 MAPK) 和c-Jun N端激酶(c-Jun N-terminal kinase,JNK),是一组在调控促炎性细胞因子表达中起重要作用的信号分子[3]。ERK/p38 MAPK/JNK信号通路在调节炎症、氧化应激和细胞凋亡方面发挥重要作用[6],该信号通路的激活有助于脊髓损伤后炎症驱动的神经组织学破坏和神经元凋亡,从而加重脊髓损伤进展[6-7]。研究[8]发现,甘草苷可通过抑制MAPK信号通路,对心肌纤维化发挥保护作用。然而,甘草苷能否通过抑制MAPK信号通路抑制脊髓损伤后炎症反应和神经元凋亡仍不清楚。因此,本研究探讨了甘草苷对脊髓损伤的保护作用,及其与炎症反应和神经元凋亡的关系。
1 材料与方法 1.1 材料 1.1.1 实验动物48只雌性C57BL/6小鼠,6~8周龄,购自辽宁长生生物科技有限公司。小鼠于空调动物房饲养,动物房内环境温度为(22±1) ℃,相对湿度为45%~55%,光照时间为12 h/12 h明暗交替。实验期间小鼠自由进食饮水。所有实验均经中国医科大学伦理委员会批准。
1.1.2 主要试剂甘草苷(美国MCE公司);全蛋白提取试剂盒、JNK抗体、p-JNK抗体、p38 MAPK抗体、p-p38 MAPK抗体、ERK抗体、p-ERK抗体、辣根过氧化物酶标记的羊抗兔IgG、内参抗体β-actin (沈阳万类生物科技有限公司);NeuN抗体、caspase 3抗体(武汉三鹰生物技术有限公司);Cy3标记山羊抗兔IgG (美国英杰生命技术有限公司);FITC标记山羊抗小鼠IgG (英国Abcam公司);髓过氧化物酶(myelopero-xidase,MPO) 试剂盒(南京建成生物工程研究所);苏木精(北京索莱宝科技有限公司);曙红Y[生工生物工程(上海) 股份有限公司];In Situ Cell Death Detection Kit (红光) (瑞士罗氏公司);甲酚紫(中国国药集团)。
1.1.3 主要仪器紫外可见分光光度计(UV752N,上海佑科仪器仪表有限公司);电泳仪(DYY-7C,北京市六一仪器厂);显微镜(BX53,日本OLYMPUS公司);石蜡切片机(RM2235,德国Leica公司)。
1.2 方法 1.2.1 脊髓损伤小鼠模型的建立[9]将小鼠适应性饲喂1周后,腹腔注射50 mg/kg戊巴比妥钠麻醉,随后以T10椎板为中心,切开皮肤,钝性剥离椎旁肌肉,暴露T9~11棘突和椎板,咬除T10棘突和椎板,采用重3 g、直径1.5 mm的撞击器,从2.5 cm高度对暴露的脊髓进行撞击,以产生中度挫伤性损伤。损伤部位存在挫伤、双下肢抽搐和尾巴痉挛性摇摆为造模成功的标志。Sham组只进行T10椎板切除术,不撞击。术后立即腹腔注射0.5 mL生理盐水(100 μL/20 g) 和丁丙诺啡(50 μg·kg-1·d-1),之后1次/d,持续4 d。进行膀胱按摩,2次/d,以防止泌尿系统感染,直到自主排尿。
1.2.2 实验分组将48只C57BL/6小鼠随机分为4组,分别为假手术组(Sham组)、脊髓损伤模型组(SCI组)、低剂量甘草苷组(LQ-L组)、高剂量甘草苷组(LQ-H组),每组12只。建模后第2天,分别给予LQ-L组和LQ-H组小鼠低剂量(30 mg/kg) 和高剂量(60mg/kg) 甘草苷灌胃给药,Sham组和SCI组给予与LQ-H组同体积的0.5%羧甲基纤维素钠溶液,1次/d,连续7 d。
1.2.3 运动功能的评估每组随机取6只小鼠,于术前和术后1、3、7、14、21 d进行小鼠后肢运动功能评分(Basso mouse scale,BMS)。观察小鼠后肢踝关节活动度、协调性、脚爪姿态、躯干稳定性和尾巴姿态。BMS评分为0~9分,评分越低,运动功能障碍越重。由3名独立评估者采用双盲法进行评分,每次观察小鼠4 min,取3名评估者评分的平均值作为最终得分。
1.2.4 HE染色给药完成后每组随机取3只小鼠,腹腔注射200 mg/kg戊巴比妥钠麻醉处死,以损伤点为中心,取纵向离损伤点5 mm以内的脊髓组织,用4%多聚甲醛固定24 h,包埋切片(切片厚度为5 μm),取纵向距离损伤中心2 mm处的脊髓切片,脱蜡至水后进行HE染色,脱水封片后于40倍镜下观察脊髓组织病变面积,相对病变面积(%) =炎症面积/脊髓面积×100。
1.2.5 比色法测定MPO活性给药完成后每组随机取3只小鼠,腹腔注射200 mg/kg戊巴比妥钠麻醉处死,以损伤点为中心,取纵向离损伤点5 mm以内的脊髓组织,准确称取组织质量,按照试剂盒说明书方法操作,将样品制备成5%的组织匀浆,取制备好的组织匀浆按照说明书依次加入试剂后混匀,60 ℃水浴10 min,取出后立即在波长460 nm处测定各孔吸光度值,计算MPO活性,以间接评估中性粒细胞浸润情况。MPO活性(U/g组织湿质量) = (测定OD值-对照OD值) / (11.3×取样量)。
1.2.6 TUNEL染色取上述制备的3只小鼠脊髓组织石蜡切片,脱蜡至水后利用TUNEL反应液染色,DAPI染核后利用荧光猝灭剂封片,于400倍镜下观察脊髓组织中细胞凋亡情况。
1.2.7 免疫荧光染色取上述制备的3只小鼠脊髓组织石蜡切片,脱蜡至水后利用NeuN和caspase 3 (稀释比例1∶100) 4 ℃孵育过夜,按照1∶200稀释比例于室温孵育二抗90 min,滴加DAPI复染核,荧光猝灭剂封片后于400倍镜下观察脊髓组织中NeuN、caspase 3的共定位,分析caspase 3阳性细胞数量。
1.2.8 Nissl染色取上述制备的3只小鼠脊髓组织石蜡切片,脱蜡至水后进行甲酚紫染色,冰醋酸乙醇分化、脱水封片后,于400倍镜下观察脊髓组织中神经元丢失情况。
1.2.9 Western blotting取上述未经固定的3只小鼠的脊髓组织,利用全蛋白提取试剂盒抽提组织总蛋白,BCA蛋白浓度测定试剂盒定量,按照40 μg蛋白上样进行SDS-PAGE电泳,转膜,5%脱脂奶粉进行封闭,4 ℃过夜孵育一抗(JNK、p-JNK、p38 MAPK、p-p38 MAPK、ERK、p-ERK、β-actin抗体按照1∶500稀释),按照1∶5 000稀释比例于37 ℃、45 min孵育二抗。ECL底物发光后,扫描胶片,采用凝胶图像处理系统(Gel-Pro-Analyzer软件) 分析目标条带的灰度值。
1.3 统计学分析采用SPSS 20软件进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD检验。BMS评分的比较采用Kruskal-Wallis检验。P < 0.05为差异有统计学意义。
2 结果 2.1 甘草苷对脊髓损伤小鼠运动功能的影响术后第1、3、7、14、21天,与Sham组比较,SCI组和LQ-L组的BMS评分均明显下降(P < 0.01或0.05)。术后第1天,与Sham组比较,LQ-H组BMS评分明显下降(P < 0.01),而术后第3、7、14、21天,2组比较差异均无统计学意义(P > 0.05)。术后第14、21天,与SCI组比较,LQ-H组BMS评分明显升高(P < 0.05),而术后第1、3、7天,2组比较差异均无统计学意义(P > 0.05)。术后第1、3、7、14、21天,SCI组、LQ-H组与LQ-L组比较,BMS评分的差异均无统计学意义(P > 0.05)。见表 1。
| Group | n | Day 0 | Day 1 | Day 3 | Day 7 | Day 14 | Day 21 |
| Sham | 6 | 9.00±0.00 | 9.00±0.00 | 9.00±0.00 | 9.00±0.00 | 9.00±0.00 | 9.00±0.00 |
| SCI | 6 | 9.00±0.00 | 0.50±0.551) | 0.67±0.522) | 1.17±0.752) | 1.67±0.522) | 2.17±0.752) |
| LQ-L | 6 | 9.00±0.00 | 0.50±0.551) | 1.33±0.521) | 2.33±0.521) | 3.00±0.631) | 3.50±0.551) |
| LQ-H | 6 | 9.00±0.00 | 0.33±0.522) | 2.17±1.17 | 4.33±1.37 | 4.83±1.173) | 5.33±1.033) |
| 1) P < 0.05 vs Sham group;2) P < 0.01 vs Sham group;3) P < 0.05 vs SCI group. BMS,Basso Mouse Scale;Sham,sham-operation group;SCI,spinal cord injury model group;LQ-L,low-dose liquiritin group;LQ-H,high-dose liquiritin group. | |||||||
2.2 甘草苷对脊髓损伤小鼠脊髓组织病变面积的影响
HE染色结果显示:Sham组、SCI组、LQ-L组、LQ-H组脊髓组织相对病变面积分别为(0.00±0.00) %、(49.10±14.65) %、(31.30±8.24) %、(12.52±3.44) %。与Sham组比较,SCI组、LQ-L组、LQ-H组相对病变面积明显增加(P < 0.01);LQ-L组、LQ-H组与SCI组比较,LQ-H组与LQ-L组比较,相对病变面积明显减小(P < 0.05或0.01)。见图 1。
|
| A, sham-operation group; B, spinal cord injury model group; C, low-dose liquiritin group; D, high-dose liquiritin group. 图 1 脊髓组织HE染色结果 ×40 Fig.1 and eosin staining of the spinal cord tissues ×40 |
2.3 甘草苷对脊髓损伤小鼠脊髓组织中中性粒细胞浸润的影响
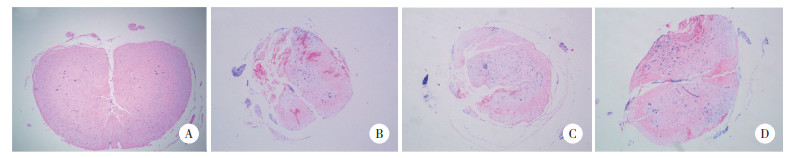
将MPO活性作为中性粒细胞浸润的间接测量指标,确定脊髓损伤后的炎症状况。与Sham组比较,SCI组、LQ-L组、LQ-H组MPO活性明显增加(P < 0.05或0.01);SCI组与LQ-L组比较,差异无统计学意义(P > 0.05);LQ-H组与SCI组、LQ-L组比较,MPO活性明显下调(P < 0.05或0.01)。见图 2。
|
| Sham, sham-operation group; SCI, spinal cord injury model group; LQ-L, low-dose liquiritin group; LQ-H, high-dose liquiritin group. * P < 0.05 vs Sham group; ** P < 0.01 vs Sham group; ## P < 0.01 vs SCI group; △ P < 0.05 vs LQ-L group. 图 2 4组脊髓组织中MPO活性的比较 Fig.2 Comparison of the MPO activity in the spinal cord tissues among the four groups |
2.4 甘草苷对脊髓损伤小鼠脊髓组织中细胞凋亡的影响
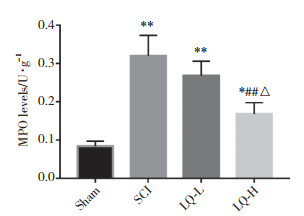
TUNEL染色显示:Sham组脊髓切片上仅有极少量散在的凋亡细胞;与Sham组比较,SCI组、LQ-L组凋亡细胞数大量增加;与Sham组比较,LQ-H组凋亡细胞数量增加较少;,LQ-H、LQ-L组与SCI组比较,LQ-H组与LQ-L组比较,凋亡细胞均减少。见图 3。
|
| Sham, sham-operation group; SCI, spinal cord injury model group; LQ-L, low-dose liquiritin group; LQ-H, high-dose liquiritin group. 图 3 4组脊髓组织中细胞凋亡情况 ×400 Fig.3 Cell apoptosis in the spinal cord tissues in the four groups ×400 |
2.5 甘草苷对脊髓损伤小鼠脊髓组织中神经元丢失的影响
Nissl染色结果显示(图 4A):与Sham组比较,SCI组、LQ-L组、LQ-H组小鼠脊髓切片中神经元细胞密度均降低;LQ-L组、LQ-H组与SCI组比较,LQ-H组与LQ-L组比较,神经元细胞密度增加。
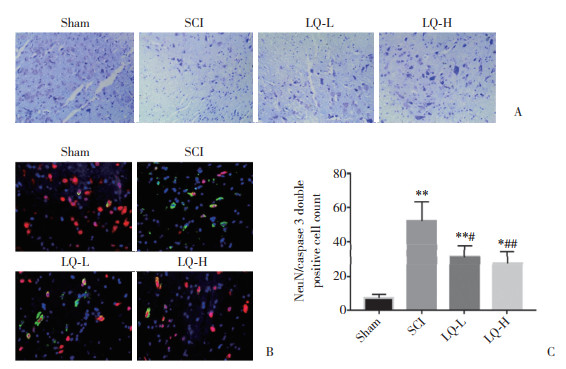
|
| A, Nissl staining (×200);B, immunofluorescence staining (×400);C, statistical results of Neun/caspase 3 double positive cells. Sham, sham-operation group; SCI, spinal cord injury model group; LQ-L, low-dose liquiritin group; LQ-H, high-dose liquiritin group. * P < 0.05 vs Sham group; ** P < 0.01 vs Sham group; # P < 0.05 vs SCI group; ## P < 0.01 vs SCI group. 图 4 4组脊髓组织中神经元丢失情况 Fig.4 Loss of neurons in the spinal cord tissues in the four groups |
免疫荧光染色显示(图 4B、4C):与Sham组比较,SCI组、LQ-L组、LQ-H组caspase 3标记的神经元细胞数量明显增加(P < 0.05或0.01);与SCI组比较,LQ-L组、LQ-H组caspase 3标记的神经元细胞数量明显减少(P < 0.05或0.01);LQ-L组与LQ-H组比较,差异无统计学意义(P > 0.05)。
2.6 甘草苷对脊髓损伤小鼠脊髓组织中MAPK通路蛋白表达的影响Western blotting结果显示:与Sham组比较,SCI组、LQ-L组小鼠脊髓组织中p-ERK、p-p38 MAPK和p-JNK蛋白表达明显上调(P < 0.05或0.01);与Sham组比较,LQ-H组p-ERK和p-JNK蛋白表达明显上调(P < 0.05),但p-p38 MAPK蛋白表达的差异无统计学意义(P > 0.05);与SCI组比较,LQ-L组、LQ-H组p-ERK、p-p38 MAPK和p-JNK蛋白表达明显下调(P < 0.05或0.01);与LQ-L组比较,LQ-H组p-ERK和p-p38 MAPK蛋白表达明显下调(P < 0.05),但p-JNK蛋白表达的差异无统计学意义(P > 0.05)。见图 5。
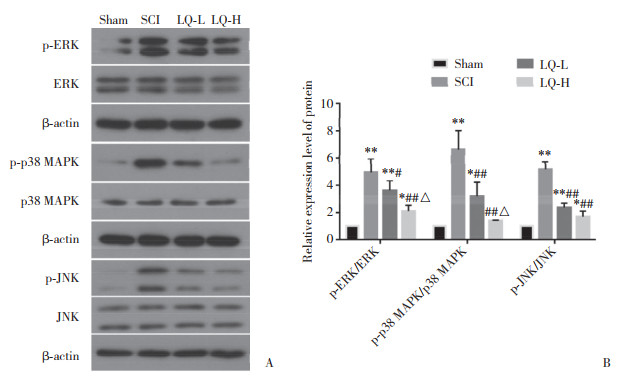
|
| A, Western blotting results; B, relative expression levels of p-ERK/ERK, p-p38 MAPK/MAPK, and p-JNK/JNK. Sham, sham-operation group; SCI, spinal cord injury model group; LQ-L, low-dose liquiritin group; LQ-H, high-dose liquiritin group. * P < 0.05 vs Sham group; ** P < 0.01 vs Sham group; # P < 0.05 vs SCI group; ## P < 0.01 vs SCI group; △ P < 0.05 vs LQ-L group. 图 5 4组脊髓组织中MAPK通路蛋白的表达情况 Fig.5 Expressions of the MAPK pathway proteins in the spinal cord tissues in the four groups |
3 讨论
本研究结果表明,甘草苷能显著改善脊髓损伤小鼠的运动功能,这主要与减少细胞凋亡和炎症反应有关。研究[10]报道,脊髓损伤后血脊髓屏障的破坏导致包括中性粒细胞在内的细胞浸润,形成强烈的局部炎症,导致细胞死亡和永久性神经功能障碍。本研究通过HE染色和检测损伤组织中MPO活性,发现甘草苷可以显著减小损伤后的炎症区域和降低中性粒细胞的浸润程度。本研究结果与既往甘草苷通过抑制炎症损伤减轻野百合碱诱导的肝窦阻塞综合征的研究[11]结果相似,证明甘草苷可通过抑制炎症损伤和中性粒细胞浸润,对小鼠脊髓损伤发挥神经保护作用。
凋亡是脊髓损伤后脊髓的一个显著特征,表现为细胞核DNA断裂和caspase激活[12]。本研究在损伤后的小鼠脊髓组织中检测到凋亡的神经元,脊髓损伤后损伤部位的神经元可检测到caspase激活。caspase是凋亡程序的重要执行者[13],其中caspase 3可在各种类型的中枢神经系统细胞凋亡过程中被激活,其激活可能是中枢神经系统中的关键凋亡事件。本研究发现,脊髓损伤后神经元中的caspase 3被激活,表达活化caspase 3的神经元数量显著增多,同时Nissl染色结果也显示神经元密度降低。而在甘草苷治疗后,caspase 3活化及神经元丢失情况明显改善。结果说明,甘草苷对脊髓损伤的缓解作用至少部分是通过减少caspase 3的激活、抑制细胞凋亡实现的。
MAPK通路在脊髓损伤的病理生理学中起关键作用[3, 7]。既往研究[14]表明,脊髓损伤后,MAPK信号通路在神经元、小胶质细胞/巨噬细胞和星形胶质细胞中被激活,并参与调节慢性疼痛。脊髓损伤后抑制MAPK通路可显示不同的结果,如减轻炎症或减少凋亡。研究[8]报道,甘草苷可通过抑制MAPK信号通路对心肌纤维化发挥保护作用。本研究结果表明,ERK、p38 MAPK和JNK的激活与脊髓损伤有关。值得注意的是,甘草苷治疗显著降低了脊髓损伤小鼠脊髓组织中ERK、p38 MAPK和JNK的磷酸化。结果证明,甘草苷在一定程度上是通过阻断MAPK信号通路发挥作用的。
综上所述,本研究结果表明,甘草苷可以显著恢复脊髓损伤小鼠运动功能;此外,甘草苷显著抑制脊髓损伤小鼠脊髓组织炎症和神经元凋亡,这些作用主要是通过甘草苷对MAPK通路的抑制作用实现的。本研究结果提示,甘草苷可能对脊髓损伤具有一定的治疗效果。
| [1] |
SCHREIBER AF, GARLASCO J, VIEIRA F, et al. Separation from mechanical ventilation and survival after spinal cord injury: a syste- matic review and meta-analysis[J]. Ann Intensive Care, 2021, 11(1): 149. DOI:10.1186/s13613-021-00938-x |
| [2] |
SHIAO R, LEE-KUBLI CA. Neuropathic pain after spinal cord injury: challenges and research perspectives[J]. Neurotherapeutics, 2018, 15(3): 635-653. DOI:10.1007/s13311-018-0633-4 |
| [3] |
LIU Z, YAO X, JIANG W, et al. Advanced oxidation protein products induce microglia-mediated neuroinflammation via MAPKs-NF-κB signaling pathway and pyroptosis after secondary spinal cord injury[J]. J Neuroinflammation, 2020, 17(1): 90. DOI:10.1186/s12974-020-01751-2 |
| [4] |
ZHANG MT, WANG B, JIA YN, et al. Neuroprotective effect of li- quiritin against neuropathic pain induced by chronic constriction injury of the sciatic nerve in mice[J]. Biomed Pharmacother, 2017, 95: 186-198. DOI:10.1016/j.biopha.2017.07.167 |
| [5] |
SUN YX, TANG Y, WU AL, et al. Neuroprotective effect of liquiritin against focal cerebral ischemia/reperfusion in mice via its antioxidant and antiapoptosis properties[J]. J Asian Nat Prod Res, 2010, 12(12): 1051-1060. DOI:10.1080/10286020.2010.535520 |
| [6] |
REN J, SU D, LI L, et al. Anti-inflammatory effects of Aureusidin in LPS-stimulated RAW264.7 macrophages via suppressing NF-κB and activating ROS- and MAPKs-dependent Nrf2/HO-1 signaling pathways[J]. Toxicol Appl Pharmacol, 2020, 387: 114846. DOI:10.1016/j.taap.2019.114846 |
| [7] |
WANG JL, REN CH, FENG J, et al. Oleanolic acid inhibits mouse spinal cord injury through suppressing inflammation and apoptosis via the blockage of p38 and JNK MAPKs[J]. Biomed Pharmacother, 2020, 123: 109752. DOI:10.1016/j.biopha.2019.109752 |
| [8] |
ZHANG Y, ZHANG L, ZHANG Y, et al. The protective role of liqui- ritin in high fructose-induced myocardial fibrosis via inhibiting NF-κB and MAPK signaling pathway[J]. Biomed Pharmacother, 2016, 84: 1337-1349. DOI:10.1016/j.biopha.2016.10.036 |
| [9] |
WANG C, ZHANG L, NDONG JC, et al. Progranulin deficiency exa- cerbates spinal cord injury by promoting neuroinflammation and cell apoptosis in mice[J]. J Neuroinflammation, 2019, 16(1): 238. DOI:10.1186/s12974-019-1630-1 |
| [10] |
HE Z, ZOU S, YIN J, et al. Inhibition of endoplasmic reticulum stress preserves the integrity of blood-spinal cord barrier in diabetic rats subjected to spinal cord injury[J]. Sci Rep, 2017, 7(1): 7661. DOI:10.1038/s41598-017-08052-4 |
| [11] |
HUANG Z, ZHAO Q, CHEN M, et al. Liquiritigenin and liquiritin alleviated monocrotaline-induced hepatic sinusoidal obstruction syndrome via inhibiting HSP60-induced inflammatory injury[J]. Toxicology, 2019, 428: 152307. DOI:10.1016/j.tox.2019.152307 |
| [12] |
ZHAO H, CHEN S, GAO K, et al. Resveratrol protects against spinal cord injury by activating autophagy and inhibiting apoptosis mediated by the SIRT1/AMPK signaling pathway[J]. Neuroscience, 2017, 348: 241-251. DOI:10.1016/j.neuroscience.2017.02.027 |
| [13] |
LOSSI L, CASTAGNA C, MERIGHI A. Caspase-3 mediated cell death in the normal development of the mammalian cerebellum[J]. Int J Mol Sci, 2018, 19(12): 3999. DOI:10.3390/ijms19123999 |
| [14] |
TAKEURA N, NAKAJIMA H, WATANABE S, et al. Role of macrophages and activated microglia in neuropathic pain associated with chronic progressive spinal cord compression[J]. Sci Rep, 2019, 9(1): 15656. DOI:10.1038/s41598-019-52234-1 |
 2022, Vol. 51
2022, Vol. 51