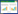文章信息
- 曹会茹, 徐阳, 王华德, 文普帅
- CAO Huiru, XU Yang, WANG Huade, WEN Pushuai
- 结直肠癌组织中CISD2的表达及其对5-氟尿嘧啶化疗敏感性的影响
- Expression of CISD2 in colorectal cancer tissues and its effect on sensitivity to 5-fluorouracil chemotherapy
- 中国医科大学学报, 2022, 51(5): 429-434
- Journal of China Medical University, 2022, 51(5): 429-434
-
文章历史
- 收稿日期:2021-05-09
- 网络出版时间:2022-05-23 16:14
2. 锦州医科大学 生物人类学研究所,辽宁 锦州 121001
2. Biological Anthropology Institute, Jinzhou Medical University, Jinzhou 121001, China
研究[1]显示,我国结直肠癌发病率及死亡率均较高。目前,结直肠癌广泛使用的治疗方法是5-氟尿嘧啶(5-fluorouracil,5-FU)及以5-FU为基础的联合化疗,但5-FU耐药性限制了其在临床中的应用[2]。因此,降低5-FU耐药性,提高肿瘤对5-FU的敏感性是提高化疗疗效、改善结直肠癌的预后关键。CDGSH铁硫结构域2(CDGSH iron-sulfur domain 2,CISD2)是CDGSH铁硫结构域蛋白家族成员,具有调控线粒体完整性和功能、钙代谢、氧化还原反应等作用[3]。研究证明,CISD2能增强乳腺癌细胞的增殖和侵袭能力[4];前列腺癌中高表达的CISD2能促进细胞的侵袭和迁移,并预示预后不良[5];胃癌中CISD2增强癌细胞对5-FU的化疗敏感性[6]。目前,关于CISD2对结直肠癌的作用及临床意义研究未见报道。本研究探讨结直肠癌组织中CISD2的表达,分析其表达水平与临床指标的关系;同时探讨CISD2表达对5-FU敏感性的影响及分子机制,旨在为改善5-FU治疗结直肠癌的效果提供新的思路。
1 材料与方法 1.1 组织细胞和主要试剂选取锦州医科大学附属第一医院普外科手术切除25例患者的新鲜结直肠癌与癌旁组织,癌旁组织为癌组织边缘 > 2 cm组织,于-80 ℃冰箱保存。纳入标准:术前未接受过放疗、化疗,经病理诊断为结直肠癌。本研究经锦州医科大学附属第一医院伦理委员会批准(批号:201923),患者家属知情同意。50例人结直肠癌组织微阵列由上海芯超生物技术有限公司完成。抗CISD2、caspase-3和β-actin抗体购自美国Proteintech公司;抗ATG5、Beclin 1、LC3-Ⅱ/Ⅰ、AKT和p-AKT抗体购自美国Cell Signaling Technology公司;反转试剂盒、荧光定量PCR试剂盒购自加拿大Applied Biological Materials公司。
1.2 方法 1.2.1 Oncomine数据库CISD2 mRNA水平分析分析Oncomine平台(http://www.oncomine.org)结直肠癌和匹配的正常组织中CISD2 mRNA的表达水平,筛选标准为P < 0.05。
1.2.2 细胞培养和转染HCT116和HCT8肿瘤细胞株分别用含有10%的胎牛血清的McCoy 5A和L-15培养基,置于37 ℃、5% CO2培养箱中培养。取对数生长期的细胞,按Lipofectamine 3000转染试剂盒方法转染。
1.2.3 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)TRIzol试剂提取组织中的RNA,采用反转录试剂盒进行反转录合成cDNA,以cDNA为模板,采用荧光定量PCR试剂盒和ABI 7500实时PCR系统进行定量PCR反应,重复实验3次,以18S rRNA为内参;CISD2,正向引物5’-CACCGAGTCGTAGTCGAG
GT-3’,反向引物5’-TTTCGGGTAGTGGAAAACC
A-3’;18S rRNA,正向引物5’-GTAACCCGTTGAAC
CCCATT -3’,反向引物5’-CCATCCAATCGGTAGTA
GCG-3’。CISD2的表达水平采用2-ΔΔCt法进行计算。
1.2.4 免疫组化检测人结直肠癌组织芯片经烘蜡、脱蜡、抗原修复、一抗孵育、封闭、二抗孵育、染色后,每个切片随机选择5个视野,Image J软件评估各视野CISD2平均光密度(average optical density,AOD)来判定CISD2的表达水平,AOD=积分光密度/面积。各视野下的染色强度及阳性细胞百分比评价:0分,无着色;1分,浅黄色;2分,棕黄色;3分,棕褐色。阳性细胞0~5%,0分;6%~25%,1分;26%~50%,2分;51%~75%,3分;76%~100%,4分。染色强度及阳性细胞百分比评分之和记为总分,0~2分为CISD2阴性表达,3~7为CISD2阳性表达。
1.2.5 MTT法检测细胞活力将细胞分为对照组(转染空载质粒)、过表达CISD2组(转染CISD2表达质粒)、单纯5-FU处理组(10 µmol/L或20 µmol/L 5-FU处理24 h)、过表达CISD2和5-FU联合组(转染CISD2表达质粒,同时给予10 µmol/L或20 µmol/L 5-FU处理24 h)。取各组5×103个细胞悬液接种于96孔板,加入20 µL MTT试剂后,置于37 ℃培养箱中4 h,测定波长570 nm的吸光度(optical density,OD)值。
1.2.6 Western blotting检测取对照组、过表达CISD2组、单纯5-FU处理组、过表达CISD2和5-FU联合组的蛋白样品经电泳分离,转膜、封闭,4 ℃孵育β-actin、CISD2、ATG5、Beclin 1、LC3-Ⅱ/Ⅰ、AKT和p-AKT一抗,过夜,次日洗膜、二抗孵育、ECL显色、利用Image J软件分析各组条带灰度值。
1.3 统计学分析采用SPSS 18.0软件进行统计学分析。正态分布的计量资料以x±s表示,2组比较采用t检验分析,计数资料采用率(%)表示,组间比较采用χ2检验,P < 0.05为差异有统计学意义。
2 结果 2.1 结直肠癌组织及癌旁组织中CISD2的表达及其与临床病理特征的关系qRT-PCR结果显示,结直肠癌组织中CISD2 mRNA表达水平为0.03±0.06,明显低于癌旁组织(1.02±0.32,P < 0.000 1,图 1A)。Oncomine数据库多个结直肠数据集样本中CISD2 mRNA水平也明显降低(图 1B)。
|
| A, the expression of CISD2 in colorectal cancer detected by qRT-PCR; B, mRNA level of CISD2 in the colorectal datasets in Oncomine database; C, immunohistochemical staining of CISD2 in colorectal cancer(×200); D, quantification of CISD2 protein expression between Ctr and CRC groups. *P < 0.000 1 vs Ctr group. Ctr, adjacent non-cancer tissues; CRC, colorectal cancer; AOD, average optical density. 图 1 结直肠癌组织及癌旁组织中CISD2的表达 Fig.1 CISD2 expression in colorectal cancer (CRC) tissues and adjacent non-cancer tissues |
免疫组化染色结果显示,CISD2主要定位于细胞质中。与癌旁组织(0.39±0.06)比较,CRC组织(0.35±0.04)CISD2表达显著减少(P < 0.01),见图 1C、1D。
2.2 结直肠癌组织中CISD2表达及其与患者临床指标的关系结果显示,CISD2的表达阳性率与M期(P = 0.03)相关,而与性别、年龄、TNM分期、T期、N期和淋巴结总数不相关,见表 1。
| Item | n | CISD2 [n(%)] | χ2 | P | |
| Negative | Positive | ||||
| Sex | 0.02 | 0.88 | |||
| Male | 31 | 14(45.16) | 17(54.84) | ||
| Female | 19 | 9(47.37) | 10(52.63) | ||
| Age | 0.67 | 0.41 | |||
| < 60 years | 26 | 10(38.46) | 16(61.54) | ||
| ≥60 years | 24 | 12(50.00) | 12(50.00) | ||
| TNM stage | 0.10 | 0.75 | |||
| Ⅰ+Ⅱ | 38 | 17(44.74) | 21(55.26) | ||
| Ⅲ+Ⅳ | 12 | 6(50.00) | 6(50.00) | ||
| T stage | 1.16 | 0.28 | |||
| T1/T2 | 22 | 12(54.55) | 10(45.55) | ||
| T3/T4 | 28 | 11(39.29) | 17(60.71) | ||
| N stage | 1.04 | 0.31 | |||
| N0/N1 | 42 | 18(42.86) | 24(57.14) | ||
| N2 | 8 | 5(62.50) | 3(37.50) | ||
| M stage | 4.73 | 0.03 | |||
| M0 | 36 | 20(55.56) | 16(44.44) | ||
| M1 | 14 | 3(21.43) | 11(78.57) | ||
| Lymph node number | 0.88 | 0.35 | |||
| < 10 | 20 | 10(50.00) | 10(50.00) | ||
| ≥10 | 30 | 11(36.67) | 19(63.33) | ||
2.3 CISD2的表达对结直肠癌细胞5-FU敏感性的影响
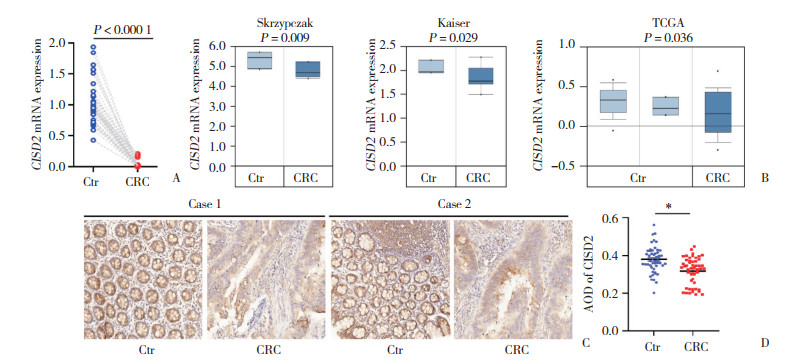
MTT实验结果显示,10、20 μmol/L5-FU处理HCT8细胞后,细胞活力分别为0.19±0.02和0.17±0.03,与对照组(0.33±0.02)比较,CRC细胞活力下降(t = 10.50,P < 0.000 1;t = 9.45,P < 0.000 1;图 2A);CISD2过表达联合5-FU(10、20 μmol/L)作用细胞时,细胞活力分别为0.16±0.01和0.12±0.01,显著低于单纯5-FU处理组细胞活力(t = 3.58,P < 0.01;t = 7.04,P < 0.000 1),见图 2A。HCT116细胞中的实验结果与HCT8细胞类似,见图 2B。
|
| A, HCT8 cells; B HCT116 cells. * P < 0.05, ** P < 0.01, *** P < 0.001, **** P < 0.000 1. 图 2 过表达CISD2对结直肠癌细胞5-FU敏感性的影响 Fig.2 Effect of overexpression of CISD2 on the sensitivity of colorectal cancer cells to 5-FU |
2.4 5-FU对结直肠癌细胞CISD2表达的影响
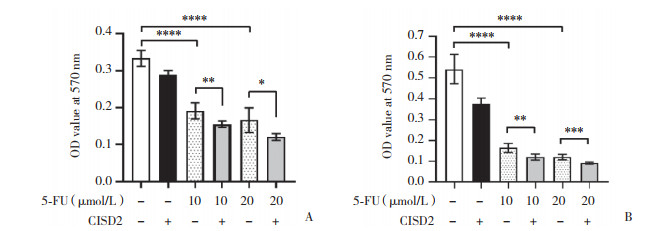
Western blotting结果显示,在HCT8和HCT116细胞中,与对照组比较,5、10、20 μmol/L 5-FU处理24 h后CISD2蛋白水平显著升高,差异均有统计学意义(均P < 0.05),见图 3、表 2。
|
| 1,control group;2,5 μmol/L 5-FU group;3,10 μmol/L 5-FU group;4,20 μmol/L 5-FU group. 图 3 5-FU诱导结直肠癌细胞中CISD2的表达 Fig.3 Effects of 5-FU treatment on expression of CISD2 in colorectal cancer cells |
| Group | CISD2 protein expression | |
| HCT8 cells | HCT116 cells | |
| Control | 1.00±0.03 | 1.00±0.04 |
| 5 μmol/L 5-FU | 1.27±0.121) | 1.18±0.071) |
| 10 μmol/L 5-FU | 1.33±0.102) | 1.15±0.051) |
| 20 μmol/L 5-FU | 1.30±0.111) | 1.14±0.031) |
| 1)P < 0.05,2)P < 0.01 vs control group. | ||
2.5 CISD2对结直肠癌细胞ATG5、Beclin 1、LC3-Ⅱ/Ⅰ、caspase-3、活化caspase-3、AKT和p-AKT表达水平的影响
结果显示,与对照组HCT8和HCT116细胞比较,单纯5-FU处理组细胞中自噬蛋白Beclin 1、ATG5和LC3-Ⅱ/Ⅰ显著增高。与单纯5-FU处理组HCT8和HCT116细胞相比,过表达CISD2联合5-FU处理组细胞中Beclin 1、ATG5和LC3-Ⅱ/Ⅰ蛋白水平降低而凋亡蛋白活化的caspase-3表达水平明显增高。与对照组HCT8和HCT116细胞相比,单纯5-FU处理组细胞中p-AKT表达水平降低;而与单纯5-FU处理组相比,过表达CISD2联合5-FU处理组细胞中p-AKT表达升高,见图 4,表 3、4。
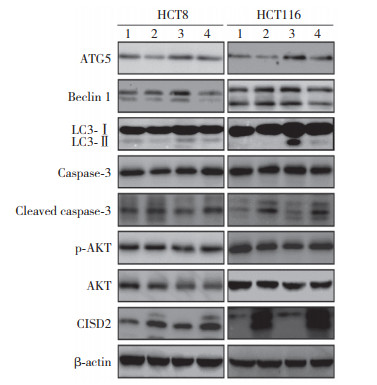
|
| 1, control group; 2, CISD2 overexpression group; 3, 5-FU group; 4, CISD2 overexpression and 5-FU combined group. 图 4 CISD2对5-FU诱导结直肠癌细胞自噬和凋亡相关蛋白的影响 Fig.4 Effect of CISD2 on 5-FU-induced autophagy and apoptosis-related proteins in colorectal cancer cells |
| Group | ATG5 | Beclin 1 | LC3-Ⅱ/Ⅰ | p-AKT | Cleaved caspase-3 |
| Control | 1.000±0.006 | 1.000±0.012 | 1.000±0.010 | 1.000±0.038 | 1.000±0.062 |
| CISD2 overexpression | 0.976±0.057 | 1.002±0.018 | 0.808±0.022 | 1.090±0.099 | 1.919±0.033 |
| 5-FU | 1.500±0.1871) | 1.515±0.1681) | 1.925±0.0501) | 0.837±0.0972) | 1.372±0.298 |
| CISD2+5-FU | 1.016±0.0523) | 1.076±0.1063) | 0.703±0.0423) | 1.293±0.1234) | 2.096±0.0534) |
| 1)P < 0.01,2)P < 0.05 vs control group;3)P < 0.01,4)P < 0.05 vs 5-FU group. CISD2+5-FU,CISD2 overexpression and 5-FU combined. | |||||
| Group | ATG5 | Beclin 1 | LC3-Ⅱ/Ⅰ | p-AKT | Cleaved caspase-3 |
| Control | 1.000±0.029 | 1.000±0.013 | 1.000±0.015 | 1.000±0.035 | 1.000±0.020 |
| CISD2 overexpression | 0.988±0.019 | 0.979±0.014 | 0.935±0.119 | 1.106±0.079 | 1.986±0.034 |
| 5-FU | 1.517±0.0531) | 1.379±0.0772) | 20.52±0.0472) | 0.858±0.0681) | 0.999±0.026 |
| CISD2+5-FU | 1.027±0.0333) | 0.993±0.0673) | 3.757±0.0824) | 1.488±0.1024) | 2.163±0.0894) |
| 1)P < 0.05,2)P < 0.01 vs control group;3)P < 0.05,4)P < 0.01 vs 5-FU group. CISD2+5-FU,CISD2 overexpression and 5-FU combined. | |||||
3 讨论
CISD2与多种肿瘤的发生与演进密切相关。CISD2能激活Wnt/β-catenin信号通路促进胰腺癌细胞增殖[7];CISD2缺失能抑制神经母细胞瘤细胞增殖和分化;WANG等[8]发现胃癌中CISD2表达水平增高,并调控AKT途径促进癌细胞增殖,这些研究提示CISD2在肿瘤中扮演癌基因的作用。但也有研究结果与之相悖,SUN等[6]发现胃癌中CISD2的表达水平显著下调,并能增强胃癌细胞对5-FU的敏感性。由此可见,CISD2在肿瘤中的角色仍有争议。本研究发现,CISD2在结直肠癌组织中表达显著下调,与结直肠癌患者的M分期有关。同时,CISD2可能通过AKT通路抑制自噬而增强结直肠癌细胞对5-FU的敏感性。
当前,5-FU仍然是结直肠癌治疗不可或缺的药物。自5-FU广泛用于Ⅰ期结直肠癌治疗后,5-FU/亚叶酸治疗方案已成为结直肠癌标准治疗方案[9]。但是,5-FU的耐药性也成为治疗失败的主要原因。细胞自噬是真核生物中进化保守的、对细胞内物质进行周转利用的重要过程[10]。研究[11]表明,癌细胞可依赖自噬来进行细胞保护以应对不利的微环境,如营养缺乏、缺氧、缺乏生长因子、存在化疗或某些靶向疗法介导的耐药性等。因此,自噬抑制剂联合5-FU治疗在癌症治疗中展现出巨大潜力。5-FU联合自噬抑制剂3-甲基腺嘌呤显著提高5-FU在肺癌和结直肠癌的治疗效果[9, 12]。本研究发现,5-FU处理结直肠癌细胞时,自噬相关蛋白ATG5、Beclin 1和LC3-Ⅱ/Ⅰ水平增高,提示5-FU引起了结直肠癌细胞的自噬,而过表达CISD2显著抑制了5-FU诱导的结直肠癌细胞中的自噬过程,这也与胃癌中CISD2的作用一致[6]。因此,CISD2可作为潜在的干预靶点来解决5-FU耐药性问题。
研究[13]发现,PI3K/Akt/mTOR信号通路是抑制自噬的主要途径。外界信号刺激诱导PI3K调节亚基p85的SH2结构域磷酸化,催化亚基p110解除抑制而激活PI3K,而引起AKT第308位点苏氨酸和473位点丝氨酸磷酸化,活化后的AKT激活mTOR而抑制自噬[14]。研究显示,PI3K/AKT/mTOR途径调控细胞自噬而影响肿瘤对5-FU药物的敏感性。TSPAN9下调PI3K/AKT/mTOR途径激活自噬而降低胃癌细胞对5-FU的敏感性[15];辣椒素显著增加胆管癌细胞对5-FU敏感性,其机制是辣椒素激活PI3K/AKT/mTOR途径而抑制5-FU激活的自噬[16];胃癌细胞中CISD2也经PI3K/AKT/mTOR信号通路抑制5-FU诱导的自噬而增强癌细胞对5-FU的敏感性[6]。本研究中CISD2逆转了5-FU下调AKT磷酸化的作用,并抑制5-FU诱导的结直肠癌细胞自噬过程,提示CISD2可能经PI3K/AKT/mTOR途径抑制自噬而增强结直肠癌细胞对5-FU的敏感性。
综上所述,本研究发现CISD2在结直肠癌组织中表达下调,其过表达能增强结直肠癌对5-FU的敏感性,此作用可能是通过激活AKT/mTOR通路抑制自噬而实现的。靶向CISD2可能增加结直肠癌组织对5-FU的化疗敏感性,同时也可能是解决5-FU耐药问题的潜在方向。
| [1] |
CHEN W, SUN K, ZHENG R, et al. Cancer incidence and mortality in China, 2014[J]. Chin J Cancer Res, 2018, 30(1): 1-12. DOI:10.21147/j.issn.1000-9604.2018.01.01 |
| [2] |
ALNUQAYDAN AM, RAH B, ALMUTARY AG, et al. Synergistic antitumor effect of 5-fluorouracil and withaferin-A induces endoplasmic reticulum stress-mediated autophagy and apoptosis in colorectal cancer cells[J]. Am J Cancer Res, 2020, 10(3): 799-815. |
| [3] |
YEH CH, CHOU YJ, KAO CH, et al. Mitochondria and calcium homeostasis: cisd2 as a big player in cardiac ageing[J]. Int J Mol Sci, 2020, 21(23): 9238. DOI:10.3390/ijms21239238 |
| [4] |
刘壮凯, 白静慧, 张瑞山, 等. CISD2在乳腺癌组织中的表达及其对人乳腺癌MCF-7细胞增殖与侵袭的影响[J]. 解剖科学进展, 2020, 26(2): 140-142. DOI:10.16695/j.cnki.1006-2947.2020.02.005 |
| [5] |
ZHU QQ, TIAN L, LI DL, et al. Elevated CISD2 expression predicts poor diagnosis and promotes invasion and migration of prostate cancer cells[J]. Eur Rev Med Pharmacol Sci, 2020, 24(12): 6597-6604. DOI:10.26355/eurrev_202006_21645 |
| [6] |
SUN Y, JIANG Y, HUANG J, et al. CISD2 enhances the chemosensitivity of gastric cancer through the enhancement of 5-FU-induced apoptosis and the inhibition of autophagy by AKT/mTOR pathway[J]. Cancer Med, 2017, 6(10): 2331-2346. DOI:10.1002/cam4.1169 |
| [7] |
YANG Y, BAI YS, WANG Q. CDGSH iron sulfur domain 2 activates proliferation and EMT of pancreatic cancer cells via wnt/β-catenin pathway and has prognostic value in human pancreatic cancer[J]. Oncol Res, 2017, 25(4): 605-615. DOI:10.3727/096504016x14767450526417 |
| [8] |
WANG L, OUYANG F, LIU X, et al. Overexpressed CISD2 has prognostic value in human gastric cancer and promotes gastric cancer cell proliferation and tumorigenesis via AKT signaling pathway[J]. Oncotarget, 2016, 7(4): 3791-3805. DOI:10.18632/oncotarget.6302 |
| [9] |
LI J, HOU N, FARIED A, et al. Inhibition of autophagy augments 5-fluorouracil chemotherapy in human colon cancer in vitro and in vivo model[J]. Eur J Cancer, 2010, 46(10): 1900-1909. DOI:10.1016/j.ejca.2010.02.021 |
| [10] |
YANG Z, KLIONSKY DJ. Eaten alive: a history of macroautophagy[J]. Nat Cell Biol, 2010, 12(9): 814-822. DOI:10.1038/ncb0910-814 |
| [11] |
SUI X, CHEN R, WANG Z, et al. Autophagy and chemotherapy resistance: a promising therapeutic target for cancer treatment[J]. Cell Death Dis, 2013, 4: e838. DOI:10.1038/cddis.2013.350 |
| [12] |
PAN X, ZHANG X, SUN H, et al. Autophagy inhibition promotes 5-fluorouraci-induced apoptosis by stimulating ROS formation in human non-small cell lung cancer A549 cells[J]. PLoS One, 2013, 8(2): e56679. DOI:10.1371/journal.pone.0056679 |
| [13] |
RONG L, LI Z, LENG X, et al. Salidroside induces apoptosis and protective autophagy in human gastric cancer AGS cells through the PI3K/Akt/mTOR pathway[J]. Biomed Pharmacother, 2020, 122: 109726. DOI:10.1016/j.biopha.2019.109726 |
| [14] |
FARHAN M, SILVA M, LI S, et al. The role of FOXOs and autophagy in cancer and metastasis-Implications in therapeutic development[J]. Med Res Rev, 2020, 40(6): 2089-2113. DOI:10.1002/med.21695 |
| [15] |
QI Y, QI W, LIU S, et al. TSPAN9 suppresses the chemosensitivity of gastric cancer to 5-fluorouracil by promoting autophagy[J]. Cancer Cell Int, 2020, 20: 4. DOI:10.1186/s12935-019-1089-2 |
| [16] |
HONG ZF, ZHAO WX, YIN ZY, et al. Capsaicin enhances the drug sensitivity of cholangiocarcinoma through the inhibition of chemotherapeutic-induced autophagy[J]. PLoS One, 2015, 10(5): e0121538. DOI:10.1371/journal.pone.0121538 |
 2022, Vol. 51
2022, Vol. 51