文章信息
- 王钦, 刘维新, 李冬, 张慧玲, 袁琳琳, 海双双, 彭娜
- WANG Qin, LIU Weixin, LI Dong, ZHANG Huiling, YUAN Linlin, HAI Shuangshuang, PENG Na
- 高脂饮食下核因子κB调控自噬在小鼠溃疡性结肠炎中的作用及其机制
- Role and mechanism of nuclear factor-κB in regulating autophagy in mice with ulcerative colitis on a high-fat diet
- 中国医科大学学报, 2022, 51(5): 420-424
- Journal of China Medical University, 2022, 51(5): 420-424
-
文章历史
- 收稿日期:2021-11-01
- 网络出版时间:2022-05-23 14:49
炎症性肠病(inflammatory bowel disease,IBD)是一类慢性、易复发的肠道炎性疾病,包括溃疡性结肠炎和克罗恩病[1]。近年来自噬在IBD中的作用越来越受到关注,在人类基因组中发现了大量与IBD相关的基因变异,揭示了自噬在肠道稳态中发挥重要作用的关键途径。IBD患者体内常出现细胞自噬功能低下,但具体作用机制尚未阐明。核因子κB(nuclear factor-κB,NF-κB)信号通路对炎性细胞因子的调控,在IBD的发生机制中具有重要地位[2]。研究[3]显示,BALB/c小鼠实验性结肠炎模型中自噬的抑制通路哺乳动物雷帕霉素靶蛋白被激活,并通过NF-κB途径抑制肠上皮细胞的自噬,以调节肠道炎症。本课题组前期研究[4]发现,高脂饮食会加重溃疡性结肠炎,增加肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)活性。TNF-α可以进一步活化NF-κB,加重炎症和组织损伤,影响结肠黏膜愈合[5]。高脂饮食下诱导的脂质刺激会降低自噬小体和溶酶体之间的融合效率,从而抑制自噬[6]。但是高脂饮食是否改变自噬在IBD中的表达,国内外尚缺乏相关研究证据。本研究通过建立高脂饮食下葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的小鼠溃疡性结肠炎模型,进一步阐明高脂饮食调控下自噬在IBD中的作用及其机制,为临床IBD的治疗和预防提供新方向。
1 材料与方法 1.1 动物选用8周龄BALB/c雄性小鼠48只,体质量19~23 g,购自北京维通利华实验动物技术有限公司。实验前,小鼠在温度(24±2)℃、湿度40%~50%、昼夜循环12 h的无特定病原体环境中适应性喂养1周。
1.2 材料高脂饲料:基础饲料+15%猪油+15%蔗糖,购自江苏省协同医药生物工程有限责任公司。DSS,分子量36×103~50×103,购自上海翊圣生物科技有限公司。小鼠白细胞介素(interleukin,IL)-6、IL-10、TNF-α ELISA试剂盒,购自凡科维公司。NF-κB和LC3引物序列,购自苏州泓迅生物科技股份有限公司。RNA提取试剂盒和PCR试剂盒,购自上海普洛麦格生物产品有限公司。小鼠垫料和正常维持饲料均为实验室自备。
1.3 方法 1.3.1 模型建立和分组适应性喂养1周后,将小鼠随机分为正常对照组(Control组)、高脂饮食组(HFD组)、DSS组、DSS+高脂饮食组(DSS+HFD组),每组12只,采用剪趾法编号。配置3% DSS饮用水,每日更换。予以Control组小鼠灭菌水和正常饮食,自由进食。予以HFD组小鼠灭菌水和高脂饮食,自由进食。予以DSS组、DSS+HFD组小鼠3% DSS饮用水3 d+灭菌水4 d为1个循环周期,以此重复9个周期。分别予以DSS组、DSS+HFD组小鼠正常饮食和高脂饮食,自由进食。
1.3.2 体质量差值的比较每日记录小鼠的体质量,计算各组小鼠体质量与该周期初始体质量的差值,比较体质量差值的变化情况。
1.3.3 疾病活动指数(disease activity index,DAI)的评估按照体质量下降(体质量下降百分比为当日体质量下降值与前一日体质量之比,< 1%,0分;1%~ < 5%,1分;5%~ < 10%,2分;10%~ < 20%,3分;≥20%,4分)、大便性状(成形大便,0分;松散大便且不粘附肛门,2分;稀便且粘附肛门,4分)和便血(隐血阴性,0分;隐血阳性,2分;肉眼血便,4分)的评分标准,每天观察记录3项指标计算总评分,得到DAI。
1.3.4 标本采集于第1、5循环周期末各组处死4只小鼠,第9循环周期末处死各组剩余小鼠。处死前1 h给予小鼠自由饮用水,摘取眼球取血,放入1 mL EP管中,4 ℃冰箱内静置2 h,在4 ℃、3 000 r/min下离心15 min,提取血清,留存于-80 ℃冰箱。取小鼠结肠作纵行切开,用生理盐水冲净后,截取1 cm左右的结肠组织,用10%甲醛溶液进行组织固定,石蜡包埋结肠组织,HE染色。在液氮中快速冷冻1 cm的相邻部分,置于冻存管中,留存于-80 ℃冰箱。
1.3.5 结肠组织病理学损伤情况观察在光镜下观察结肠组织,按照组织病理评分标准计算总评分。评分标准:上皮组织无损伤破坏、无炎症浸润,0分;少量杯状细胞破坏、炎症浸润至隐窝基底周围,1分;广泛杯状细胞破坏、炎症浸润至黏膜肌层,2分;广泛杯状细胞破坏及少量腺体破坏、黏膜肌层广泛炎症浸润并水肿增厚,3分;大量腺体消失、炎症浸润至黏膜下层,4分。
1.3.6 血清中IL-6、IL-10和TNF-α的表达情况检测取出-80 ℃冰箱中留存的小鼠血清,按照ELISA试剂盒说明书操作。
1.3.7 结肠组织中NF-κB和LC3 mRNA的表达水平检测按照PCR试剂盒说明书,在QuantStudio 3 Real-Time PCR System上用SYBR-GREEN进行特定引物配对扩增,检测mRNA的表达。反应体系包括2 μL cDNA,10 μL SYBR Premix,上下游引物各0.4 μL,7.2 μL去离子水。引物序列:NF-κB,正向5’-GAAGCACGAATGACAGAGGC-3’,反向5’-GCTTGGCGGATTAGCTCTTTT-3’;LC3,正向5’-AACATGAGCGAGTTGGTCAAG-3’,反向5’-GCTCGTAGATGTCCGCGAT-3’。将目标基因和管家基因的Ct值代入公式2-ΔΔCt进行定量分析,获得目标基因mRNA的相对表达量。
1.4 统计学分析采用SPSS 23.0软件进行统计分析。计量资料均以x±s表示。2组间比较采用t检验,多组间比较采用单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 体质量差值变化第5循环周期末开始,除Control组外,其他3组小鼠体质量增长幅度均降低。到第9循环周期末,DSS+HFD组小鼠体质量甚至出现了负增长。第5、9循环周期末,DSS组体质量差值小于Control组(P < 0.05),DSS+HFD组体质量差值小于Control组和DSS组(均P < 0.05)。见表 1。
| Item | Control group(n = 4) | HFD group(n = 4) | DSS group(n = 4) | DSS+HFD group(n = 4) |
| Body mass difference(g) | ||||
| 1st cycle | 0.97±0.92 | 1.27±0.36 | 1.10±0.68 | 1.82±0.911) |
| 5th cycle | 0.85±0.58 | 1.00±0.44 | 0.62±0.151) | 0.35±0.101),2) |
| 9th cycle | 0.90±0.51 | 0.57±0.48 | 0.13±0.101) | -0.35±0.281),2) |
| DAI | ||||
| 1st cycle | 0.00±0.00 | 0.00±0.00 | 0.67±0.581) | 1.33±1.151) |
| 5th cycle | 0.00±0.00 | 0.67±0.58 | 3.00±1.001) | 4.67±1.151),2) |
| 9th cycle | 0.00±0.00 | 1.33±1.151) | 3.67±0.581) | 6.33±0.581),2) |
| Histopathological score | ||||
| 1st cycle | 0.00±0.00 | 0.00±0.00 | 1.50±0.581) | 2.75±0.501),2) |
| 5th cycle | 0.00±0.00 | 0.00±0.00 | 2.50±0.581) | 3.50±0.581),2) |
| 9th cycle | 0.00±0.00 | 0.75±0.501) | 3.25±0.501) | 4.50±1.001),2) |
| 1)P < 0.05 vs Control group;2)P < 0.05 vs DSS group. HFD,high-fat diet;DSS,dextran sodium sulfate. | ||||
2.2 小鼠一般情况和DAI的比较
第1循环周期末,DSS诱导的小鼠溃疡性结肠炎症状不明显。第2循环周期开始后,DSS组和DSS+HFD组个别小鼠出现大便隐血阳性,其中DSS+HFD组个别小鼠还出现了松散大便。第5循环周期开始后,DSS组和DSS+HFD组小鼠大便隐血均为阳性,其中DSS+HFD组大部分小鼠还伴随肉眼血便和松散大便,更换为灭菌水后,DSS组和DSS+HFD组小鼠大便隐血阳性转阴、肉眼血便消失。第9循环周期开始后,DSS组和DSS+HFD组小鼠都出现了大便隐血阳性或肉眼血便,其中DSS+HFD组小鼠出现了腹泻;更换为灭菌水后,DSS组大部分小鼠大便隐血阳性转阴、肉眼血便消失,但DSS+HFD组小鼠腹泻和大便隐血阳性仍持续。第9循环周期末,HFD组个别小鼠出现了松散大便。Control组小鼠在整个实验过程中一般情况好、大便正常。
第1、5、9循环周期末,DSS组和DSS+HFD组DAI均大于Control组(P < 0.05)。第5、9循环周期末,DSS+HFD组DAI大于DSS组(P < 0.05)。第9循环周期末,HFD组DAI大于Control组(P < 0.05)。见表 1。
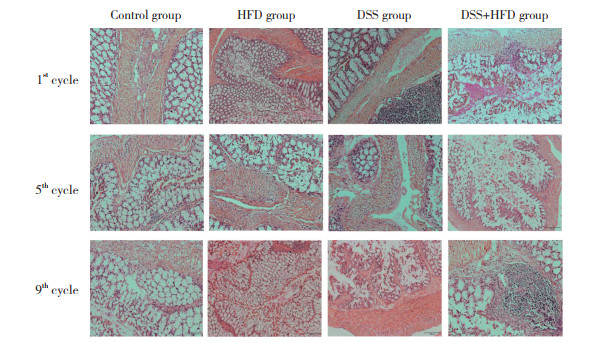
2.3 结肠组织病理学情况第1循环周期末,Control组和HFD组结肠组织各层结构清晰可见、无炎症浸润和上皮组织损伤;DSS组结肠组织可见杯状细胞破坏,炎症浸润至隐窝基底周围,个别小鼠炎症浸润至黏膜肌层;DSS+HFD组结肠组织炎症广泛浸润至黏膜肌层并水肿增厚,伴广泛杯状细胞破坏。第5、9循环周期末,Control组无明显变化;DSS组出现少量腺体破坏,黏膜肌层均可见广泛炎症浸润并水肿增厚,个别小鼠出现大量腺体破坏和消失;DSS+HFD组小鼠均出现大量腺体萎缩或消失,炎症浸润至黏膜下层。第9循环周期末,HFD组个别小鼠出现少量杯状细胞破坏,有炎症细胞浸润在隐窝基底周围。见图 1。
|
| 图 1 第1、5、9循环周期末4组小鼠结肠组织病理图片×200 Fig.1 Pathological pictures of colonic tissue at the end of the 1st, 5th, and 9th cycle in the four groups ×200 |
第1、5、9循环周期末,DSS组和DSS+HFD组病理组织学评分均大于Control组(P < 0.05),且DSS+HFD组大于DSS组(P < 0.05);第9循环周期末,HFD组病理组织学评分大于Control组(P < 0.05)。见表 1。
2.4 血清中IL-6、TNF-α和IL-10表达情况 2.4.1 IL-6表达水平第1、5、9循环周期末,DSS组和DSS+HFD组血清IL-6水平均高于Control组(P < 0.05)。第9循环周期末,DSS+HFD组血清IL-6水平高于DSS组(P < 0.05)。见表 2。
| Item | Control group(n = 4) | HFD group(n = 4) | DSS group(n = 4) | DSS+HFD group(n = 4) |
| IL-6(pg/mL) | ||||
| 1st cycle | 189.84±6.38 | 213.20±59.75 | 233.39±45.681) | 240.95±61.091) |
| 5th cycle | 191.29±63.57 | 206.11±55.09 | 257.66±78.551) | 267.46±46.111) |
| 9th cycle | 210.18±53.33 | 266.59±52.02 | 299.68±9.711) | 329.78±12.231),2) |
| TNF-α(ng/L) | ||||
| 1st cycle | 647.05±29.11 | 664.06±29.68 | 686.73±20.57 | 751.01±40.341),2) |
| 5th cycle | 680.11±22.76 | 730.21±29.291) | 748.16±16.741) | 804.93±24.211),2) |
| 9th cycle | 714.15±13.59 | 760.48±24.521) | 771.81±21.631) | 835.19±15.561),2) |
| IL-10(pg/mL) | ||||
| 1st cycle | 1 236.08±29.23 | 1 148.60±56.85 | 1 176.68±157.30 | 1 173.80±74.91 |
| 5th cycle | 1 344.53±63.50 | 1 253.63±185.65 | 1 222.44±96.39 | 1 197.28±92.891) |
| 9th cycle | 1 379.50±29.18 | 1 342.74±94.69 | 1 251.04±76.06 | 1 200.85±24.141) |
| 1)P < 0.05 vs Control group;2)P < 0.05 vs DSS group. HFD,high-fat diet;DSS,dextran sodium sulfate. | ||||
2.4.2 TNF-α表达水平
第1、5、9循环周期末,DSS+HFD组血清TNF-α水平高于Control组和DSS组(均P < 0.05)。第5、9循环周期末,HFD组和DSS组血清TNF-α水平均高于Control组(P < 0.05)。见表 2。
2.4.3 IL-10表达水平第5、9循环周期末,DSS+HFD组血清IL-10水平低于Control组(P < 0.05),虽低于DSS组但差异无统计学意义(P > 0.05)。见表 2。
2.5 结肠组织中NF-κB和LC3 mRNA表达情况 2.5.1 NF-κB mRNA表达水平DSS组和DSS+HFD组结肠组织NF-κB mRNA水平均高于Control组(P < 0.05),且DSS+HFD组高于DSS组(P < 0.05)。见表 3。
| Item | Control group(n = 4) | HFD group(n = 4) | DSS group(n = 4) | DSS+HFD group(n = 4) |
| NF-κB mRNA | 1.00±0.09 | 1.81±1.18 | 2.63±2.001) | 6.51±1.201),2) |
| LC3 mRNA | 1.03±0.28 | 0.51±0.18 | 0.24±0.031) | 0.13±0.011),2) |
| 1)P < 0.05 vs Control group;2)P < 0.05 vs DSS group. HFD,high-fat diet;DSS,dextran sodium sulfate. | ||||
2.5.2 LC3 mRNA表达水平
DSS组和DSS+HFD组结肠组织LC3 mRNA水平均低于Control组(P < 0.05),且DSS+HFD组低于DSS组(P < 0.05)。见表 3。
3 讨论近年来,我国IBD发病率上升速度显著增快[7]。肥胖被认为是导致IBD发生的危险因素之一[8]。高脂饮食是引起肥胖的重要原因,研究[9]发现,高脂饲料会引起NF-κB活化、辅助性T细胞17分化、肠道微生物区系组成紊乱,导致结肠炎。脂类在消化道分解的产物会损害肠道内微环境,诱发肠黏膜炎症,使肠黏膜屏障受损[10]。与高碳水化合物饮食相比,高脂饮食与肠道微生物群的显著差异有关[11]。第5、9循环周期末,DSS组体质量差值小于Control组(P < 0.05),DSS+HFD组体质量差值小于Control组和DSS组(均P < 0.05),表明溃疡性结肠炎小鼠的正常生长进程遭到破坏,而高脂饮食进一步加重了严重程度。第1、5、9循环周期末,DSS组和DSS+HFD组DAI均高于Control组(P < 0.05);第5、9循环周期末,DSS+HFD组DAI大于DSS组(P < 0.05);第9循环周期末,HFD组DAI大于Control组(P < 0.05)。结肠组织病理切片显示,DSS+HFD组的炎症浸润范围和程度、杯状细胞和腺体破坏的数量均较DSS组严重;第9循环周期末,HFD组个别小鼠出现少量杯状细胞破坏和炎症细胞浸润。第1、5、9循环周期末,DSS组和DSS+HFD组病理组织学评分均大于Control组(P < 0.05),且DSS+HFD组大于DSS组(P < 0.05);第9循环周期末,HFD组病理组织学评分大于Control组(P < 0.05)。小鼠体质量差值、DAI、结肠组织病理切片和病理学组织评分结果均表明,高脂饮食会诱发结肠炎症以及加重DSS诱导的溃疡性结肠炎。
本研究通过检测血清炎性细胞因子水平进一步证实溃疡性结肠炎的炎症程度改变,第1、5、9循环周期末,DSS+HFD组TNF-α水平高于DSS组和Control组(均P < 0.05),第5、9循环周期末HFD组和DSS组TNF-α水平均高于Control组(P < 0.05);第1、5、9循环周期末,DSS组和DSS+HFD组IL-6水平均高于Control组(P < 0.05),第9循环周期末DSS+HFD组IL-6水平高于DSS组(P < 0.05)。结果表明,高脂饮食下肠道促炎性细胞因子IL-6、TNF-α的分泌增加,进一步加重了溃疡性结肠炎。IL-10的保护作用已在DSS诱导的结肠炎模型中被证实,IL-10的丢失促进了IBD的发展[12]。本研究中,溃疡性结肠炎小鼠模型中IL-10的表达经历了炎症期的丢失和恢复期的活化这一不断累积的过程,所以随着循环周期的增加,虽然DSS组和DSS+HFD组小鼠IL-10的表达水平较循环初期增长,但与Control组相比仍降低;第5、9循环周期末,DSS+HFD组IL-10水平低于Control组(P < 0.05),虽低于DSS组但差异无统计学意义(P > 0.05)。
本研究检测了小鼠结肠组织中NF-κB和LC3 mRNA的相对表达情况,结果发现,DSS组和DSS+HFD组NF-κB mRNA水平均高于Control组(P < 0.05),且DSS+HFD组高于DSS组(P < 0.05);DSS组和DSS+HFD组LC3 mRNA水平均低于Control组(P < 0.05),且DSS+HFD组低于DSS组(P < 0.05)。炎症较重的DSS+HFD组小鼠NF-κB mRNA表达水平比炎症较轻的DSS组高,提示高脂饮食下NF-κB进一步活化,加重了溃疡性结肠炎。炎症较轻的DSS组小鼠自噬标志物LC3 mRNA表达水平比炎症较重的DSS+HFD组高,提示自噬在溃疡性结肠炎中起抗炎作用,考虑高脂饮食下NF-κB进一步活化,抑制自噬的表达,加重了溃疡性结肠炎。
综上所述,DSS组和DSS+HFD组小鼠与Control组小鼠相比,都有肠道炎症加重、NF-κB活化、自噬表达受抑制的表现,其中DSS+HFD组小鼠的上述表现更为显著,考虑和高脂饮食下NF-κB进一步活化使自噬的表达受抑制相关,同时进一步证实了高脂饮食是介导溃疡性结肠炎改变的重要因素,提示抑制NF-κB信号通路的治疗药物和自噬在溃疡性结肠炎中的抗炎作用有希望为治疗和预防IBD提供新机会。
| [1] |
FLYNN S, EISENSTEIN S. Inflammatory bowel disease presentation and diagnosis[J]. Surg Clin North Am, 2019, 99(6): 1051-1062. DOI:10.1016/j.suc.2019.08.001 |
| [2] |
TANIGUCHI K, KARIN M. NF-κB, inflammation, immunity and cancer: coming of age[J]. Nat Rev Immunol, 2018, 18(5): 309-324. DOI:10.1038/nri.2017.142 |
| [3] |
ZHOU M, XU W, WANG J, et al. Boosting mTOR-dependent autophagy via upstream TLR4-MyD88-MAPK signalling and downstream NF-κB pathway quenches intestinal inflammation and oxidative stress injury[J]. EBioMedicine, 2018, 35: 345-360. DOI:10.1016/j.ebiom.2018.08.035 |
| [4] |
李虹. 高脂饮食对不同周期溃疡性结肠炎小鼠血清IL2, IL10和TNF-α的影响[D]. 沈阳: 中国医科大学, 2018.
|
| [5] |
AMIRSHAHROKHI K. Febuxostat attenuates ulcerative colitis by the inhibition of NF-κB, proinflammatory cytokines, and oxidative stress in mice[J]. Int Immunopharmacol, 2019, 76: 105884. DOI:10.1016/j.intimp.2019.105884 |
| [6] |
KOGA H, KAUSHIK S, CUERVO AM. Altered lipid content inhibits autophagic vesicular fusion[J]. FASEB J, 2010, 24(8): 3052-3065. DOI:10.1096/fj.09-144519 |
| [7] |
KAPLAN GG. The global burden of IBD: from 2015 to 2025[J]. Nat Rev Gastroenterol Hepatol, 2015, 12(12): 720-727. DOI:10.1038/nrgastro.2015.150 |
| [8] |
HARPER JW, ZISMAN TL. Interaction of obesity and inflammatory bowel disease[J]. World J Gastroenterol, 2016, 22(35): 7868-7881. DOI:10.3748/wjg.v22.i35.7868 |
| [9] |
CAVALLARI JF, DENOU E, FOLEY KP, et al. Different Th17 immunity in gut, liver, and adipose tissues during obesity: the role of diet, genetics, and microbes[J]. Gut Microbes, 2016, 7(1): 82-89. DOI:10.1080/19490976.2015.1127481 |
| [10] |
周凤, 刘维新, 于艳红, 等. 高脂饮食对AOM/DSS诱导的小鼠不同周期溃疡性结肠炎的影响及白细胞介素6的改变[J]. 中国医科大学学报, 2017, 46(3): 232-237. DOI:10.12007/j.issn.0258-4646.2017.03.010 |
| [11] |
WU GD, CHEN J, HOFFMANN C, et al. Linking long-term dietary patterns with gut microbial enterotypes[J]. Science, 2011, 334(6052): 105-108. DOI:10.1126/science.1208344 |
| [12] |
NEUMANN C, SCHEFFOLD A, RUTZ S. Functions and regulation of T cell-derived interleukin-10[J]. Semin Immunol, 2019, 44: 101344. DOI:10.1016/j.smim.2019.101344 |
 2022, Vol. 51
2022, Vol. 51