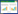文章信息
- 孙倩, 刘盛力, 马钰, 杜莉
- SUN Qian, LIU Shengli, MA Yu, DU Li
- 大黄酸通过Wnt/β-catenin信号通路抑制喉癌细胞的增殖、迁移和侵袭
- Rhein inhibits the proliferation, migration, and invasion of laryngeal carcinoma cells through the Wnt/β-catenin signaling pathway
- 中国医科大学学报, 2022, 51(5): 415-419
- Journal of China Medical University, 2022, 51(5): 415-419
-
文章历史
- 收稿日期:2021-12-24
- 网络出版时间:2022-05-23 14:50
喉癌是一种头颈恶性肿瘤,其中鳞状细胞癌占95%以上。喉癌发病率呈逐年上升趋势,且喉癌侵袭和转移性很强,5年生存率约为60.9%。虽然手术、放化疗以及靶向治疗技术近年来快速发展,但喉癌患者的生存率较过去无明显提高[1]。因此,寻找新的治疗靶点和治疗手段有迫切意义。大黄酸是中药芦荟、大黄的主要成分之一,在大黄、何首乌、虎杖等蓼科植物中能够分离纯化,其化学名为4,5-二羟基2-羧酸蒽醌[2],属单蒽核类1,8-二羟基蒽醌衍生物,具有抗氧化、抗炎、抗病毒、泻下、抗糖尿病肾病、抗肿瘤等多种药理活性[3]。研究[4]发现,大黄酸可以抑制卵巢癌、乳腺癌、肝癌、宫颈癌、喉癌等多种肿瘤细胞增殖,诱导其凋亡,可以抑制肺癌细胞和胰腺癌细胞的运动和侵袭能力。而且研究[4]表明,大黄酸能有效降低肿瘤细胞的多药耐药性,具有较好的安全性。因此,大黄酸作为肿瘤治疗药物有一定应用前景。本研究探讨了大黄酸对喉癌细胞增殖、迁移和侵袭能力的作用及其作用机制。
1 材料与方法 1.1 细胞和主要试剂喉癌细胞Hep-2细胞(中国医学科学院基础医学研究所细胞资源中心),青霉素/链霉素(北京索莱宝),EMEM培养基(美国Hyclone公司),胰蛋白酶和胎牛血清(美国Gibco公司),BCA法蛋白浓度测定试剂盒(北京Genstar公司),XAV939 (美国TargetMol公司)、Dvl2、GSK-3β、p-GSK-3β和β-catenin抗体(美国Proteintech公司),β-actin (美国Cell Signaling公司),SKL2001 (美国Millipore公司),HRP标记的羊抗兔IgG和羊抗鼠IgG (美国CST公司),大黄酸(中国普西唐公司)。
1.2 细胞培养和分组冻存细胞复苏培养,将Hep-2细胞置于EMEM培养基培养,培养条件为37 ℃、5%CO2、饱和湿度,6~8 h观察贴壁情况,24 h后换液。离心管中分别加入无血清培养基,倍半稀释法将大黄酸稀释成6、12、24 μmol/L。将Hep-2细胞分为对照组、低浓度(6 μmol/L) 大黄酸组、中浓度(12 μmol/L) 大黄酸组、高浓度(24 μmol/L) 大黄酸组。显微镜下观察细胞处于对数生长期时,按照1×105/孔接种至6孔板。待细胞汇合度约80% 时,低、中、高浓度大黄酸组分别加入3种浓度的大黄酸溶液,对照组加入等量无血清的培养基。另设对照组、XAV939+大黄酸组、SKL2001+大黄酸组、大黄酸组。对照组不做处理,XAV939+大黄酸组加入2 μmol/L XAV939和24 μmol/L大黄酸,SKL2001+大黄酸组加入20 μmol/L SKL2001和24 μmol/L大黄酸,大黄酸组加入24 μmol/L大黄酸。XAV939为Wnt/β-catenin信号通路抑制剂,SKL2001为Wnt/β-catenin信号通路激活剂。
1.3 MTT法评价细胞增殖能力取对数生长期的Hep-2细胞,按照5×103/孔接种至96孔板,细胞贴壁后加入3种浓度的大黄酸溶液。37 ℃、5%CO2培养24、48、72 h后,每孔加入5 mg/mL MTT溶液,37 ℃、5%CO2培养4 h。弃上清,每孔加150 μL DMSO,使MTT甲臜沉淀溶解,酶标仪测定570 nm波长下的吸光值。
1.4 划痕实验评价细胞迁移能力先在6孔板底部画上刻度,再取对数生长期的喉癌细胞按照1×105/孔接种,待细胞完全融合后移去培养基。用10 μL枪头尖端划出一条泳道,PBS冲洗细胞碎片2次,倒置显微镜下记录0 h泳道的宽度及含不同浓度大黄酸的无血清培养基培养48 h的泳道宽度,每组细胞选取5个视野拍照,计算细胞迁移距离,得到细胞相对迁移能力。
1.5 Transwell检测细胞侵袭能力取对数生长期的喉癌细胞,置于EP管中,制成1×105/mL浓度的悬浮液,将200 μL细胞悬液加入用Matrigel胶覆盖的24孔板Transwell小室上室,分别加入200 μL浓度为6、12、24 μmol/L大黄酸无血清培养基。室温过夜,下室加入15%胎牛血清的培养基,在恒温培养箱中培养24 h后,擦除小室内细胞,甲醇固定,0.5%结晶紫染色,冲洗封片后,倒置显微镜下任取5个区域计数侵袭细胞。
1.6 实时定量PCR检测基因表达水平收集大黄酸溶液处理48 h的喉癌细胞,提取细胞中总RNA,以GAPDH为内参,反转录后实时定量PCR检测β-catenin、Dvl2、GSK-3β mRNA表达水平。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 7 min。引物序列:Dvl2,正向5’-CTTTCTGGGCTCGGATGT-3’,反向5’-CGGTGTGTCGGATCAGG-3’,扩增片段长度为119 bp;GSK-3β,正向5’-TGTGTAACTTGCCCTCACC-3’,反向5’-TGCCAACAGACTCCACTTC-3’,扩增片段长度为91 bp;β-catenin,正向5’-TCCTTGGGACTCTTGTTCA-3’,反向5’-CACTTGGCAGACCATCATC-3’,扩增片段长度为122 bp;GAPDH,正向5’-CCTTCCGTGTCCCCACT-3’,反向5’-GCCTGCTTCACCACCTTC-3’,扩增片段长度为100 bp。
1.7 免疫印迹法检测相关蛋白的表达将处于生长对数期的喉癌细胞用不同浓度的大黄酸溶液处理48 h。常规收集喉癌细胞,加入150 μL RIPA裂解液裂解30 min,离心取上清液,振荡混匀冰上裂解10 min,再离心取上清,用蛋白定量试剂盒测定蛋白浓度。制备聚丙烯酰胺凝胶,每个泳道加入20 μg蛋白样品,置于电转槽中电转至PVDF膜,恒压电泳转膜,5%脱脂奶粉室温振荡封闭1 h。分别加入一抗,过夜。1×TBST溶液洗膜3次,二抗37 ℃孵育2 h,TBST洗膜3次,每次20 min,ECL显影。目标蛋白相对表达量=目的条带灰度值/GAPDH。
1.8 统计学分析采用SPSS 17.0软件分析数据。计量资料以x±s表示,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 大黄酸对Hep-2细胞增殖的抑制作用MTT结果显示,与对照组比较,低、中、高浓度大黄酸组细胞的增殖抑制率明显升高,提示大黄酸显著抑制喉癌细胞的增殖。中、高浓度大黄酸组Hep-2细胞增殖的抑制率明显高于低浓度大黄酸组,高浓度大黄酸组Hep-2细胞增殖的抑制率明显高于中浓度大黄酸组,差异均有统计学意义(P < 0.05);且随着作用时间延长,大黄酸对Hep-2细胞增殖的抑制率明显升高(P < 0.05)。结果提示,大黄酸对Hep-2细胞增殖的呈时间和剂量依赖性(P < 0.05)。见表 1。
| Group | 24 h | 48 h | 72 h |
| Control | 1.25±0.21 | 1.88±0.37 | 2.50±0.46 |
| Low-dose rhein | 8.13±0.681) | 14.38±1.251),4) | 21.88±1.481),4),5) |
| Medium-dose rhein | 15.63±1.461),2) | 21.25±1.351),2),4) | 31.88±1.691),2),4),5) |
| High-dose rhein | 19.37±1.621),2),3) | 33.75±1.761),2),3),4) | 43.75±1.831),2),3),4),5) |
| 1) P < 0.05 vs control group at the same time point;2) P < 0.05 vs low-dose rhein group at the same time point;3) P < 0.05 vs medium-dose rhein group at the same time point;4) P < 0.05 vs 24 h within group;5) P < 0.05 vs 48 h within group. | |||
2.2 大黄酸抑制Hep-2细胞侵袭和迁移
Transwell结果(图 1A) 显示,不同浓度的大黄酸作用于喉癌细胞48 h后,显著降低喉癌细胞侵袭数量,且中、高浓度大黄酸组侵袭细胞数量低于低浓度大黄酸组,高浓度大黄酸组侵袭细胞数量低于中浓度大黄酸组,差异均有统计学意义(P < 0.05)。结果提示,大黄酸对细胞侵袭的抑制作用呈剂量依赖性。
|
| A, effect of rhein on the invasion of Hep-2 cells; B, effect of rhein on the migration of Hep-2 cells. * P < 0.05 vs control group; # P < 0.05 vs low-dose rhein group; Δ P < 0.05 vs medium-dose rhein group. 图 1 不同浓度大黄酸对Hep-2细胞侵袭和迁移的抑制作用 Fig.1 Effect of different doses of rhein on the invasion and migration of Hep-2 cells |
划痕实验结果(图 1B) 显示,与对照组相比,低、中、高浓度大黄酸组划痕愈合速度显著变慢(P < 0.05),且中、高浓度大黄酸组划痕愈合速度低于低浓度大黄酸组,高浓度大黄酸组划痕愈合速度低于中浓度大黄酸组,差异均有统计学意义(P < 0.05)。结果提示,大黄酸可以抑制Hep-2细胞的迁移能力,且呈剂量依赖性。
2.3 大黄酸对Hep-2细胞β-catenin、Dvl2和GSK-3β mRNA表达的影响实时定量PCR结果示,大黄酸作用于喉癌Hep-2细胞48 h后,低、中、高浓度大黄酸组Hep-2细胞的Dvl2和β-catenin mRNA表达水平较对照组显著降低(P < 0.05),中、高浓度大黄酸组GSK-3β mRNA表达水平较对照组显著升高(P < 0.05)。中、高浓度大黄酸组与低浓度大黄酸组比较,高浓度大黄酸组与中浓度大黄酸组比较,Dvl2和β-catenin mRNA表达水平显著降低(P < 0.05),GSK-3β mRNA表达水平显著升高(P < 0.05)。见表 2。
| Group | Dvl2 | GSK-3β | β-catenin | p-GSK-3β protein | |||||
| mRNA | Protein | mRNA | Protein | mRNA | Protein | ||||
| Control | 1.13±0.22 | 1.15±0.10 | 0.47±0.09 | 0.50±0.06 | 1.18±0.24 | 0.25±0.03 | 0.39±0.05 | ||
| Low-dose rhein | 0.81±0.141) | 1.13±0.04 | 0.51±0.09 | 0.68±0.03 | 0.69±0.081) | 0.18±0.01 | 0.31±0.02 | ||
| Medium-dose rhein | 0.62±0.081),2) | 0.98±0.051),2) | 0.71±0.041),2) | 0.81±0.031),2) | 0.51±0.051),2) | 0.12±0.031),2) | 0.21±0.021),2) | ||
| High-dose rhein | 0.46±0.121),2),3) | 0.49±0.021),2),3) | 1.04±0.121),2),3) | 1.01±0.051),2),3) | 0.42±0.031),2),3) | 0.08±0.011),2),3) | 0.10±0.011),2),3) | ||
| 1) P < 0.05 vs control group;2) P < 0.05 vs low-dose rhein group;3) P < 0.05 vs medium-dose rhein group. | |||||||||
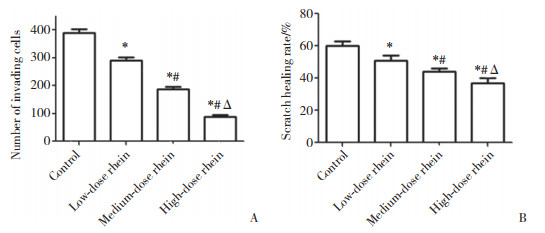
2.4 大黄酸对Hep-2细胞Dvl2、GSK-3β、p-GSK-3β、β-catenin蛋白表达的影响
免疫印迹法结果(图 2) 显示,大黄酸作用于喉癌细胞48 h后,中、高浓度大黄酸组喉癌Hep-2细胞Dvl2、p-GSK-3β和β-catenin蛋白表达量较对照组显著降低(P < 0.05),GSK-3β蛋白表达量较对照组显著升高(P < 0.05)。中、高浓度大黄酸组与低浓度大黄酸组比较,高浓度大黄酸组与中浓度大黄酸组比较,Dvl2、p-GSK-3β和β-catenin蛋白表达量显著降低(P < 0.05),GSK-3β蛋白表达量显著升高(P < 0.05)。见表 2。
|
| 图 2 Western blotting检测Hep-2细胞中β-catenin、Dvl2、GSK-3β、p-GSK-3β蛋白表达 Fig.2 Expression of β-catenin, Dvl2, GSK-3β, and p-GSK-3β proteins in Hep-2 cells detected by Western blotting |
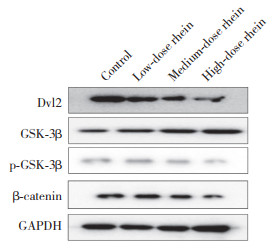
2.5 抑制或激活Wnt/β-catenin信号通路对大黄酸抑制Hep-2细胞细胞侵袭和迁移作用的影响
为进一步探讨大黄酸是否通过Wnt/β-catenin信号通路影响喉癌细胞的侵袭和迁移,采用XAV939阻断信号通路、SKL2001激活信号通路。细胞划痕实验结果(图 3A) 显示,XAV939+大黄酸组与大黄酸组相比,细胞迁移率明显降低(P < 0.05),提示XAV939抑制Wnt/β-catenin信号通路后细胞迁移率下降;SKL2001激活Wnt /β-catenin信号通路后,可以逆转大黄酸对Hep-2细胞迁移的抑制作用(P < 0.05)。细胞侵袭实验结果(图 3B) 显示,SKL2001+大黄酸组与大黄酸组比,侵袭细胞数量明显增加(P < 0.05),SKL2001可以逆转大黄酸对Hep-2细胞侵袭的抑制作用。以上结果提示,大黄酸通过抑制Wnt/β-catenin信号通路,发挥抑制Hep-2细胞侵袭和迁移的作用。
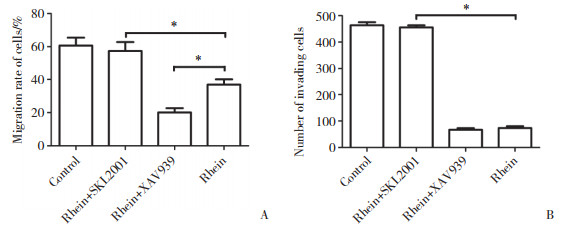
|
| A, effect of rhein on the migration of Hep-2 cells; B, effect of rhein on the invasion of Hep-2 cells. * P < 0.05. 图 3 大黄酸通过Wnt/β-catenin信号通路抑制喉癌细胞的迁移和侵袭 Fig.3 Effect of rhein on the migration and invasion of Hep-2 cells after inhibition and activation of the Wnt/β-catenin signaling pathway |
3 讨论
在中国大黄酸的使用已有千年历史,其主要存在于黄精科植物中,表现出较强的抗癌药理活性[5]。研究[6]表明,大黄酸能通过抑制ATP产生,降低线粒体跨膜电位,释放凋亡诱导因子,从而诱导肿瘤细胞凋亡。大黄酸能诱导肝癌、神经胶质瘤和乳腺癌等多种肿瘤细胞发生凋亡[7]。此外,大黄酸还有抗纤维化作用、调脂作用、降糖作用等。大黄酸可减少白细胞介素和肿瘤坏死因子等促炎性细胞因子的生成,从而减少免疫细胞迁移,具有强大的抗炎作用。本研究结果显示,大黄酸作用于喉癌细胞可以显著降低喉癌细胞侵袭的数量,还可以抑制Hep-2细胞的侵袭和迁移能力。胡雅琼等[8]的研究显示,大黄酸对宫颈癌细胞的生长和运动有抑制作用,并促进Hela细胞进入程序性死亡。张岩等[9]的研究表明,大黄酸通过激活p38 MAPK信号通路,对结肠癌SW480细胞的增殖、迁移和侵袭能力起到抑制作用。
β-catenin主要负责介导细胞间的黏附和相关信号的转导。当Wnt信号通路激活时,Wnt与Frz、LRP受体结合后作用于胞质内的蓬乱蛋白(Dsh或DV1),DV1在支架蛋白的协同下,使β-catenin在细胞核内与T细胞因子结合,促进靶基因转录,激活下游相关基因的表达,如cyclin D1等[10],促进肿瘤细胞增殖,抑制其凋亡。正常情况下,正常组织中β-catenin作用被抑制。当β-catenin发生功能障碍后,β-catenin由胞膜内侧进入细胞质内,由E-cadherin介导的细胞间的黏附物质失去稳定性,细胞间黏附功能下降,细胞被侵袭、转移的危险性大大增加[11-12]。许多研究[13]证实,β-catenin的表达量与肿瘤恶性程度和侵袭能力正相关。本研究表明,大黄酸通过抑制Dvl2和β-catenin的表达、促进GSK-3β表达,发挥抑制Wnt/β-catenin信号通路的作用,进而抑制喉癌Hep-2细胞的增殖、侵袭和迁移。
综上所述,本研究在细胞水平上发现大黄酸能降低喉癌Hep-2细胞的增殖、迁移和侵袭能力,其作用机制与Wnt/β-catenin信号通路抑制相关,为大黄酸应用于喉癌治疗提供了参考。
| [1] |
李永, 聂鹏印. 芹菜素对喉癌Hep-2细胞增殖、迁移与侵袭的影响[J]. 解剖科学进展, 2019, 25(4): 398-401. DOI:10.16695/j.cnki.1006-2947.2019.04.013 |
| [2] |
唐楠, 常剑, 饶竞. 大黄酸通过抑制ERK途径诱导胶质瘤细胞增殖分化的实验研究[J]. 临床神经外科杂志, 2018, 15(4): 246-249. DOI:10.3969/j.issn.1672-7770.2018.04.002 |
| [3] |
余德芊. 中药大黄有效成分大黄酸的抗肿瘤作用研究进展[J]. 现代医药卫生, 2020, 36(3): 390-392. DOI:10.3969/j.issn.1009-5519.2020.03.022 |
| [4] |
胡万乐. 大黄酸抑制STAT3抗结肠癌及增敏EGFR抑制剂的活性研究[D]. 苏州: 苏州大学, 2018.
|
| [5] |
和莹莹, 薛金慧, 赵娜. 大黄酸对非小细胞肺癌A549细胞增殖、迁移和侵袭能力的影响及其机制[J]. 吉林大学学报(医学版), 2020, 46(2): 302-308, 434. DOI:10.13481/j.1671-587x.20200216 |
| [6] |
郑舟琴, 杜宏. 大黄酸药理作用的新进展[J]. 重庆医学, 2019, 48(22): 3897-3901. |
| [7] |
YOU L, DONG X, YIN X, et al. Rhein induces cell death in HepaRG cells through cell cycle arrest and apoptotic pathway[J]. Int J Mol Sci, 2018, 19(4): 1060. DOI:10.3390/ijms19041060 |
| [8] |
胡雅琼, 孔梅, 程萍. 大黄酸对宫颈癌细胞生长和运动能力的影响[J]. 中国免疫学杂志, 2019, 35(20): 2499-2503. DOI:10.3969/j.issn.1000-484X.2019.20.012 |
| [9] |
张岩, 马丽辉, 邓黎黎, 等. 大黄酸对结肠癌SW480生长和侵袭抑制机制探讨[J]. 中华肿瘤防治杂志, 2020, 27(1): 12-18. DOI:10.16073/j.cnki.cjcpt.2020.01.03 |
| [10] |
KIM DY, PARK EY, CHANG E, et al. A novel miR-34a target, protein kinase D1, stimulates cancer stemness and drug resistance through GSK3/β-catenin signaling in breast cancer[J]. Oncotarget, 2016, 7(12): 14791-14802. DOI:10.18632/oncotarget.7443 |
| [11] |
TONG Y, LIU Y, ZHENG H, et al. Artemisinin and its derivatives can significantly inhibit lung tumorigenesis and tumor metastasis through Wnt/β-catenin signaling[J]. Oncotarget, 2016, 7(21): 31413-31428. DOI:10.18632/oncotarget.8920 |
| [12] |
SU YJ, CHANG YW, LIN WH, et al. An aberrant nuclear localization of E-cadherin is a potent inhibitor of Wnt/β-catenin-elicited promotion of the cancer stem cell phenotype[J]. Oncogenesis, 2015, 4(6): e157. DOI:10.1038/oncsis.2015.17 |
| [13] |
王吉维, 郝文伟, 李盛涛, 等. 五味子乙素通过Wnt/β-catenin信号通路调节人胰腺癌细胞增殖、凋亡和侵袭[J]. 解剖科学进展, 2021, 27(1): 58-60, 64. DOI:10.16695/j.cnki.1006-2947.2021.01.015 |
 2022, Vol. 51
2022, Vol. 51