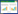文章信息
- 王少磊, 张倩, 宋续军, 李雪, 王丽喆, 刘杰
- WANG Shaolei, ZHANG Qian, SONG Xujun, LI Xue, WANG Lizhe, LIU Jie
- CXCR2参与调控小鼠种植体周围炎发病机制的研究
- Role of the CXCR2 in regulating the pathogenesis of peri-implantitis in mice
- 中国医科大学学报, 2022, 51(5): 409-414
- Journal of China Medical University, 2022, 51(5): 409-414
-
文章历史
- 收稿日期:2021-11-29
- 网络出版时间:2022-05-23 11:43
2. 青岛大学口腔医学院口腔修复学教研室,山东 青岛 266003
2. Department of Prosthodontics, School of Stomatology of Qingdao University, Qingdao 266003, China
种植义齿修复已成为治疗牙齿缺失的主要方式。随着种植义齿的广泛应用,患种植体周围炎的患者逐年增多。种植体周围炎是由牙龈卟啉单胞菌(Porphyromonas gingivalis,P.g)为代表的菌斑微生物引发的炎症性疾病,牙龈组织充血水肿、牙槽嵴破坏吸收为其典型特点[1]。研究[2]表明,该病5~10年发病率约为10%~20%,若得不到及时有效的治疗将会引发种植体松动脱落,导致种植失败。因此,有必要对其发病机制进行深入研究,以期寻找治疗的新方法。
CXCR2是重要的趋化因子受体,属于G蛋白耦联受体家族,在多种炎症性疾病中发挥重要作用。研究[3]表明,CXCR2能通过与CXCL1、CXCL2、CXCL3、CXCL5、CXCL6、CXCL7等白细胞介素-8 (interleukin-8,IL-8) 家族趋化因子结合,将以中性粒细胞为代表的白细胞、淋巴细胞趋化至炎症局部,发挥免疫炎症调控作用。研究[4-7]发现,CXCR2结合其配体IL-8、CXCL1、CXCL2能够诱导破骨细胞生成,引发骨质吸收。种植体周围炎作为一种典型的炎症性骨破坏性疾病,其组织病理特点为炎症细胞浸润、破骨细胞生成及骨质吸收。鉴于CXCR2在炎症及骨免疫中的重要作用,推测CXCR2在种植体周围炎中可能扮演重要角色。因此,本研究利用SB225002抑制CXCR2,初步探讨CXCR2在小鼠种植体周围炎发病机制中的作用。
1 材料与方法 1.1 材料 1.1.1 实验动物36只SPF级4周龄雄性C57BL/6J小鼠购自济南朋悦动物中心,许可证号SCXK (鲁) 20190003,体质量15~18 g。经青岛大学附属医院伦理委员会批准,饲养于青岛大学附属医院中心实验室动物实验中心的无菌单元内,整个实验过程中可随意进食无菌水和软质饲料。
1.1.2 P.g (ATCC 33277)培养于37 ℃厌氧环境中(5%H2、5%CO2、90%N2)。采用分光光度计测定菌落集成单位(colony forming unit,CFU),将对数生长期的细菌稀释至1×109 CFU后进行热灭活[8],将5-0丝线放入菌液中浸泡30 min,用于后续实验。
1.2 方法 1.2.1 建立小鼠种植体周围炎模型小鼠适应性饲养1周后,腹腔注射氯胺酮(100 mg/kg) 和赛拉嗪(5 mg/kg) 全身麻醉,拔除右侧上颌第一磨牙,在腭根窝洞内即刻植入种植体(定制于威高集团,尺寸为长1.7 mm,主直径0.7 mm,冠方六边形边长0.9 mm,尖端直径0.4 mm) [9]。愈合4周达骨结合后,将小鼠随机分为对照组、模型组及治疗组,每组12只。将浸有热灭活P.g的5-0丝线结扎在模型组和治疗组种植体颈部,对照组不做处理。
1.2.2 注射CXCR2抑制剂SB225002丝线结扎后,治疗组每天腹腔注射CXCR2抑制剂SB225002 (美国Selleck公司) 2 mg/kg,对照组及模型组腹腔注射等量生理盐水。连续注射14 d后,观察小鼠生存状态及种植体状况。
1.2.3 获取标本每组随机选取6只小鼠处死,切取腭侧牙龈进行RT-PCR分析,剩余上颌骨标本用于Micro-CT检测。其余6只小鼠处死后切取上颌骨标本,旋出种植体,常规制作石蜡切片,用于组织化学分析。
1.3 检测与分析 1.3.1 形态学观察用显微组织镊对种植体进行叩诊和松动度检查。肉眼观察牙龈的颜色、质地及形态,评估种植体周围组织的炎症变化。
1.3.2 Micro-CT分析使用μCT100 (瑞士SCANCO Medical AG公司) 扫描上颌骨标本。参数为工作电压70 kVp,电流200 μA,分辨率10 μm,曝光时长500 ms,每视图 5帧。获取数据后导入Mimics Research 20.0软件进行三维重建和分析。为量化种植体周围骨吸收情况,将种植体周围直径1.0 mm、高1.7 mm、轴线与种植体长轴重合的圆柱体体积定义为感兴趣体积(volume of interest,VOI),计算VOI内的骨体积分数(bone volume/total volume,BV/TV)。
1.3.3 HE、TRAP及免疫荧光染色(immunofluorescence staining,IF)HE及TRAP染色方法参照文献[9],染色完成后使用配有摄像机的显微镜(日本Olmpus公司) 观察采集图像,通过Cellsens软件进行分析。在400倍视野下观察HE染色组织切片,于种植体腭侧纤维结缔组织中随机选取4个50 μm×50 μm的方形区域,计算总炎症细胞密度。对牙槽嵴顶的破骨细胞计数,将TRAP染色组织切片中一边与种植体长轴重合一边位于种植体骨内第一螺纹的正方形区域(0.5 mm×0.5 mm) 定义为感兴趣区域(region of interest,ROI),将该区域内细胞核呈深蓝色、细胞质呈粉红色的TRAP阳性细胞记为破骨细胞。IF中,采用Ly6G (中性粒细胞表面标志物) 标记中性粒细胞[10]。石蜡切片脱蜡后,使用胃蛋白酶修复液进行抗原修复,3%BSA封闭,加入兔抗鼠Ly6G抗体(1∶400稀释,武汉Servicebio公司),4 ℃湿盒内孵育12 h,加入荧光二抗,避光室温孵育50 min,加入DAPI染液复染细胞,淬灭组织自发荧光后封片,于荧光显微镜下观察并采集图像。使用ImageJ软件计算每张图片Ly6G平均荧光强度,用于评估中性粒细胞浸润情况。
1.3.4 RT-PCR分析将牙龈组织在预冷的研钵中研磨成粉末状,用TRIzol抽提总RNA,用PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒(日本TaKaRa公司) 逆转录成cDNA,用RT-PCR法检测Cxcl1及细胞核因子-κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,Rankl) mRNA表达情况。引物序列如下,Cxcl1,F5’-GGGCGCCTATCGCCAATGAG-3’,R5’-GGGAGCTTCAGGGTCAAGGC-3’;Rankl,F5’-ACGTGAGCTATGGAAGGGGGT-3’,R5’-GCAGGTCCCAGCGCAATGTA-3’;Gapdh,F5’-CGTGTTCCTACCCCCAATGT-3’,R5’-TGTCATCATACTTGGCAGGTTTCT-3’。按照2-△△Ct法计算目的基因相对表达量。
1.4 统计学分析采用SPSS 24.0软件对数据进行统计学分析,计量资料用x±s表示。采用独立样本t检验对2组间数据进行比较,P < 0.05为差异有统计学意义。
2 结果 2.1 结扎浸有热灭活P.g的丝线可诱发种植体周围炎种植体植入4周后,叩诊检查所有种植体呈清脆金属音,用显微组织镊近中、远中、颊侧、舌侧方向夹持时均无松动,周围牙龈粉红色,质地坚韧,无肿胀充血,表明骨结合成功[11]。炎症诱导2周,未出现小鼠死亡或种植体脱落。模型组及治疗组种植体近中、远中、颊侧、舌侧方向上均出现松动,牙龈深红色,质地松脆,肿胀充血。治疗组牙龈肿胀程度较模型组轻,见图 1。
|
| A, control group; B, model group; C, treatment group. 图 1 炎症诱导2周时口内情况 Fig.1 Intraoral conditions after 2 weeks of inflammation induction |
2.2 抑制CXCR2可减轻小鼠种植体周围骨吸收
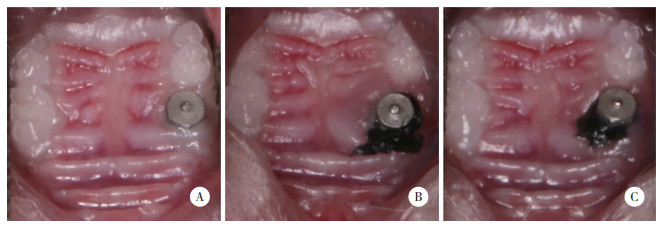
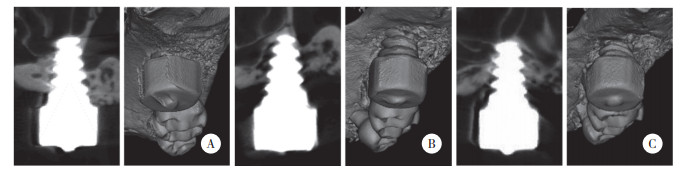
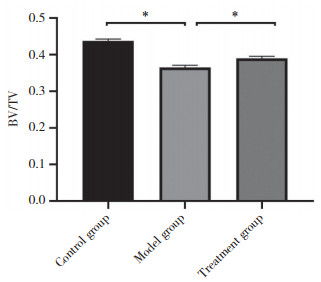
模型组及治疗组小鼠种植体周围出现凹形骨吸收,骨密度减低,骨高度下降,见图 2。与对照组相比,模型组的BV/TV显著降低(P < 0.05),而治疗组的BV/TV较模型组显著升高(P < 0.05),见图 3。
|
| A, control group; B, model group; C, treatment group. 图 2 Micro-CT二维及三维扫描结果 Fig.2 Micro-CT 2D and 3D scan results |
|
| *P < 0.05. 图 3 骨体积分数比较 Fig.3 The comparison of bone volume fraction |
2.3 抑制CXCR2后种植体周围组织中的中性粒细胞和破骨细胞减少
HE染色及IF染色结果显示,相较于对照组,模型组牙龈组织中的总炎症细胞及中性粒细胞显著增多,而治疗组牙龈组织中的总炎症细胞及中性粒细胞较模型组显著减少(P < 0.05),见图 4、5A、5B。TRAP染色结果显示,模型组ROI内的破骨细胞数量显著高于对照组,而抑制CXCR2的治疗组ROI内的破骨细胞数量较模型组显著下降,差异均有统计学意义(均P < 0.05),见图 4、5C。
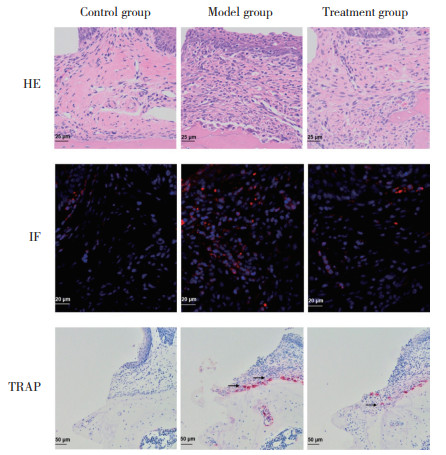
|
| The arrow shows osteoclast. 图 4 组织学染色结果 Fig.4 Histological staining results |
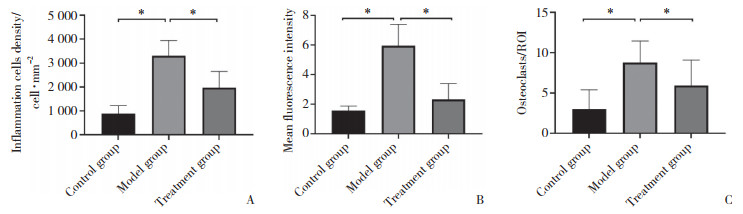
|
| A, inflammatory cell density; B, mean fluorescence intensity of Ly6G (neutrophil marker); C, the amount of osteoclasts. *P < 0.05. 图 5 组织学分析结果 Fig.5 Histological analysis results |
2.4 抑制CXCR2能降低Cxcl1和Rankl mRNA表达水平
RT-PCR结果显示,模型组小鼠牙龈组织中Cxcl1、Rankl mRNA的相对表达水平较对照组明显升高;治疗组小鼠牙龈中Cxcl1、Rankl mRNA的相对表达水平较模型组显著下降,差异均有统计学意义(P < 0.05),见图 6。
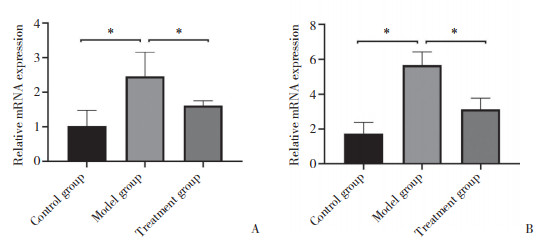
|
| A, Cxc11; B, Rankl. *P < 0.05. 图 6 Cxcl1和Rankl mRNA表达RT-PCR检测结果 Fig.6 The mRNA expression of Cxcl1 and Rankl detected by RT-PCR |
3 讨论
小鼠种植体周围炎模型是研究种植体周围炎病理机制的重要工具。本研究采用的即刻种植方式能有效减少对小鼠的创伤并缩短实验周期,是一种科学、高效的小鼠种植体植入方法。种植体周围炎被定义为发生在已完成骨结合的种植体周围组织的炎症。与人类不同,小鼠种植体植入后愈合4周便能达到理想的骨结合[11-12]。因此,本研究在愈合4周后对小鼠骨结合情况进行了确认,并引入了炎症诱导因素。本研究在前期研究[9]建模方法的基础上引入热灭活P.g,比单纯结扎丝线能更好地模拟细菌因素在种植体周围炎发病机制中的作用。
种植体周围炎与牙周炎相似,是一种由细菌引发、宿主免疫因素参与的感染性疾病[1]。研究[13-15]认为,趋化因子IL-8及其受体CXCR2与种植体周围炎和牙周炎的发生发展密切相关。本研究中,种植体周围炎小鼠牙龈中的Cxcl1 (人IL-8小鼠同源物) mRNA表达升高,使用CXCR2抑制剂后表达下降,进一步证实了上述观点。
IL-8与CXCR2结合后的主要效应是募集活化中性粒细胞。中性粒细胞释放的基质金属蛋白酶、活性氧、胞外诱捕网在杀伤病原微生物的同时也会降解周围组织,加重组织破坏。通过趋化因子受体调控中性粒细胞是抗炎治疗的重要方式[3]。ALAM等[16]在类风湿关节炎及特异性皮炎的研究中发现,用抗体阻断CXCR2能够抑制小鼠中性粒细胞募集,并减轻炎症。STEELE等[17]认为基因敲除CXCR2或者使用药物抑制CXCR2均能有效治疗小鼠胰腺炎。ZHU等[18]发现抑制CXCR2后中性粒细胞释放的髓过氧化物酶、肿瘤坏死因子-α、白细胞介素-1β等促炎症介质减少,而且CXCR2抑制剂SB225002能够缓解小鼠溃疡性结肠炎。本研究利用SB225002抑制种植体周围炎小鼠的CXCR2,发现牙龈组织中总炎症细胞及中性粒细胞显著减少,牙龈炎症减轻,与上述研究结果一致,证明了抑制CXCR2对种植体周围牙龈炎症的治疗具有积极作用。
除牙龈软组织的炎症外,种植体周围炎还伴随活跃的牙槽嵴吸收过程。RANKL在该过程中发挥关键作用,通过与前破骨细胞上的细胞核因子-κB受体活化因子(receptor activator of nuclear factor-κB,RANK) 结合,诱导破骨细胞分化成熟,进而促进骨质吸收[19]。本研究阻断CXCR2后,Rankl mRNA表达量及破骨细胞数量显著下降,可能与抑制CXCR2受体导致的中性粒细胞募集减少有关。中性粒细胞是RANKL的重要来源细胞,不仅可通过表达膜结合型RANKL直接诱导破骨细胞活化,还可通过分泌弹性蛋白酶对RANKL的竞争性配体骨保护素进行降解,间接促进破骨细胞的生成[20-21]。本研究中,抑制CXCR2受体后引发的Rankl mRNA表达下降、破骨细胞减少还可能与IL-8的生物效能被阻断有关。IL-8是一种多效细胞因子,通过与CXCR2结合,激活下游信号,不仅可以促进RANKL的表达,还可直接诱导破骨细胞生成。KOPESKY等[22]的体外研究证明,即使RANKL持续存在,向前破骨细胞中添加IL-8抗体或者CXCR2拮抗剂仍能有效抑制破骨细胞的分化。因此,本研究中阻断CXCR2后出现的Rankl mRNA表达下降、破骨细胞减少可能是中性粒细胞募集减少和IL-8功能受阻的综合表现。
综上所述,本研究发现,抑制CXCR2能够减少小鼠种植体周围炎的中性粒细胞募集和破骨细胞生成,进而缓解小鼠种植体周围炎,但其具体的病理机制尚需进一步研究。由于研究条件有限,本研究未对在小鼠种植体周围炎中抑制CXCR2产生的作用进行时序观察,有待今后进一步探究。
| [1] |
EPHROS H, KIM S, DEFALCO R. Peri-implantitis: evaluation and management[J]. Dent Clin North Am, 2020, 64(2): 305-313. DOI:10.1016/j.cden.2019.11.002 |
| [2] |
KLINGE B, KLINGE A, BERTL K, et al. Peri-implant diseases[J]. Eur J Oral Sci, 2018, 126(Suppl 1): 88-94. DOI:10.1111/eos.12529 |
| [3] |
CHENG Y, MA XL, WEI YQ, et al. Potential roles and targeted therapy of the CXCLs/CXCR2 axis in cancer and inflammatory diseases[J]. Biochim Biophys Acta Rev Cancer, 2019, 1871(2): 289-312. DOI:10.1016/j.bbcan.2019.01.005 |
| [4] |
王欣宇, 孙琳, 刘湘源, 等. 趋化因子受体CXCR1/2及其配体在骨代谢中的作用[J]. 中华风湿病学杂志, 2021, 25(1): 61-64. DOI:10.3760/cma.j.c141217-20200226-00069 |
| [5] |
WANG C, LIU Y, WANG Y, et al. Adenovirus-mediated siRNA targeting CXCR2 attenuates titanium particle-induced osteolysis by suppressing osteoclast formation[J]. Med Sci Monit, 2016, 22: 727-735. DOI:10.12659/msm.897243 |
| [6] |
ASANO M, YAMAGUCHI M, NAKAJIMA R, et al. IL-8 and MCP-1 induced by excessive orthodontic force mediates odontoclastogenesis in periodontal tissues[J]. Oral Dis, 2011, 17(5): 489-498. DOI:10.1111/j.1601-0825.2010.01780.x |
| [7] |
VALERIO MS, HERBERT BA, BASILAKOS DS, et al. Critical role of MKP-1 in lipopolysaccharide-induced osteoclast formation through CXCL1 and CXCL2[J]. Cytokine, 2015, 71(1): 71-80. DOI:10.1016/j.cyto.2014.08.007 |
| [8] |
YEE M, KIM A, ALPAGOT T, et al. Porphyromonas gingivalis stimulates IL-18 secretion in human monocytic THP-1 cells[J]. Microbes Infect, 2012, 14(9): 684-689. DOI:10.1016/j.micinf.2012.03.002 |
| [9] |
宋续军. 种植体周围炎小鼠模型的建立及NLRP3在模型中的表达研究附20例临床病例汇报[D]. 青岛, 青岛大学: 2020. DOI: 0.27262/1d.cnki.gqdau.2020.000278.
|
| [10] |
ROCHA FRG, DELITTO AE, DE SOUZA JAC, et al. NLRC4 inflammasome has a protective role on inflammatory bone resorption in a murine model of periodontal disease[J]. Immunobiology, 2020, 225(1): 151855. DOI:10.1016/j.imbio.2019.10.004 |
| [11] |
DENG S, HU Y, ZHOU J, et al. TLR4 mediates alveolar bone resorption in experimental peri-implantitis through regulation of CD45+ cell infiltration, RANKL/OPG ratio, and inflammatory cytokine production[J]. J Periodontol, 2020, 91(5): 671-682. DOI:10.1002/JPER.18-0748 |
| [12] |
TAKAMORI Y, ATSUTA I, NAKAMURA H, et al. Histopathological comparison of the onset of peri-implantitis and periodontitis in rats[J]. Clin Oral Implants Res, 2017, 28(2): 163-170. DOI:10.1111/clr.12777 |
| [13] |
SCHMINKE B, VOM ORDE F, GRUBER R, et al. The pathology of bone tissue during peri-implantitis[J]. J Dent Res, 2015, 94(2): 354-361. DOI:10.1177/0022034514559128 |
| [14] |
QI YS, LI C, DU YM, et al. Chemokine receptor 2 (CXCR2) gene polymorphisms and their association with the risk of developing peri-implantitis in Chinese Han population[J]. J Inflamm Res, 2021, 14: 1625-1631. DOI:10.2147/JIR.S304261 |
| [15] |
HUANG YK, TSENG KF, TSAI PH, et al. IL-8 as a potential therapeutic target for periodontitis and its inhibition by caffeic acid phenethyl ester in vitro[J]. Int J Mol Sci, 2021, 22(7): 3641. DOI:10.3390/ijms22073641 |
| [16] |
ALAM MJ, XIE L, ANG C, et al. Therapeutic blockade of CXCR2 rapidly clears inflammation in arthritis and atopic dermatitis models: demonstration with surrogate and humanized antibodies[J]. mAbs, 2020, 12(1): 1856460. DOI:10.1080/19420862.2020.1856460 |
| [17] |
STEELE CW, KARIM SA, FOTH M, et al. CXCR2 inhibition suppresses acute and chronic pancreatic inflammation[J]. J Pathol, 2015, 237(1): 85-97. DOI:10.1002/path.4555 |
| [18] |
ZHU FQ, HE H, FAN L, et al. Blockade of CXCR2 suppresses proinflammatory activities of neutrophils in ulcerative colitis[J]. Am J Transl Res, 2020, 12(9): 5237-5251. |
| [19] |
赵娇阳, 时静, 李文晋. OPG/RANKL/RANK信号通路在牙槽骨代谢中研究进展[J]. 临床军医杂志, 2022, 50(2): 214-217. DOI:10.16680/j.1671-3826.2022.02.30 |
| [20] |
CHAKRAVARTI A, RAQUIL MA, TESSIER P, et al. Surface RANKL of Toll-like receptor 4-stimulated human neutrophils activates osteoclastic bone resorption[J]. Blood, 2009, 114(8): 1633-1644. DOI:10.1182/blood-2008-09-178301 |
| [21] |
SUGISAKI R, MIYAMOTO Y, YOSHIMURA K, et al. Possible involvement of elastase in enhanced osteoclast differentiation by neutrophils through degradation of osteoprotegerin[J]. Bone, 2020, 132: 115216. DOI:10.1016/j.bone.2019.115216 |
| [22] |
KOPESKY P, TIEDEMANN K, ALKEKHIA D, et al. Autocrine signaling is a key regulatory element during osteoclastogenesis[J]. Biol Open, 2014, 3(8): 767-776. DOI:10.1242/bio.20148128 |
 2022, Vol. 51
2022, Vol. 51