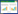文章信息
- 李明虹, 杨舒筠, 李丹, 李星道, 刘希冲, 高文婷, 姬晓彤, 白剑英
- LI Minghong, YANG Shuyun, LI Dan, LI Xingdao, LIU Xichong, GAO Wenting, JI Xiaotong, BAI Jianying
- 亚硫酸钠暴露对人正常肝细胞自噬的影响及其作用机制
- Effect of sodium sulfite exposure on autophagy of normal human hepatocytes and its mechanism
- 中国医科大学学报, 2022, 51(5): 401-408
- Journal of China Medical University, 2022, 51(5): 401-408
-
文章历史
- 收稿日期:2021-08-23
- 网络出版时间:2022-05-23 15:02
2. 太原市疾病预防控制中心有害生物控制科,太原 030001
2. Department of Pest Control, The Center for Disease Control and Prevention of Taiyuan, Taiyuan 030001, China
亚硫酸钠(Na2SO3) 在食品生产和加工行业中广泛用作添加剂、防腐剂、还原剂、骨质疏松剂或色素去除剂[1],通常存在于坚果、果脯、干菜、银耳、粉丝、马铃薯或甘薯淀粉、竹笋、罐头、高浓度葡萄酒和果酒等食品中[2]。研究[3]表明Na2SO3对神经系统有毒性,Na2SO3氧化酶缺乏时表现一定的神经系统损伤症状(智力低下、共济失调、疲劳等)。当体内Na2SO3高水平(约2 mmol/L) 蓄积时,会导致婴儿或青少年早期死亡。Na2SO3也可引起特定敏感人群的致命哮喘[4]。研究[5]显示Na2SO3与肾脏损害有关,长期透析治疗的慢性肾脏病患者尿中Na2SO3浓度平均为(3.80±3.32) μmol/L,高于健康人群[(1.55±0.54) μmol/L]。
前期研究发现Na2SO3暴露可导致小鼠肝脏坏死性改变,这与Na2SO3暴露增加血清转氨酶活性并可能导致肝损伤的临床研究[6]结果一致。前期研究[7]还发现Na2SO3可增加肝细胞受体相互作用蛋白激酶1 (receptor interacting protein kinase 1,RIP1) 的表达,这说明Na2SO3可能与程序性细胞坏死或凋亡有关。自噬是一种高度保守的机制,将受损的细胞、退化或老化的蛋白质和细胞器带到溶酶体消化,以维持细胞内稳态。在正常生理过程中,自噬可以抵抗病毒感染,限制过度炎症反应,起到保护机体稳态的作用[7]。研究[8]发现自噬抑制可促进癌细胞凋亡、坏死,自噬缺陷也会导致肝脏中的蛋白质积累,导致肝肿大、肝细胞死和肝衰竭。
自噬相关蛋白LC3在自噬过程中发挥关键作用,自噬受体蛋白p62通过泛素化与LC3相互作用区域(LC3 interacting region,LIRs) 结合,并促进底物与吞噬体的结合。因此,LC3和底物蛋白p62的结合在底物的选择、靶向和降解中至关重要[9]。AMP活化蛋白激酶(AMP-activated protein kinase,AMPK) 是一种关键的能量传感器,可感知细胞能量状态以维持能量稳态,是自噬调节的关键蛋白[10]。本研究探讨Na2SO3暴露对人正常肝细胞自噬的影响及其作用机制,旨在为制定食品添加剂中Na2SO3安全限值提供一定的参考价值,同时为严重Na2SO3中毒治疗寻找可能的作用靶点。
1 材料与方法 1.1 细胞株与主要试剂人正常肝细胞株HL-7702购自中国科学院上海细胞生物研究所干细胞库。主要试剂包括Na2SO3 (美国Sigma-Aldrich公司)、胰蛋白酶(美国Sigma-Aldrich公司)、DMEM培养基(美国Gibco公司)、CCK-8试剂盒(日本Dojindo Molecular Technologies公司)、Alexa Fluor 488山羊抗兔IgG (美国Invitrogen公司)、胎牛血清(浙江天杭生物科技股份有限公司)、蛋白显影发光液ECL Plus试剂盒(美国Pierce Biotechnology公司)、ATP检测试剂盒(S0026) (上海碧云天生物技术有限公司)。主要抗体包括兔抗LC3B (D11) 单克隆抗体、兔抗SQSTM1/p62单克隆抗体、兔抗AMPKα、兔抗p-AMPKα、小鼠抗caspase-3单抗和兔抗cleaved caspase-3 (Asp175) (美国Cell Signaling Technology公司),兔抗β-actin单抗(Asp175) (美国Santa Cruz Biotechnology公司),辣根过氧化物酶标记的二抗(武汉三鹰生物公司)。
1.2 细胞培养、分组及处理用DMEM高糖培养基培养HL-7702细胞。在培养基中添加谷氨酰胺(1 mmol/L)、青霉素(100 U/mL),链霉素(100 μg/mL) 和10% 胎牛血清,于37 ℃、5% CO2培养箱中培养。每2~3 d传代1次,取对数生长期细胞进行后续实验。
待细胞融合度达80%左右时,用0.25%胰酶消化细胞,制成细胞悬液,调整细胞密度铺板,将细胞分为7组:阴性对照组(含10%胎牛血清的DMEM培养基),Na2SO3暴露组(0.1、1、2.5、5mmol/L),阳性对照组(CCl4 20 mmol/L) 和溶剂对照组(0.2% DMSO),每组设3个平行。按分组处理细胞后,将各组细胞置于37 ℃、5% CO2培养箱中分别暴露2 h、48 h后,进行后续实验研究。
1.3 CCK-8试剂盒测定细胞活力HL-7702细胞长到80%,用0.25%胰酶消化细胞,制成细胞悬液,将细胞接种于96孔板中,每孔100 μL (1.5×105/孔) 细胞悬液,将培养板置于37 ℃、5%CO2培养箱预培养24 h。按分组及Na2SO3暴露时间干预HL-7702。待暴露结束后向每孔加入10 μL CCK-8试剂,将培养板置于37 ℃、5% CO2培养箱4 h,用酶标仪测定各组细胞在450 nm处的吸光度(optical density,OD) 值,计算各组细胞存活率,细胞存活率(%) = (暴露组OD值-空白组OD值) / (阴性对照组OD值-空白组OD值) ×100。空白组为只含10%胎牛血清的DMEM培养基。
1.4 免疫荧光法检测LC3B蛋白表达HL-7702细胞长到80%,用0.25%胰酶消化细胞,制成细胞悬液,将细胞接种于24孔板上,按实验分组干预2 h、48 h后,吸弃上清,每孔用无菌PBS清洗3次,每次5 min;每孔加预冷4%甲醇室温固定20 min。然后用PBS/0.1%Triton渗透细胞,10%山羊血清封闭,一抗LC3B抗体(1∶200) 稀释孵育过夜,PBS洗涤3次,每次3 min,Alexa 488标记的二抗(1∶500) 稀释孵育2 h。PBS洗涤3次后,hoechst33342复染10 min,抗荧光猝灭剂封片。免疫荧光显微镜观察图片。
1.5 Western blotting检测HL-7702细胞中LC3B、p62及AMPK蛋白表达HL-7702细胞长至对数生长期,调整细胞密度为3×106/mL,接种于6孔板中,置于37 ℃、5% CO2培养箱中培养过夜。按实验分组及暴露时间干预HL-7702细胞,干预结束后用无菌PBS清洗,每孔加入细胞裂解液200 μL,将6孔板置于冰上10 min,收集各组蛋白,采用BCA法进行蛋白定量。制备分离胶、浓缩胶,上样,以80 V电压电泳150 min,使用湿式转膜法将蛋白转移至PVDF膜,400 mA电流转膜60 min。用5%脱脂奶粉室温封闭2 h,一抗、二抗孵育后加ECL发光液后于多功能化学发光成像分析系统BG-gdsAUTO 720显影。采用Image-Pro Plus 6. 0图像分析软件进行蛋白表达的半定量分析。
1.6 HL-7702细胞内ATP含量检测按分组暴露时间干预HL-7702细胞。干预结束后,吸弃培养液,冷PBS洗涤细胞,每孔加入200 μL全细胞裂解液。待细胞完全裂解后收集各组细胞裂解液,4 ℃ 12 000 r/min离心10 min。取离心后上清液按照Beyotime ATP检测试剂盒说明书检测ATP水平。在96孔板中,每孔加100 μL ATP检测工作液,室温静置3~5 min,再向各孔中加入20 μL标准品或样品,立即用移液器混匀后,用化学发光仪测定相对光单位(relative light unit,RLU) 值,根据标准曲线计算样品中ATP浓度。每个样品设3个复孔,将计算得到的ATP浓度换算为蛋白(nmol/mg) 形式。
1.7 统计学分析数据使用SPSS 26.0软件包进行统计分析,计量资料以x±s表示,多组间比较进行方差齐性检验、单因素方差分析;各组间两两比较采用Dunnet t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 Na2SO3暴露对HL-7702细胞的毒性作用结果显示,与阴性对照组比较,2 h、48 h 0.1 mmol/L Na2SO3暴露组细胞存活率无明显变化;1、2.5、5 mmol/L Na2SO3暴露组2 h、48 h细胞存活率随Na2SO3浓度的升高而降低(P < 0.05);阳性对照组细胞存活率也明显下降(P < 0.05)。见表 1。
| Group | Survival rate (%) | |
| 2 h | 48 h | |
| Negative control | 100.00±0.12 | 100.00±0.26 |
| 0.1 mmol/L Na2SO3 | 101.27±1.33 | 101.14±3.05 |
| 1 mmol/L Na2SO3 | 94.83±2.171) | 91.02±2.381) |
| 2.5 mmol/L Na2SO3 | 89.76±2.131) | 82.04±1.171) |
| 5 mmol/L Na2SO3 | 82.94±0.631) | 73.58±2.531) |
| Positive control | 16.94±1.391) | 12.45±3.061) |
| 0.2% DMSO | 99.05±2.74 | 100.08±4.71 |
| 1) P < 0.05 vs negative control group. | ||
2.2 Na2SO3暴露对HL-7702细胞细胞核形态及LC3B表达的影响
Alexa Fluor 488标记的LC3B在蓝色激发光下呈现绿色荧光,Hoechst33258复染的细胞核在紫外激发光作用下呈现蓝色荧光,Merge为两者的合并图。与阴性对照组比较,Na2SO3暴露各组HL-7702细胞中LC3B蛋白的绿色荧光强度在2 h时无明显变化,而在48 h时0.1、1 mmol/L Na2SO3暴露组荧光强度增加,2.5、5 mmol/L Na2SO3暴露组荧光强度减弱。与阴性对照组比较,阳性对照组HL-7702细胞2 h和48 h时的绿色荧光强度均明显增加。表明高剂量、长时间Na2SO3暴露可降低HL-7702细胞中LC3B蛋白的表达,且在较高剂量水平时LC3B蛋白表达水平随Na2SO3浓度的增加而降低。见图 1。
|
| A, Na2SO3 exposure for 2 h; B, Na2SO3 exposure for 48 h. 图 1 Na2SO3暴露2 h、48 h时各组LC3B蛋白表达×400 Fig.1 LC3B protein expression after sulfite exposure for 2 h and 48 h in each group by immunofluorescence × 400 |
2.3 Na2SO3暴露对各组HL-7702细胞中蛋白表达的影响 2.3.1 LC3B蛋白表达
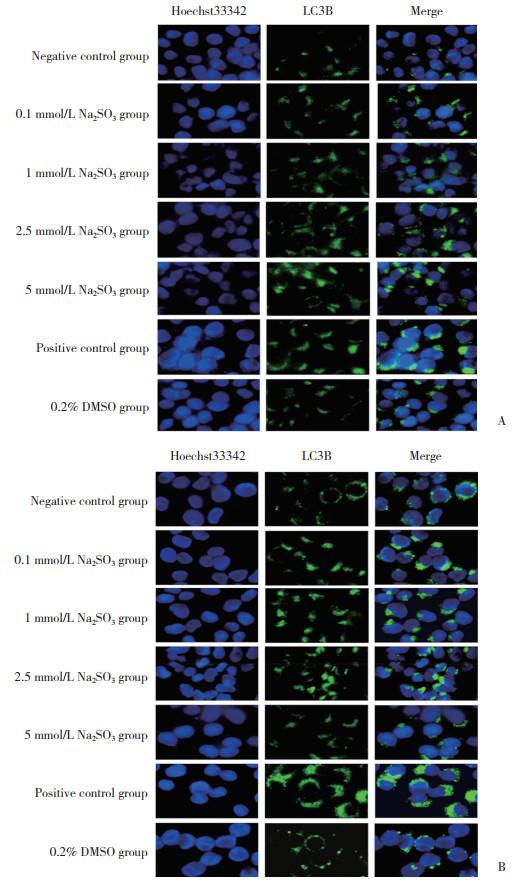
与阴性对照组比较,暴露2 h时1、5 mmol/L Na2SO3组LC3B-Ⅱ蛋白表达均明显增加(P < 0.05);暴露48 h时0.1、1 mmol/L Na2SO3组LC3B-Ⅱ蛋白表达增加(P < 0.05);而2.5、5 mmol/L Na2SO3组LC3B-Ⅱ表达下降(P < 0.05)。与阴性对照组比较,暴露48 h时5 mmol/L Na2SO3组LC3B-Ⅱ表达下降最明显,差异有统计学意义(P < 0.05)。与阴性对照组比较,阳性对照组暴露2 h、48 h时LC3-Ⅱ蛋白表达均明显增加,差异有统计学意义(P < 0.05),见图 2。
|
| 1, negative control group; 2, 0.1 mmol/L Na2SO3 group; 3, 1 mmol/L Na2SO3 group; 4, 2.5 mmol/L Na2SO3 group; 5, 5 mmol/L Na2SO3 group; 6, positive control group; 7, 0.2% DMSO group. A, Na2SO3 exposure for 2 h; B, Na2SO3 exposure for 48 h.* P < 0.05 vs negative control group. 图 2 Na2SO3暴露2 h、48 h时HL-7702细胞中LC3B表达 Fig.2 LC3B protein expression after sulfite exposure for 2 h and 48 h in each group |
2.3.2 p62蛋白表达
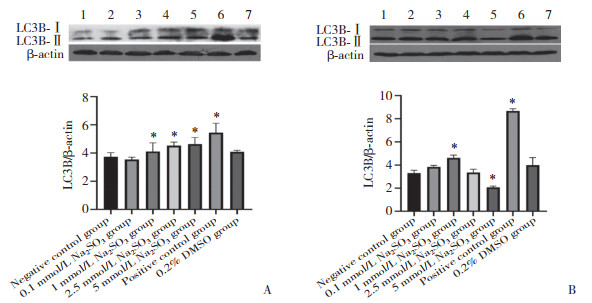
与阴性对照组比较,暴露2 h时Na2SO3各组p62蛋白表达均明显增加(P < 0.05);而暴露48 h时Na2SO3各组,随着Na2SO3暴露剂量的增加,p62蛋白表达逐渐降低,其中2.5、5 mmol/L Na2SO3组,p62蛋白表达显著降低(P < 0.05)。与阴性对照组比较,阳性对照组48 h p62蛋白表达增加(P < 0.05),见图 3。
|
| 1, negative control group; 2, 0.1 mmol/L Na2SO3 group; 3, 1 mmol/L Na2SO3 group; 4, 2.5 mmol/L Na2SO3 group; 5, 5 mmol/L Na2SO3 group; 6, positive control group; 7, 0.2% DMSO group. A, Na2SO3 exposure for 2 h; B, Na2SO3 exposure for 48 h.* P < 0.05 vs negative control group. 图 3 Na2SO3暴露2 h、48 h时HL-7702细胞中p62表达 Fig.3 p62 protein expression after sulfite exposure for 2 h and 48 h in each group |
2.3.3 AMPK蛋白表达
与阴性对照组比较,暴露2 h时Na2SO3各组AMPKα蛋白表达均无明显变化,暴露48 h时阳性对照组AMPKα蛋白表达升高(P < 0.05)。见图 4。
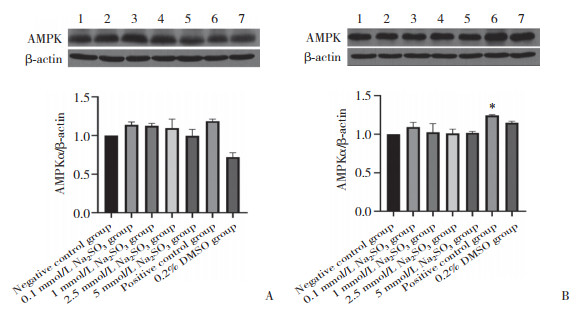
|
| A, Na2SO3 exposure for 2 h; B, Na2SO3 exposure for 48 h. 1, negative control group; 2, 0.1 mmol/L Na2SO3 group; 3, 1 mmol/L Na2SO3 group; 4, 2.5 mmol/L Na2SO3 group; 5, 5 mmol/L Na2SO3 group; 6, positive control group; 7, 0.2% DMSO group. * P < 0.05 vs negative control group. 图 4 Na2SO3暴露2 h、48 h时HL-7702细胞中AMPKα表达 Fig.4 AMPKα protein expression after sulfite exposure for 2 h and 48 h in each group |
2.3.4 caspase-3蛋白表达
与阴性对照组比较,暴露2 h时Na2SO3各组caspase-3无明显变化,活化的caspase-3 (cleaved caspase-3) 蛋白均未表达。与阴性对照组比较,暴露48 h时Na2SO3各组caspase-3无明显变化,而阳性对照组caspase-3表达增加(P < 0.05);1、2.5、5 mmol/L Na2SO3各暴露组cleaved caspase-3表达增加(P < 0.05),且呈现浓度依从性;阳性对照组cleaved caspase-3表达增加(P < 0.05)。见图 5。
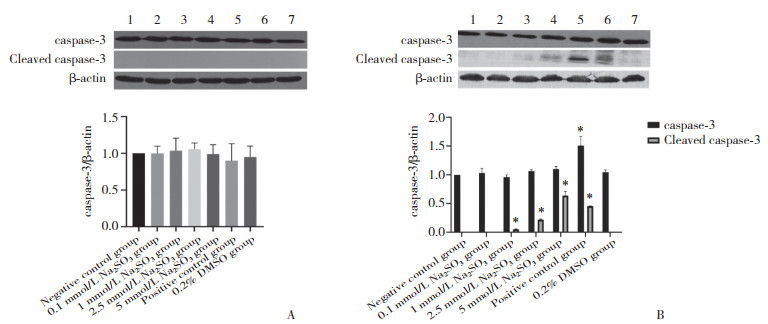
|
| A, Na2SO3 exposure for 2 h; B, Na2SO3 exposure for 48 h. 1, negative control group; 2, 0.1 mmol/L Na2SO3 group; 3, 1 mmol/L Na2SO3 group; 4, 2.5 mmol/L Na2SO3 group; 5, 5 mmol/L Na2SO3 group; 6, positive control group; 7, 0.2% DMSO group. * P < 0.05 vs negative control group. 图 5 Na2SO3暴露2 h、48 h时HL-7702细胞中caspase-3表达 Fig.5 Caspase-3 protein expression after sulfite exposure for 2 h and 48 h in each group |
2.4 Na2SO3暴露对各组HL-7702细胞中ATP含量的影响
结果显示,与阴性对照组比较,暴露2 h、48 h时Na2SO3各组ATP含量均显著升高(P < 0.05),见表 2。
| Group | ATP (nmol/mg) | |
| 2 h | 48 h | |
| Negative control | 0.297±0.05 | 0.398±0.03 |
| 0.1 mmol/L Na2SO3 | 0.321±0.011) | 0.437±0.031) |
| 1 mmol/L Na2SO3 | 0.374±0.031) | 0.971±0.021) |
| 2.5 mmol/L Na2SO3 | 0.392±0.031) | 1.717±0.061) |
| 5 mmol/L Na2SO3 | 0.398±0.021) | 1.849±0.281) |
| 20 mmol/L CCL4 | 0.329±0.011) | 0.571±0.081) |
| 0.2% DMSO | 0.237±0.01 | 0.338±0.01 |
| 1) P < 0.05 vs negative control group. | ||
3 讨论
Na2SO3是防止食品变质常用的一种食品添加剂。动物实验发现Na2SO3可致小鼠肝损伤和细胞死亡[11]。本研究采用体外实验模型探讨Na2SO3长期暴露效应,结果显示,1~5 mmol/L Na2SO3各暴露组干预2 h、48 h均可使细胞活力下降,且随着Na2SO3浓度增加和暴露时间延长细胞存活率逐渐降低,表明较高浓度的Na2SO3暴露可造成肝细胞死亡,且存在剂量时间效应关系。
自噬是真核细胞维持稳态和细胞存活的重要机制,可将聚集的蛋白质或受损的细胞器在溶酶体中蛋白水解酶的控制下降解[12]。LC3B-Ⅱ是自噬体形成的标志,是评估细胞中自噬体数量的金标准[13]。
本研究免疫荧光结果显示,48 h LC3B荧光强度先增强后减弱(0.1、1 mmol/L Na2SO3暴露组荧光强度增加,2.5、5 mmol/L Na2SO3暴露组荧光强度减弱),提示高剂量长时间Na2SO3暴露可使HL-7702细胞中LC3B蛋白表达降低,且高剂量时,蛋白表达水平随Na2SO3浓度的增加而降低,推测高剂量长时间Na2SO3作用会抑制细胞自噬。Western blotting结果显示,Na2SO3暴露2 h时,1、2.5、5 mmol/L Na2SO3组LC3B-Ⅱ蛋白表达均明显增加,说明Na2SO3可促进肝细胞自噬前体的形成及逐步成熟,暴露48 h时随着Na2SO3浓度的增加,LC3B-Ⅱ蛋白表达先增加后下降,且在5 mmol/L Na2SO3时LC3B-Ⅱ蛋白表达下降最明显,与免疫荧光结果一致。推测低浓度短时间的Na2SO3暴露促进细胞自噬的发生,而长时间高剂量Na2SO3暴露抑制自噬的发生。KOMATSU等[14]研究发现异常自噬可引起肝损伤,与本研究结果一致。
当自噬途径正常时,p62将随自噬降解底物一起降解。当自噬途径被阻断时,p62将被累积。过量的p62蛋白可抑制蛋白酶体对泛素化蛋白的降解,大量泛素化蛋白积聚,最终导致细胞死亡[15]。本研究结果显示,暴露2 h时Na2SO3各组p62蛋白表达均增加;而暴露48 h时各组随着Na2SO3浓度的增加,p62蛋白表达逐渐降低,且在5 mmol/L Na2SO3组下降最明显,推测其可能的原因是:长时间高浓度Na2SO3暴露引起的自噬已趋于完成,同时增强的自噬作用降解了自噬相关蛋白p62,使p62蛋白表达降低。LC3B作为p62的底物适配器,可招募自噬受体p62。自噬抑制后LC3B表达量下降,此时选择性自噬发挥作用,p62也被选择性自噬降解[16]。阳性对照组在48 h时蛋白表达水平增加,表明CCl4可促进肝细胞自噬。研究[17]表明CCl4可诱导肝损伤,CCl4暴露会损害细胞线粒体,受损线粒体定位到含有LC3的膜上,激活细胞自噬,促进自噬体的形成,随后自噬体与溶酶体融合,达到清除细胞的目的。本研究结果显示,暴露48 h时5 mmol/L Na2SO3与阳性对照组HL-7702细胞内LC3、p62蛋白表达变化不一致,推测可能是Na2SO3与CCl4引起HL-7702细胞死亡的机制不同所致。
AMPK是维持体内代谢平衡的关键酶,与自噬在不同组织中的活化有关[18],朱朋飞等[19]研究发现当细胞缺乏能量(ATP) 后,ATP/AMP下降可以激活AMPK,AMPK激活时,FOXO3的磷酸化激活自噬基因。本研究尝试从ATP和AMPK的变化中去探讨Na2SO3暴露引起自噬可能的途径。结果显示,随着Na2SO3暴露剂量的增加,2 h、48 h时HL-7702细胞内ATP增加,而AMPK蛋白表达无明显变化;本研究未检测到磷酸化AMPK的表达,提示短时间低剂量Na2SO3暴露引发的肝细胞自噬过程的增强并不是由于ATP合成受到抑制,反馈性诱导AMPK的激活所导致。因此推测Na2SO3暴露引起的肝细胞自噬异常可能不是通过AMPK途径,而ATP的持续升高可能是由于自噬本身降解了底物所产生的,或者是细胞功能活动受到抑制而ATP消耗减少所致,但具体的机制还有待进一步研究。
自噬与细胞凋亡密切相关,本研究测定了凋亡相关蛋白caspase-3的表达水平,结果显示,暴露2 h、48 h时Na2SO3各组caspase-3表达无明显变化,但Na2SO3暴露48 h后,1、2.5、5 mmol/L Na2SO3组cleaved caspase-3增加,且cleaved caspase-3表达水平随着Na2SO3浓度增加而增加,推测高浓度长时间Na2SO3暴露可促进细胞凋亡。
综上所述,高浓度(5 mmol/L) Na2SO3暴露能抑制HL-7702细胞自噬,促进细胞凋亡。其作用机制可能是通过降低LC3B和p62蛋白表达来实现的。细胞中自噬、死亡及细胞凋亡等多种模式同时发生,并可相互串扰和重叠。本研究尚无法明确Na2SO3暴露引起的细胞凋亡与自噬之间的关系是相互促进还是相互拮抗,推测自噬抑制可能是其引起细胞死亡的机制之一。希望今后进一步明确Na2SO3暴露引起肝损伤的效应机制。
| [1] |
SILVA M, GAMA J, PINTO N, et al. Sulfite concentration and the occurrence of headache in young adults: a prospective study[J]. Eur J Clin Nutr, 2019, 73(9): 1316-1322. DOI:10.1038/s41430-019-0420-2 |
| [2] |
GARAGUSO I, NARDINI M. Polyphenols content, phenolics profile and antioxidant activity of organic red wines produced without sulfur dioxide/sulfites addition in comparison to conventional red wines[J]. Food Chem, 2015, 179: 336-342. DOI:10.1016/j.foodchem.2015.01.144 |
| [3] |
KOHL JB, MELLIS AT, SCHWARZ G. Homeostatic impact of sulfite and hydrogen sulfide on cysteine catabolism[J]. Br J Pharmacol, 2019, 176(4): 554-570. DOI:10.1111/bph.14464 |
| [4] |
KUMAR A, TRIQUIGNEAUX M, MADENSPACHER J, et al. Sulfite-induced protein radical formation in LPS aerosol-challenged mice: implications for sulfite sensitivity in human lung disease[J]. Redox Biol, 2018, 15: 327-334. DOI:10.1016/j.redox.2017.12.014 |
| [5] |
VINCENT AS, LIM BG, TAN J, et al. Sulfite-mediated oxidative stress in kidney cells[J]. Kidney Int, 2004, 65(2): 393-402. DOI:10.1111/j.1523-1755.2004.00391.x |
| [6] |
MELLIS AT, MISKO AL, ARJUNE S, et al. The role of glutamate oxaloacetate transaminases in sulfite biosynthesis and H2S metabolism[J]. Redox Biol, 2021, 38: 101800. DOI:10.1016/j.redox.2020.101800 |
| [7] |
杨舒筠, 白剑英, 张艳, 等. 亚硫酸钠对人正常二倍体肝细胞的损伤作用程序性坏死相关蛋白受体相互作用蛋白1表达的影响[J]. 环境与健康杂志, 2015, 32(12): 1061-1064. DOI:10.16241/j.cnki.1001-5914.2015.12.006 |
| [8] |
郭海清, 陈亚利, 段钟平, 等. 细胞自噬与肝炎病毒感染的相关性研究[J]. 胃肠病学和肝病学杂志, 2015, 24(4): 381-384. DOI:10.3969/j.issn.1006-5709.2015.040.04 |
| [9] |
SCHAAF MBE, KEULERS TG, VOOIJS MA, et al. LC3/GABARAP family proteins: autophagy- (un) related functions[J]. FASEB J, 2016, 30(12): 3961-3978. DOI:10.1096/fj.201600698R |
| [10] |
KIM J, KUNDU M, VIOLLET B, et al. AMPK and mTOR regulate autophagy through direct phosphorylation of Ulk1[J]. Nat Cell Biol, 2011, 13(2): 132-141. DOI:10.1038/ncb2152 |
| [11] |
MENG ZQ. Oxidative damage of sulfur dioxide on various organs of mice: sulfur dioxide is a systemic oxidative damage agent[J]. Inhal Toxicol, 2003, 15(2): 181-195. DOI:10.1080/08958370304476 |
| [12] |
LEVINE B, KROEMER G. Biological functions of autophagy genes: a disease perspective[J]. Cell, 2019, 176(1/2): 11-42. DOI:10.1016/j.cell.2018.09.048 |
| [13] |
RUNWAL G, STAMATAKOU E, SIDDIQI FH, et al. LC3-positive structures are prominent in autophagy-deficient cells[J]. Sci Rep, 2019, 9(1): 10147. DOI:10.1038/s41598-019-46657-z |
| [14] |
KOMATSU M, ICHIMURA Y. Physiological significance of selective degradation of p62 by autophagy[J]. FEBS Lett, 2010, 584(7): 1374-1378. DOI:10.1016/j.febslet.2010.02.017 |
| [15] |
JEONG SJ, ZHANG XY, RODRIGUEZ-VELEZ A, et al. p62/SQSTM1 and selective autophagy in cardiometabolic diseases[J]. Antioxid Redox Signal, 2019, 31(6): 458-471. DOI:10.1089/ars.2018.7649 |
| [16] |
LAMARK T, SVENNING S, JOHANSEN T. Regulation of selective autophagy: the p62/SQSTM1 paradigm[J]. Essays Biochem, 2017, 61(6): 609-624. DOI:10.1042/EBC20170035 |
| [17] |
KANG JW, HONG JM, LEE SM. Melatonin enhances mitophagy and mitochondrial biogenesis in rats with carbon tetrachloride-induced liver fibrosis[J]. J Pineal Res, 2016, 60(4): 383-393. DOI:10.1111/jpi.12319 |
| [18] |
KE R, XU QC, LI C, et al. Mechanisms of AMPK in the maintenance of ATP balance during energy metabolism[J]. Cell Biol Int, 2018, 42(4): 384-392. DOI:10.1002/cbin.10915 |
| [19] |
朱朋飞, 秦建民. 细胞自噬在原发性肝癌发生与防治中的生物学作用[J]. 中国医药科学, 2015, 5(4): 24-28. |
 2022, Vol. 51
2022, Vol. 51