文章信息
- 高立伟, 杨雄涛, 谷润川, 许长丹, 朱广迎
- GAO Liwei, YANG Xiongtao, GU Runchuan, XU Changdan, ZHU Guangying
- 局限期小细胞肺癌同步放化疗中不同靶区勾画模式对疗效及毒性反应影响的对比研究
- Comparative study on the efficacy and toxicity of different clinical target volume models in limited disease small cell lung cancer with concurrent chemoradiotherapy
- 中国医科大学学报, 2022, 51(5): 390-394
- Journal of China Medical University, 2022, 51(5): 390-394
-
文章历史
- 收稿日期:2022-03-25
- 网络出版时间:2022-05-23 13:37
2. 北京大学中日友好临床医学院放射肿瘤科,北京 100029
2. Department of Radiation Oncology, Peking University China-Japan Friendship School of Clinical Medicine, Beijing 100029, China
肺癌是全球发病率、致死率排名第一的恶性肿瘤[1]。根据病理形态,肺癌主要分为非小细胞肺癌(non-small cell lung cancer,NSCLC) 和小细胞肺癌(small cell lung cancer,SCLC) 2种。SCLC约占所有肺癌患者总数的14%[2],按病程早晚分为局限期小细胞肺癌(limited disease small cell lung cancer,LD-SCLC) 和广泛期小细胞肺癌(extensive-stage small cell lung cancer,ES-SCLC) 2类[3]。SCLC的分期由1973年美国退伍军人肺癌协作组(Veterans Administration Lung Group system,VA) [4]和美国癌症联合委员会(American Joint Committee on Cancer,AJCC) 第8版[5]制定的TNM分期来表示。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN) 指南将VA和AJCC系统结合起来,将LD-SCLC定义为AJCC Ⅰ~Ⅲ期疾病(任何T和N,M0,排除多个肺结节、广泛的T3~T4),可以采用根治剂量安全有效治疗[6]的SCLC病例。所有其他SCLC患者被定义为ES-SCLC。LD-SCLC患者占SCLC患者总数的1/3。部分LD-SCLC可通过放化疗联合治疗达到治愈。目前的标准治疗方案为4~6个周期顺铂为基础的化疗同步胸部放疗,胸部放疗与第1或第2个化疗周期同步进行[7],治疗后有部分或完全缓解的患者应在胸部治疗结束后进行预防性脑放疗[8]。LD-SCLC放疗与全身治疗的协同模式、剂量分割方式、靶区范围、靶区勾画方式等方面,目前尚存争议。中日友好医院放射肿瘤科在临床施治过程中,根据医师判断和患者意愿,选择原发灶大体靶区(primary gross tumor target volume,GTVprimary) 扩大与不扩大临床靶区(clinical target volume,CTV) 2种模式。本研究对比了LD-SCLC胸部放疗中GTVprimary扩大与不扩大CTV这2种靶区勾画方法对患者预后及治疗毒性反应的影响。
1 材料与方法 1.1 研究对象回顾性分析中日友好医院放射肿瘤科2016年10月至2021年10月收治的经病理学确诊的89例不能手术的LD-SCLC病例资料。根据AJCC第8版,符合Ⅰ~Ⅲ期,无多发肺结节和广泛的T3~T4,采用根治剂量进行治疗。收集并分析治疗前分期检查资料,包括胸部增强计算机断层扫描(computed tomography,CT)、头颅磁共振成像(magnetic resonance imaging,MRI)、颈部及双侧锁骨上B超、腹部B超、全身骨扫描或氟脱氧葡萄糖正电子发射断层摄影术(flurodeoxyglucose positron emission tomography,FDG-PET) 检查。所有患者均无严重的内科疾病,骨髓、肝、肾功能基本正常;美国东部肿瘤协作组(eastern cooperative oncology group,ECOG) 评分为0~1。本研究获得中日友好医院医学伦理委员会审核批准。
1.2 治疗方案所有纳入患者均采用同步放化疗方案,加或不加诱导或巩固化疗。诱导或巩固化疗方案及同步放化疗中,化疗方案为依托泊苷+铂类方案,共4~6个周期。
放疗采用Varian直线加速器,6~10 MV X线,调强放疗(intensity-modulated radiation therapy,IMRT) 方式,在化疗的第1或第2周期开始日同步执行。大体靶区(gross tumor volume,GTV)、CTV、计划靶区(planning tumor volume,PTV) 根据国际辐射单位和测量委员会(International Commission on Radiation Units and Measurements,ICRUM) 第50和62号报告[9-10]标准定义,采用累及野照射(involved field radiation therapy,IFRT) 方式,剂量分割模式采用加速超分割[45 Gy (1.5 Gy/次,共30次,2次/d)]或常规分割[60~66 Gy (2 Gy/次,共30~33次,1次/d)]。处方剂量95%等剂量曲线包括整个PTV。正常组织限值:接受20 Gy照射的正常肺体积(V20,包括除肿瘤外的肺组织) < 30%,脊髓受照的最大剂量点 < 45 Gy,接受50 Gy照射的心脏体积(V50) < 40%。
按靶区勾画方法,患者接受了如下2组治疗方案:(1) A组(扩CTV组),GTV为GTVprimary (CT或PET-CT扫描下肺内原发病灶) +转移淋巴结大体靶区(lymph nodes gross tumor volume,GTVnd),GTVnd包括纵隔镜检查阳性、CT短径≥1 cm或虽短径 < 1 cm但融合成簇、短径 < 1 cm而PET显像阳性的淋巴结。CTV为CTVprimary (原发灶GTV外放0.5~0.8 mm) +CTVnd (受累淋巴引流区,骨皮质、大气道、血管外膜、纵隔胸膜等天然解剖屏障手工修剪)。内靶区(internal tumor volume,ITV)为CTVprimary和CTVnd根据呼吸动度外放3~10 mm。PTV根据摆位误差及系统误差由ITV外放0.5 mm获得。放疗40~45 Gy后行CT-sim扫描,根据肿瘤退缩情况考虑是否缩野治疗,GTV、CTV、ITV、PTV勾画同上。(2) B组(不扩CTV组),GTV为GTVprimary+GTVnd;CTV为省略CTVprimary,CTVnd勾画方式同A组;ITV为GTVprimary和CTVnd根据呼吸动度外放3~10 mm;PTV根据摆位误差及系统误差由ITV外放0.5 mm,放疗40~45 Gy后行CT-sim扫描,根据肿瘤退缩情况考虑是否缩野治疗,GTV、CTVnd、ITV、PTV勾画同上。
1.3 免疫组化增殖细胞核相关抗原-67 (nuclear-associated antigen,Ki-67) 指数评分Ki-67指数是指细胞核着色肿瘤细胞数占总肿瘤细胞数的百分比,通过数字切片扫描与应用系统(Motic Scan,中国麦克奥迪公司) 随机选取5个高倍镜视野,计算阳性细胞所占平均百分比,定量分析染色结果。
1.4 毒性反应和疗效评价治疗相关性毒性反应定义为放疗开始90 d内3度或3度以上非血液学毒性。根据化疗药物毒性反应分级标准(National Cancer Institute Common Terminology Criteria for Adverse Events,NCI-CTCAE) 判定放化疗的毒性反应。放疗结束后1~3个月复查胸部增强CT并和放疗定位CT对比,判断患者的近期疗效,近期疗效评价根据实体瘤临床疗效评价标准(response evaluation criteria in solid tumors,RECIST) 1.1[11]。治疗后2年内1次/2~3个月,2年后1次/6个月进行随访,监测患者的一线治疗失败模式、无进展生存时间(progression-free survival,PFS) 和总生存时间(overall survival,OS)。PFS从患者病理确诊时间开始计算至肿瘤进展时间,包括局部区域进展和远处转移;OS从患者病理确诊时间开始计算至死亡或者随访结束时间。截止随访时间为2022年3月1日。
1.5 统计学分析采用SPSS 23.0软件进行统计分析。应用χ2检验进行定性资料的检验;生存分析采用Kaplan-Meier曲线、log-rank检验。P < 0.05为差异有统计学意义。
2 结果 2.1 临床病理资料比较本研究共纳入LD-SCLC患者89例,其中,接受GTVprimary外扩的治疗方案(A组) 45例,接受GTVprimary不外扩的治疗方案(B组) 44例;男74例,女15例;年龄31~77岁,中位年龄60岁;ⅡB期7例,ⅢA期21例,ⅢB期34例,ⅢC期27例;中央型61例,周围型28例;Ki-67指数均值为79%,其中 > 79%者59例,≤79%者30例;ECOG 0级47例,ECOG 1级42例。2组患者临床病理特征比较无统计学差异。见表 1。
| Item | group A (n = 45) | group B (n = 44) | P |
| Age (year) | 0.909 | ||
| Mean | 60 | 58 | |
| Range | 40-77 | 31-74 | |
| ≤60 [n (%)] | 21(46.7) | 20(45.5) | |
| > 60 [n (%)] | 24(53.3) | 24(54.5) | |
| Sex [n (%)] | 0.962 | ||
| Male | 38(84.4) | 36(81.8) | |
| Female | 7(15.6) | 8(18.2) | |
| ECOG status [n (%)] | 0.600 | ||
| 0 | 25(55.6) | 22(50.0) | |
| 1 | 20(44.4) | 22(50.0) | |
| Ki-67 index [n (%)] | 0.602 | ||
| ≤mean (79%) | 14(31.1) | 16(36.4) | |
| > mean (79%) | 31(68.9) | 28(63.6) | |
| Stage [n (%)] | 0.628 | ||
| ⅡB | 3(6.7) | 4(9.1) | |
| ⅢA | 12(26.7) | 9(20.5) | |
| ⅢB | 16(35.6) | 18(40.9) | |
| ⅢC | 14(31.1) | 13(29.5) | |
| Tumor site [n (%)] | 0.943 | ||
| Proximal | 31(68.9) | 30(68.2) | |
| Peripheral | 14(31.1) | 14(31.8) | |
| Group A,CTV expanded;group B,CTV non-expanded. | |||
2.2 近期疗效比较
89例患者中,有3例患者由于身体不能耐受(A组2例,B组1例) 未能完成同步放化疗,对其余86例患者进行疗效分析,按RECIST 1.0评价患者近期疗效,将完全缓解(complete response,CR) 和部分缓解(partial response,PR) 定义为有效,疾病稳定(stable disease,SD) 和疾病进展(progressive disease,PD) 定义为无效。86例患者总有效率为77.9%,A组和B组有效率分别为79.1%和76.7% (P = 0.950)。
2.3 远期疗效比较 2.3.1 治疗失败模式分析比较对可供疗效分析的86例患者随访至2022年3月1日,中位随访时间21.3个月(3.2~60.8个月)。2组患者治疗总失败率为79.1%,其中局部进展24例(27.9%),远处转移36例(41.9%),同时发现局部进展和远处转移8例(9.3%)。A组和B组失败率分别为76.7%和81.4% (P = 0.596),其中,局部进展分别为11例(25.6%) 和13例(30.2%,P = 0.631),远处转移17例(39.5%) 和19例(44.2%,P = 0.711),同时发现局部进展和远处转移5例(11.6%) 和3例(7.0%) (P = 0.458)。A组和B组存在局部进展各16例,A、B组区域淋巴结进展分别为4例、2例,原发灶和区域淋巴结同时进展分别为2例、1例,单纯原发灶进展分别为10例、13例,一线治疗失败率和失败模式2组间无统计学差异。见表 2。
| Item | group A (n = 43) | group B (n = 43) | P |
| First-line treatment failure | 33(76.7) | 35(81.4) | 0.596 |
| Local progression | 11(25.6) | 13(30.2) | 0.631 |
| Distant metastasis | 17(39.5) | 19(44.2) | 0.711 |
| Local progression & distant metastasis | 5(11.6) | 3(7.0) | 0.458 |
| Local progression | 18(41.9) | 17(39.5) | 0.826 |
| Regional lymph node progression | 6(14.0) | 3(7.0) | 0.291 |
| Primary tumor progression | 12(27.9) | 14(32.6) | 0.639 |
2.3.2 生存分析比较
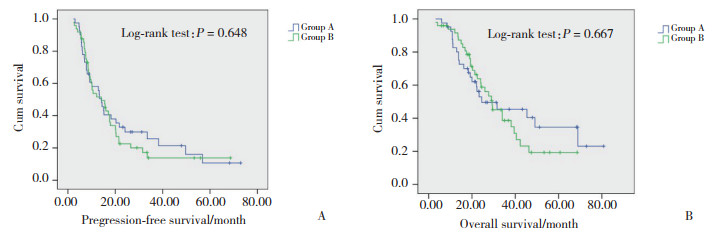
86例患者中位PFS 12.6个月(2.2~51.9个月),A组和B组患者中位PFS分别为13.2个月和12.1个月(P = 0.648)。患者1年、2年和3年生存率分别为81%、52%和32%,中位OS为20.9个月(3.2~60.8个月),A组和B组患者中位OS分别为21.5个月和20.3个月(P = 0.667)。见图 1。
|
| A, PFS; B, OS. 图 1 2组患者生存分析比较 Fig.1 Survival analysis of the two groups |
2.4 毒性反应比较
本组86例患者发生的3度及以上非血液学毒性反应主要为放射性肺炎及放射性食道炎。其中,共发生放射性肺炎9例,A组[7 (16.3%)]略高于B组[2 (4.7%)],但差异无统计学意义(P = 0.078);共发生放射性食道炎17例,A组[10 (23.3%)]略高于B组[7 (16.3%)],但差异无统计学意义(P = 0.417)。
3 讨论根据IRCU62定义,LD-SCLC放疗靶区主要包含4个部分:GTV、CTV、ITV和PTV。GTV包含GTVprimary和GTVnd,GTVprimary为原发病灶,GTVnd为转移性淋巴结;CTV包含CTVprimary和CTVnd,CTVprimary为原发灶周围的亚临床病灶,CTVnd为预防性照射的区域性淋巴引流区;ITV包括器官生理运动造成的靶区移动、疗程中器官形态变化造成的靶区移动、疗程中肿瘤退缩造成的靶区形变;PTV主要包括设备和器具造成的系统误差和摆位误差。由于大体肿瘤周围肿瘤细胞微浸润病灶的存在,参考影像学(CT、MRI、FDG-PET等) 图像勾画的GTV并不能完全包括原发灶周围的亚临床病灶,因此需要在GTV周围外扩一定范围至CTV,以达到对原发灶肿瘤的充分照射,这在目前的精确放疗时代尤为重要。在NSCLC的影像和病理对照研究中发现,不同病理类型的微浸润范围不同,GIRAUD等[12]研究发现肺腺癌平均浸润范围为2.76 mm,肺鳞状细胞癌(简称鳞癌) 为2.37 mm;如果包括95%的镜下外侵范围,GTV外扩至CTV,腺癌需要外扩8 mm,鳞癌需要外扩6 mm。GRILLS等[13]研究发现,不同核分级的肺腺癌标本镜下微浸润的范围也是不同的,核分级1~3的微浸润范围分别为9、5、4 mm,如果包括90%的镜下外侵范围,GTV外扩至CTV需要9 mm。根据以上研究结果,目前在临床应用中将肺腺癌和肺鳞癌原发灶GTV至CTV分别外扩7~9 mm和5~6 mm,但是在LD-SCLC放疗靶区原发灶CTV的制定方面,各治疗中心差异很大,常规放疗为主的RTOG9712研究[14]将GTVprimary外扩1~1.5 cm至CTV,以三维适型放疗或调强放疗为主的CONVERT研究[15]将GTVprimary外扩0.5 cm至CTV;GAO等[16]研究发现,SCLC镜下肿瘤细胞微浸润范围平均为2.81 mm,如充分覆盖90%病例的肿瘤细胞微浸润范围,定位CT指导下SCLC勾画的GTVprimary需外扩6.4 mm;充分覆盖95%病例的肿瘤细胞微浸润范围,GTVprimary需外扩8 mm。本研究通过对86例同步放化疗局部晚期NSCLC的研究发现,在临床病理资料基本平衡的前提下,GTVprimary扩大与不扩大CTV患者的近期有效率分别为79.1%和76.7% (P = 0.950);局部区域进展率均为37.2%;中位无进展生存时间分别为13.2和12.1个月(P = 0.648);中位总生存时间分别为21.5和20.3个月(P = 0.667),包括局部区域进展模式在内2组比较均无统计学差异,但是3度以上放射性肺炎扩CTV组有增高的趋势(16.3% vs 4.7%,P = 0.078)。
同步放化疗时靶区不扩大CTV并不影响近期及远期疗效考虑有2个原因:(1) 从GTV外扩到ITV再外扩到PTV,共外扩0.8~1.5 cm,治疗过程中会有部分亚临床病灶包含在治疗野内,而且计划靶区PTV外仍有剂量,所以整个放疗过程中,肿瘤靶区周围的亚临床病灶可以受到一定剂量的照射;(2) 同步放化疗过程中,由于SCLC属于化疗敏感的肿瘤类型,化疗可以对肿瘤周围的亚临床病灶有一定的杀伤作用。但由于本研究为回顾性分析,且纳入病例数较少,随访时间较短,未充分包括影响SCLC同步放化疗疗效的分子生物学标志物,因此,所得结论仍需更大规模的前瞻性随机对照试验予以验证。
综上所述,同步放化疗为LD-SCLC标准的治疗方案,本研究结果初步表明放疗过程中原发灶GTV是否外扩CTV并不影响患者的近期和远期疗效,且原发灶不扩大CTV模式能降低放化疗过程中发生3度及以上放射性肺损伤的概率。
| [1] |
DELA CRUZ CS, TANOUE LT, MATTHAY RA. Lung cancer: epidemiology, etiology, and prevention[J]. Clin Chest Med, 2011, 32(4): 605-644. DOI:10.1016/j.ccm.2011.09.001 |
| [2] |
PIGNON JP, ARRIAGADA R, IHDE DC, et al. A meta-analysis of thoracic radiotherapy for small-cell lung cancer[J]. N Engl J Med, 1992, 327(23): 1618-1624. DOI:10.1056/NEJM199212033272302 |
| [3] |
SLOTMAN BJ, VAN TINTEREN H, PRAAG JO, et al. Use of thoracic radiotherapy for extensive stage small-cell lung cancer: a phase 3 randomised controlled trial[J]. Lancet, 2015, 385(9962): 36-42. DOI:10.1016/S0140-6736(14)61085-0 |
| [4] |
ZELEN M. Keynote address on biostatistics and data retrieval[J]. Cancer Chemother Rep 3, 1973, 4(2): 31-42. |
| [5] |
SHEPHERD FA, CROWLEY J, VAN HOUTTE P, et al. The International Association for the Study of Lung Cancer lung cancer staging project: proposals regarding the clinical staging of small cell lung cancer in the forthcoming (seventh) edition of the tumor, node, metastasis classification for lung cancer[J]. J Thorac Oncol, 2007, 2(12): 1067-1077. DOI:10.1097/JTO.0b013e31815bdc0d |
| [6] |
GANTI AKP, LOO BW, BASSETTI M, et al. Small cell lung cancer, version 2.2022, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2021, 19(12): 1441-1464. DOI:10.6004/jnccn.2021.0058 |
| [7] |
FRÜH M, DE RUYSSCHER D, POPAT S, et al. Small-cell lung cancer (SCLC): esmo Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2013, 24(Suppl 6): vi99-vi105. DOI:10.1093/annonc/mdt178 |
| [8] |
AUPÉRIN A, ARRIAGADA R, PIGNON JP, et al. Prophylactic cranial irradiation for patients with small-cell lung cancer in complete remission. Prophylactic Cranial Irradiation Overview Collaborative Group[J]. N Engl J Med, 1999, 341(7): 476-484. DOI:10.1056/NEJM199908123410703 |
| [9] |
LANDBERG T, CHAVAUDRA J, DOBBS J, et al. ICRU report 50:prescribing, recording and reporting photon beam therapy[J]. J ICRU, 1993, os26(1). DOI:10.1093/jicru/os26.1.Report50 |
| [10] |
LANDBERG T, CHAVAUDRA J, DOBBS J, et al. ICRU report 62:prescribing, recording and reporting photon beam therapy (supplement to ICRU report 50)[J]. J ICRU, 1999, os32(1). DOI:10.1093/jicru/os32.1.Report62 |
| [11] |
THERASSE P, ARBUCK SG, EISENHAUER EA, et al. New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada[J]. J Natl Cancer Inst, 2000, 92(3): 205-216. DOI:10.1093/jnci/92.3.205 |
| [12] |
GIRAUD P, ANTOINE M, LARROUY A, et al. Evaluation of microscopic tumor extension in non-small-cell lung cancer for three-dimensional conformal radiotherapy planning[J]. Int J Radiat Oncol Biol Phys, 2000, 48(4): 1015-1024. DOI:10.1016/s0360-3016(00)00750-1 |
| [13] |
GRILLS IS, FITCH DL, GOLDSTEIN NS, et al. Clinicopathologic analysis of microscopic extension in lung adenocarcinoma: defining clinical target volume for radiotherapy[J]. Int J Radiat Oncol, 2007, 69(2): 334-341. DOI:10.1016/j.ijrobp.2007.03.023 |
| [14] |
KOMAKI R, SWANN RS, ETTINGER DS, et al. PhaseⅠstudy of thoracic radiation dose escalation with concurrent chemotherapy for patients with limited small-cell lung cancer: report of Radiation Therapy Oncology Group (RTOG) protocol 97-12[J]. Int J Radiat Oncol Biol Phys, 2005, 62(2): 342-350. DOI:10.1016/j.ijrobp.2004.11.030 |
| [15] |
FAIVRE-FINN C, SNEE M, ASHCROFT L, et al. Concurrent once-daily versus twice-daily chemoradiotherapy in patients with limited-stage small-cell lung cancer (CONVERT): an open-label, phase 3, randomised, superiority trial[J]. Lancet Oncol, 2017, 18(8): 1116-1125. DOI:10.1016/S1470-2045(17)30318-2 |
| [16] |
GAO LW, WANG XH, YANG XT, et al. A clinicopathologic analysis of microscopic extension in small cell lung cancer and lung adenocarcinoma: determination of clinical target volume with precise radiotherapy[J]. Thorac Cancer, 2021, 12(13): 1973-1982. DOI:10.1111/1759-7714.14000 |
 2022, Vol. 51
2022, Vol. 51