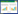文章信息
- 李日涵, 韩思源, 金锋
- LI Rihan, HAN Siyuan, JIN Feng
- 新辅助化疗对假体或扩张器植入即刻乳房重建术患者预后的影响
- Effect of neoadjuvant chemotherapy on the prognosis of patients with implant- or expender-based immediate breast reconstruction
- 中国医科大学学报, 2022, 51(4): 370-374
- Journal of China Medical University, 2022, 51(4): 370-374
-
文章历史
- 收稿日期:2021-07-11
- 网络出版时间:2022-04-29 10:34
随着乳腺疾病筛查工作的普及,越来越多的乳腺癌患者在疾病早期得到治疗,但依然有很多患者首次诊断乳腺癌时就已经处于晚期。在过去的十多年里,新辅助化疗(neoadjuvant chemotherapy,NACT)已经广泛应用于晚期乳腺癌患者,使不能手术的乳腺癌患者降期到可以手术,使不能保乳治疗患者能够选择保乳手术,同时提高了化疗药物使用的准确性,从而提高了患者的预后[1]。近年来,即刻乳房重建术越来越多地应用到乳腺癌乳房切除后的患者中,假体或扩张器植入即刻乳房重建术因其术后效果理想、损伤小等优点应用最广泛[2]。化疗药物因其影响细胞代谢周期等机制对人体的组织细胞功能及增殖产生抑制作用,在一些动物实验中,化疗药物影响切口的愈合,但在临床实践中目前尚未确定[3]。乳房重建患者因手术较单纯乳房切除损伤更大,体内存在异物而更容易出现术后并发症,术前采用新辅助化疗是否影响假体或扩张器植入即刻乳房重建术术后患者的预后鲜有报道。本研究与直接行假体或扩张器植入即刻乳房重建术患者比较,探讨新辅助化疗后再行手术患者的并发症及预后情况,旨在明确新辅助化疗患者行假体或扩张器植入即刻乳房重建手术的安全性,以便为患者提供更优的治疗方案提供参考。
1 材料与方法 1.1 临床资料及分组收集2017年7月至2019年6月中国医科大学附属第一医院乳腺外科接受乳腺癌根治性切除手术并行假体或扩张器植入即刻乳房重建手术患者的临床资料。纳入标准:(1)年龄18~60岁;(2)诊断为单侧乳腺癌;(3)乳腺术后行假体或扩张器植入即刻乳房重建手术;(4)未联合自体组织重建;(5)术后定期随访。排除标准:(1)患有糖尿病、高血压、肝肾功能异常等基础疾病;(2)同时行对侧乳房预防性切除假体植入手术;(3)失访。共纳入患者126例,其中,术前接受了新辅助化疗的47例患者[4~8次化疗,平均(4.77±1.70)次]为观察组,直接手术的79例患者为对照组。2组年龄、体质量指数(body mass index,BMI)、病理分期、分子分型以及手术术式比较差异无统计学意义(均P > 0.05)。见表 1。
| 项目 | 观察组(n = 47) | 对照组(n = 79) | t/χ2 | P |
| 年龄(岁) | 39.277±8.428 | 39.050±8.792 | 0.142 | 0.888 |
| BMI(kg/m2) | 24.385±2.113 | 23.870±2.336 | 1.240 | 0.217 |
| TNM分期 | 2.915 | 0.233 | ||
| Ⅰ期 | 7 | 18 | ||
| Ⅱ期 | 29 | 52 | ||
| Ⅲ期 | 10 | 9 | ||
| 分子分型 | 0.957 | 0.812 | ||
| Luminal A型 | 13 | 18 | ||
| Luminal B型 | 19 | 32 | ||
| HER-2阳性 | 7 | 12 | ||
| 三阴型 | 7 | 17 | ||
| 术式 | 2.801 | 0.247 | ||
| 扩张器 | 27 | 39 | ||
| NSM+扩张器 | 13 | 18 | ||
| NSM+假体 | 7 | 22 | ||
| HER-2,人表皮生长因子受体2;NSM,保留乳头的乳房切除术. | ||||
1.2 治疗 1.2.1 新辅助化疗
依据患者乳腺癌粗针穿刺活检病理结果及患者身体条件,选择新辅助化疗方案,包括表柔比星+环磷酰胺、表柔比星+多西他赛、表柔比星+多西他赛+环磷酰胺、表柔比星+环磷酰胺序贯多西他赛,对于人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)高表达患者采用多西他赛+卡铂联合曲妥珠单抗或表柔比星+环磷酰胺序贯多西他赛联合曲妥珠单抗的方案。3周为1个周期,每2个周期利用乳腺彩色多普勒超声及乳腺磁共振检查进行1次评价,并决定手术时机。
1.2.2 手术手术各环节均由同一乳房重建治疗组医生参与完成,对于肿瘤边缘距离乳头乳晕复合体2 cm以上且未浸及肿瘤投影区皮肤的患者,可于术中进行乳头乳晕复合体安全缘快速冰冻病理确认,尝试保留乳头乳晕复合体。这些患者若初始肿瘤为T2及以下,经穿刺活检或前哨淋巴结活检确认无腋窝淋巴结转移病灶,可于乳癌根治性切除后进行假体植入即刻乳房重建术。对于术后需要放疗、肿瘤体表投影区皮肤切除过多、乳头乳晕无法保留的患者选择于乳癌根治性切除后行扩张器植入的两步法即刻乳房重建术。
1.2.3 术后抗肿瘤治疗未完成足够周期新辅助化疗的观察组患者及直接进行手术的对照组患者,在无严重并发症的情况下,于手术切口基本愈合、不存在皮瓣坏死和切口裂开风险、拔除引流管后尽早(不晚于手术后8周)按计划方案进行化疗。对于已完成全部周期化疗但需要继续靶向治疗的新辅助化疗患者,也基于上述标准尽早开始后续治疗。需要术后辅助放疗的患者需在手术切口愈合、无创面的情况下再进行。内分泌治疗均根据病情于术后规范进行。
1.3 观察指标及预后评价统计患者术后总引流量、术后住院时间以及手术距后续治疗的间隔时间。统计2组患者并发症的发生情况,包括严重并发症(血肿形成、术区感染、乳头乳晕或皮瓣坏死及假体丢失)和普通并发症(脂肪液化、切口裂开、表皮松解等)。术后2年内以3个月为周期,2年后以6个月为周期进行随访,随访内容包括体格检查、影像学检查、重建乳房外观及触感的评估。记录患者出现局部复发、远处转移、假体包膜挛缩等不良事件,随访截止日期为2021年5月。
1.4 统计学分析采用SPSS 22.0软件进行统计学分析,计量资料以x±s表示,组间比较采用t检验;计数资料采用率(%)表示,组间比较采用χ2检验。利用Kaplan-Meier曲线及log-rank检验分析2组无病生存(disease-free survival,DFS)时间。P < 0.05为差异有统计学意义。
2 结果 2.1 2组术后指标比较结果显示,2组累计引流量、术后住院时间、并发症总发生率比较差异无统计学意义(P > 0.05),而手术与后续治疗间隔时间观察组较对照组延长,差异有统计学意义(P < 0.05)。观察组1例患者因发生乳头乳晕皮瓣坏死继发感染,最终行假体取出造成了假体丢失。对照组2例因出现了部分皮瓣坏死最终假体丢失。2组仅有切口皮肤表皮松解发生率差异具有统计学意义(P < 0.05),而其他并发症(皮瓣坏死、血肿形成、术后感染等)发生率比较差异均无统计学意义(均P > 0.05),见表 2。
| 项目 | 观察组(n = 47) | 对照组(n = 79) | t/χ2 | P |
| 累计引流量(mL) | 1 400.468±378.979 | 1 378.646±360.484 | 0.318 | 0.751 |
| 术后住院时间(d) | 13.064±2.689 | 12.974±2.769 | 0.177 | 0.860 |
| 手术与后续治疗间隔时间(d) | 32.957±9.910 | 25.177±5.733 | 4.915 | < 0.001 |
| 手术后并发症[n(%)] | 15(31.91) | 25(30.38) | 0.001 | 0.975 |
| 假体丢失 | 1(2.13) | 2(2.53) | 0.210 | 0.886 |
| 皮瓣坏死 | 3(6.38) | 4(5.03) | 0.098 | 0.754 |
| 血肿形成 | 5(10.64) | 11(13.92) | 0.287 | 0.592 |
| 术后感染 | 2(4.26) | 3(3.80) | 0.016 | 0.889 |
| 脂肪液化 | 14(29.79) | 19(24.05) | 0.502 | 0.479 |
| 切口裂开 | 7(14.89) | 11(13.92) | 0.230 | 0.880 |
| 表皮松解 | 22(46.81) | 21(26.58) | 5.363 | 0.021 |
2.2 2组预后比较
2组患者随访时间,局部复发、远处转移及假体包膜挛缩发生率比较差异无统计学意义(均P > 0.05),2组各出现1例Ⅱ级轻度变硬的包膜挛缩。评估结果显示,DFS时间观察组为41.1个月(95% CI:38.2~44.0),对照组为40.8个月(95% CI:39.1~42.6),2组比较差异无统计学意义(χ2 =0.422,P = 0.516),见表 3、图 1。
| 项目 | 观察组(n = 47) | 对照组(n = 79) | t/χ2 | P |
| 随访时间(月) | 33.851±7.381 | 32.342±6.793 | 1.168 | 0.245 |
| 局部复发[n(%)] | 2(4.25) | 2(2.53) | 0.285 | 0.594 |
| 远处转移[n(%)] | 7(14.89) | 9(11.39) | 0.326 | 0.568 |
| 包膜挛缩[n(%)] | 1(2.13) | 1(1.27) | 0.140 | 0.708 |

|
| 图 1 2组无病生存时间Kaplan-Meier曲线 |
3 讨论
临床实践中,对于肿瘤直径3 cm以上或存在较大腋窝淋巴结转移癌结节的患者,尤其是三阴型乳腺癌及HER-2阳性型乳腺癌患者常考虑采用新辅助化疗方案。但化疗药物多针对不同的细胞周期影响细胞增殖,患者常出现粒细胞缺乏、贫血、血小板减少、肝肾功能异常以及心脏受损等。刘伟色等[4]的研究显示,新开始的术后化疗增加了即刻乳房重建患者二次手术的风险;有研究[5]探讨了结肠癌术前化疗对手术的影响,结果显示再次手术及感染的并发症发生率较高。因此,新辅助化疗是否会增加肿瘤患者手术后并发症的发生风险一直存在争议[6]。
假体即刻乳房重建已广泛应用于乳腺癌患者,其在心理及生活质量方面均对患者有益[1, 7-8],且对肿瘤治疗没有影响[9]。保留皮肤和保留乳头乳晕的乳房切除术已经证明具有良好的肿瘤安全性,同时也为即刻乳房重建提供了良好的皮瓣覆盖基础[10]。越来越多有乳房重建需求的患者通过新辅助化疗缩小肿瘤体积后达到施行乳癌切除手术同时进行假体即刻乳房重建或扩张器植入/假体两步法即刻乳房重建的目的。新辅助化疗是否会增加即刻乳房重建术后并发症的发生率,以及是否会影响肿瘤患者的预后是近年来备受关注的话题。本研究结果显示,2组并发症中皮瓣坏死、血肿形成、术后感染、假体丢失发生率差异没有统计学意义(均P > 0.05),仅切口皮肤表皮松解发生率观察组更高,差异有统计学意义(P < 0.05)。观察组手术距后续治疗的间隔时间较对照组明显延长(P < 0.05)。VARGHESE等[3]对近年来该领域的研究进行了meta分析,表明新辅助化疗后即刻乳房重建患者与直接进行即刻乳房重建患者比较,术后并发症发生差异无统计学意义,指出血/血清肿以及切口愈合并发症的发生不会直接引起乳房重建失败,但会耽搁后续辅助治疗的开展,与本研究结果基本一致。
在延迟后续治疗对肿瘤预后造成影响的研究方面,SILVA等[11]研究显示新辅助化疗结束后的患者8周内开始辅助放疗可以提高乳腺癌患者术后的DFS时间和总生存时间。研究[12-13]发现30、60、90 d以内开始辅助化疗的患者总生存时间不存在统计学差异。因此,即使新辅助化疗患者因术后恢复问题推迟了后续的辅助治疗,只要把握好辅助治疗开始的时间就不会对患者治疗产生影响。
本研究结果显示,2组患者DFS时间比较无统计学差异(均P > 0.05),但有研究[14]显示2组患者在总生存时间和DFS时间上均有显著差异,WU等[15]研究显示2组患者在总生存时间、DFS时间、无局部复发生存率及无远处转移生存均无显著差异,可见尚无明确结论,需进一步研究论证。
综上所述,新辅助化疗未增加假体或扩张器植入即刻乳房重建患者术后并发症发生的风险,虽然后续治疗的开始时间延长,但未影响患者预后。受限于疾病对新辅助化疗反应的难以预计以及患者决策在治疗中的不断变化,目前仍难以开展相关的前瞻性研究。本研究为回顾性研究,纳入的样本量较少,且随访观察时间不长,希望后续进行更长时间的随访以及更大量的样本纳入,进而获得确切结论。
| [1] |
邵志敏, 江泽飞, 李俊杰, 等. 中国乳腺癌新辅助治疗专家共识(2019年版)[J]. 中国癌症杂志, 2019, 29(5): 390-400. DOI:10.19401/j.cnki.1007-3639.2019.05.009 |
| [2] |
郭瑢, 修秉虬, 苏永辉, 等. 中国乳腺癌术后植入物乳房重建现况调查[J]. 中华外科杂志, 2019, 57(8): 616-621. DOI:10.3760/cma.j.issn.0529-5815.2019.08.010 |
| [3] |
VARGHESE J, GOHARI SS, RIZKI H, et al. A systematic review and meta-analysis on the effect of neoadjuvant chemotherapy on complications following immediate breast reconstruction[J]. Breast, 2021, 55: 55-62. DOI:10.1016/j.breast.2020.11.023 |
| [4] |
刘伟色, 穆兰, 汤小川, 等. 即刻乳房重建对乳腺癌术后辅助化疗开始时间及并发症的影响[J]. 中华肿瘤杂志, 2017, 39(1): 44-47. DOI:10.3760/cma.j.issn.0253-3766.2017.01.009 |
| [5] |
ARHI CS, BURNS EM, BOURAS G, et al. Complications after discharge and delays in adjuvant chemotherapy following colonic resection: a cohort study of linked primary and secondary care data[J]. Colorectal Dis, 2019, 21(3): 307-314. DOI:10.1111/codi.14525 |
| [6] |
BOWEN ME, MONE MC, BUYS SS, et al. Surgical outcomes for mastectomy patients receiving neoadjuvant chemotherapy: a propensity-matched analysis[J]. Ann Surg, 2017, 265(3): 448-456. DOI:10.1097/SLA.0000000000001804 |
| [7] |
BAILEY CR, OGBUAGU O, BALTODANO PA, et al. Quality-of-life outcomes improve with nipple-sparing mastectomy and breast reconstruction[J]. Plast Reconstr Surg, 2017, 140(2): 219-226. DOI:10.1097/PRS.0000000000003505 |
| [8] |
NELSON JA, ALLEN RJ Jr, POLANCO T, et al. Long-term patient-reported outcomes following postmastectomy breast reconstruction: an 8-year examination of 3268 patients[J]. Ann Surg, 2019, 270(3): 473-483. DOI:10.1097/SLA.0000000000003467 |
| [9] |
ZHANG P, LI CZ, WU CT, et al. Comparison of immediate breast reconstruction after mastectomy and mastectomy alone for breast cancer: a meta-analysis[J]. Eur J Surg Oncol EJSO, 2017, 43(2): 285-293. DOI:10.1016/j.ejso.2016.07.006 |
| [10] |
GALIMBERTI V, VICINI E, CORSO G, et al. Nipple-sparing and skin-sparing mastectomy: review of aims, oncological safety and contraindications[J]. Breast, 2017, 34(Suppl 1): S82-S84. DOI:10.1016/j.breast.2017.06.034 |
| [11] |
SILVA SB, PEREIRA AAL, MARTA GN, et al. Clinical impact of adjuvant radiation therapy delay after neoadjuvant chemotherapy in locally advanced breast cancer[J]. Breast, 2018, 38: 39-44. DOI:10.1016/j.breast.2017.11.012 |
| [12] |
CHAVEZ-MACGREGOR M, CLARKE CA, LICHTENSZTAJN DY, et al. Delayed initiation of adjuvant chemotherapy among patients with breast cancer[J]. JAMA Oncol, 2016, 2(3): 322-329. DOI:10.1001/jamaoncol.2015.3856 |
| [13] |
RIBA LA, GRUNER RA, FLEISHMAN A, et al. Surgical risk factors for the delayed initiation of adjuvant chemotherapy in breast cancer[J]. Ann Surg Oncol, 2018, 25(7): 1904-1911. DOI:10.1245/s10434-018-6351-7 |
| [14] |
ALLUÉ CABAÑUZ M, ARRIBAS DEL AMO MD, GIL ROMEA I, et al. Direct-to-implant breast reconstruction after neoadjuvant chemotherapy: a safe option?[J]. Cir Esp (Engl Ed), 2019, 97(10): 575-581. DOI:10.1016/j.ciresp.2019.07.003 |
| [15] |
WU ZY, KIM HJ, LEE JW, et al. Long-term oncologic outcomes of immediate breast reconstruction vs conventional mastectomy alone for breast cancer in the setting of neoadjuvant chemotherapy[J]. JAMA Surg, 2020, 155(12): 1142-1150. DOI:10.1001/jamasurg.2020.4132 |
 2022, Vol. 51
2022, Vol. 51