文章信息
- 王博文, 袁亦彤, 吴琪俊, 苏雪松, 杨旭, 周华, 王艳秋
- WANG Bowen, YUAN Yitong, WU Qijun, SU Xuesong, YANG Xu, ZHOU Hua, WANG Yanqiu
- 肾小球疾病患者随机尿免疫球蛋白G/尿肌酐比值与24 h尿免疫球蛋白G的相关性
- Correlation analysis between the ratio of random urinary immunoglobulin G to urinary creatinine and 24 h urinary immunoglobulin G in patients with glomerular disease
- 中国医科大学学报, 2022, 51(4): 319-323
- Journal of China Medical University, 2022, 51(4): 319-323
-
文章历史
- 收稿日期:2021-10-11
- 网络出版时间:2022-04-29 11:23
2. 中国医科大学附属盛京医院肾内科, 沈阳 110004;
3. 中国医科大学附属盛京医院临床流行病学教研室, 沈阳 110004
2. Department of Nephrology, Shengjing Hospital of China Medical University, Shenyang 110004, China;
3. Department of Clinical Epidemiology, Shengjing Hospital of China Medical University, Shenyang 110004, China
肾小球疾病是以血尿、蛋白尿、水肿、高血压和不同程度肾功能损害为临床表现的肾脏疾病,是我国慢性肾衰竭的主要病因之一。尿蛋白作为独立因素与肾小球疾病的发生发展及预后密切相关[1]。目前,临床上应用24 h尿蛋白定量来反映肾小球疾病的蛋白尿严重程度。近期研究[2]发现,糖尿病肾病患者尿免疫球蛋白G(immunoglobulin G,IgG)先于尿微量白蛋白产生,因此IgG可敏感反映早期肾功能损害,从而有助于临床上早期干预治疗。
IgG是人体内主要的免疫球蛋白,分子量为150×103,属于大分子物质,约75%由浆细胞合成和分泌,是体内循环中最常见抗体,但在正常尿液中含量极微[3]。当肾小球基底膜功能受损时,基底膜通透性增加,尿大分子蛋白排出增多,形成非选择性肾小球蛋白尿。已有研究[4]提出并证实肾小球疾病患者尿IgG对治疗效果及预后判定具有一定的敏感度和特异度。改善全球肾脏病预后组织(kidney disease improving global outcomes,KDIGO)制定的指南[5]指出,24 h尿IgG水平可以对特发性膜性肾病(idiopathic membranous nephropathy,IMN)进行病情评估,通过参与风险分级来干预治疗决策的制定。尿IgG还可以预测原发性局灶节段性肾小球硬化症患者的预后,预测激素及环磷酰胺的治疗效果,为高危患者的一线替代治疗提供思路,增加干预治疗的有效性[6]。
研究[7]表明,尿白蛋白肌酐比值(albumin-creatinine ratio,ACR)可排除食物及代谢等因素的影响程度,反映尿液中蛋白排泄情况,且与24 h尿蛋白(urine protein,UPRO)呈显著相关,因此随机尿液ACR代替了耗时较长、步骤繁琐的24 h UPRO检测。但有关随机尿免疫球蛋白G/尿肌酐(immunoglobulin G/creatinine,IgG/Cr)与24 h尿IgG的相关性尚未见报道。本研究分析肾小球疾病患者尿IgG/Cr比值与24 h尿IgG的相关性,旨在探讨肾小球疾病患者随机尿IgG/Cr比值的临床意义,是否可以成为预测肾小球疾病严重程度及预后的指标。
1 材料与方法 1.1 临床资料收集2021年4月至6月于中国医科大学附属盛京医院肾内科肾病综合征及肾小球肾炎住院患者的临床资料。排除标准:患有肿瘤、严重脏器功能不全、合并严重并发症(感染、血栓等)或应激状态的患者。共纳入患者111例,其中男63例,女48例,平均年龄(50.6±16.0)岁。其中原发性肾小球疾病81例,继发性肾小球疾病30例。原发性肾小球疾病中行肾脏穿刺病理活检56例,包括原发性膜性肾病39例,微小病变肾病4例,IgA肾病10例,局灶节段性肾小球硬化症3例。继发性肾小球疾病中行肾脏穿刺病理活检21例,包括糖尿病肾病7例,狼疮性肾炎5例,高血压性肾损害3例,过敏性紫癜肾炎3例,淀粉样变性肾病2例,抗中性粒细胞胞质抗体(anti-neutrophil cytoplasmic antibodies,ANCA)相关性血管炎肾损害1例。
根据电子病历和实验室信息系统,收集入选患者的基本信息,包括年龄、性别、收缩压、舒张压、血红细胞计数、血红蛋白、血清白蛋白、尿素氮、血清肌酐、肾小球滤过率、甘油三酯、总胆固醇、尿肌酐、尿ACR、24 h UPRO、随机尿IgG,计算尿IgG/Cr比值并记录。检测患者24 h尿液标本中IgG含量。
1.2 患者24 h尿液标本中IgG含量检测及随机尿IgG/Cr比值计算所有患者均于入院翌日清晨开始留取24 h尿液并在24 h前取清洁中段尿留取随机尿液,并记录下时间;留取第1次尿液后存入容器内直至第2天留取最末次尿液为24 h尿液,记录尿量,混匀后测定24 h UPRO及24 h尿IgG含量。24 h UPRO及24 h尿IgG检测采用生化法;尿IgG/Cr比值(mg/g)计算为随机尿IgG(mg/dL)除以尿肌酐值(μmol/L)与肌酐分子量(113 g/mol)的乘积,所得数值再乘以107进行单位换算,得到最后的随机尿IgG/Cr比值(mg/g)。其中24 h尿IgG检测与24 h UPRO的检验取自同一天尿液标本。
1.3 统计学分析应用SPSS 25.0及GraphPad Prism.7.0软件进行统计学分析,符合正态分布计量资料采用x±s表示,偏态分布计量资料采用M(P25~P75)表示。运用Spearman秩相关方法分析24 h尿IgG与各代谢指标间的相关性,应用偏相关分析控制其他变量对相关性的影响。运用二元logistic回归模型分析尿IgG/Cr以及其他指标是否为24 h尿IgG的独立影响因素,应用多因素logistic回归分析调整其他因素的影响。P < 0.05为差异有统计学意义。绘制受试者操作特征(receiver operating characteristic,ROC)曲线,得到ROC曲线下面积(area under the curve,AUC),应用约登指数(Youden’s index)判定尿IgG/Cr的诊断界值。
2 结果 2.1 24 h尿IgG水平与其他临床指标的相关分析结果显示,患者24 h尿IgG为192.5(69.8~376.8)mg/d。其他临床指标见表 1。Spearman秩相关分析结果显示,收缩压、舒张压、血清白蛋白、估算肾小球滤过率(estimated glomerular filtration rate,eGFR)、总胆固醇、甘油三酯、尿ACR、24 h UPRO、尿IgG/Cr与24 h尿IgG均相关(均P < 0.05)。其中24 h尿IgG与血清白蛋白、eGFR呈负相关,与其他因素均呈正相关,见表 1。
| Item | Results | r | P |
| Male [n(%)] | 63(56.8) | 0.178 | 0.061 |
| Age(year) | 50.6±16.0 | 0.123 | 0.198 |
| SBP(mmHg) | 139.0(129.5-145.0) | 0.347 | < 0.001 |
| DBP(mmHg) | 88.0(78.0-93.5) | 0.225 | 0.018 |
| RBC(109/L) | 4.1(3.6-4.5) | -0.100 | 0.294 |
| HGB(g/L) | 127(114.0-136.5) | -0.105 | 0.273 |
| ALB(g/L) | 26.3(21.0-35.8) | -0.660 | < 0.001 |
| BUN(mmol/L) | 6.3(5.1-9.3) | 0.024 | 0.803 |
| SCr(umol/L) | 73.7(58.9-131.3) | 0.125 | 0.193 |
| eGFR [mL/(min·l.73 m2)] | 92.4(46.6-109.1) | -0.146 | 0.025 |
| TG(mmol/L) | 2.0(1.4-3.0) | 0.257 | 0.006 |
| TC(mmol/L) | 6.1(4.5-8.5) | 0.437 | < 0.001 |
| A/Cr(mg/g) | 2 130.8(881.3-4 037.8) | 0.727 | < 0.001 |
| 24 h UPRO(g/d) | 4.3(1.5-7.4) | 0.817 | < 0.001 |
| IgG/Cr(mg/g) | 130.4(51.4-322.6) | 0.786 | < 0.001 |
| SBP,systolic blood pressure;DBP,diastolic blood pressure;RBC,red blood cell;HGB,hemoglobin;ALB,albumin;BUN,blood urea nitrogen;SCr,serum creatinine;eGFR,estimated glomerular filtration rate;TG,triglyceride;TC,total cholesterol;A/Cr,albumin/creatinine;24 h UPRO,24 h urine protein;IgG/Cr,immunoglobulin G/creatinine. | |||
24 h尿IgG受多项指标影响,因此对尿IgG/Cr比值与24 h尿IgG两项指标行偏相关分析,将年龄、性别、收缩压、血红蛋白、血清白蛋白、血清肌酐、总胆固醇、甘油三酯作为调整变量。结果显示,尿IgG/Cr比值与24 h尿IgG的偏相关系数为0.746,P < 0.001。说明排除其他因素的影响,尿IgG/Cr比值与24 h尿IgG依然显著正相关。
2.2 24 h尿IgG的logistic回归分析肾小球疾病中将24 h尿IgG > 250 mg作为疾病风险分层标准[8],因此将24 h尿IgG > 250 mg分为大量组,将24 h尿IgG≤250 mg分为少量组,24 h尿IgG作为因变量,将各项指标纳入24 h尿IgG的二元logistic回归模型,结果显示,收缩压、血清白蛋白、总胆固醇、尿IgG/Cr为影响24 h尿IgG的独立危险因素,尿IgG/Cr每增加1个单位,24 h尿IgG升高的概率增加0.6%。见表 2。
| Viable | B | SE | Wald χ2 | P | OR | 95%CI |
| Sex | -0.598 | 0.397 | 2.271 | 0.132 | 0.550 | 0.253-1.197 |
| Age | 0.016 | 0.012 | 1.737 | 0.187 | 1.016 | 0.992-1.041 |
| SBP | 0.058 | 0.018 | 10.168 | 0.001 | 1.059 | 1.022-1.098 |
| HGB | -0.010 | 0.010 | 1.097 | 0.295 | 0.990 | 0.971-1.009 |
| ALB | -0.167 | 0.034 | 24.532 | < 0.001 | 0.846 | 0.792-0.904 |
| SCr | -0.001 | 0.002 | 0.095 | 0.758 | 0.999 | 0.995-1.004 |
| TG | 0.099 | 0.092 | 1.166 | 0.280 | 1.105 | 0.922-1.323 |
| TC | 0.206 | 0.080 | 6.597 | 0.010 | 1.229 | 1.050-1.439 |
| IgG/Cr | 0.006 | 0.002 | 16.688 | < 0.001 | 1.006 | 1.003-1.009 |
按照P < 0.10纳入标准,将单因素分析中的收缩压、血清白蛋白、总胆固醇、尿IgG/Cr纳入多因素logistic回归模型,结果显示,血清白蛋白、尿IgG/Cr是影响24 h尿IgG的独立危险因素,尿IgG/Cr每增加1个单位,24 h尿IgG升高的概率增加0.4%,见表 3。
| Viable | B | SE | Wald χ2 | P | OR | 95%CI |
| SBP | 0.036 | 0.023 | 2.415 | 0.120 | 1.037 | 0.991-1.085 |
| ALB | -0.163 | 0.051 | 10.088 | 0.001 | 0.850 | 0.769-0.940 |
| TC | -0.157 | 0.138 | 1.290 | 0.256 | 0.855 | 0.652-1.121 |
| IgG/Cr | 0.004 | 0.002 | 5.952 | 0.015 | 1.004 | 1.001-1.007 |
| Constant | -0.718 | 3.397 | 0.045 | 0.833 | 0.488 | - |
2.3 尿IgG/Cr对24 h尿IgG的预测能力
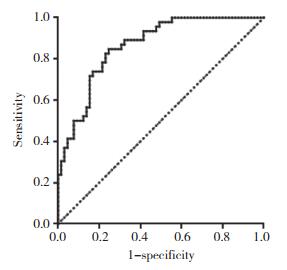
肾小球疾病患者的尿IgG/Cr对24 h尿IgG的ROC曲线分析结果显示,尿IgG/Cr ROC曲线AUC为0.863。利用约登指数(敏感度+特异度-1)最大原则得出尿IgG/Cr比值的临界值为133.5 mg/g,对应的灵敏度为0.848,特异度为0.754,即当尿IgG/Cr > 133.5 mg/g时,24 h尿IgG > 250 mg/d的可能性越大,患者可能处于高危状态,预后较差。见图 1。
|
| 图 1 肾小球疾病患者尿IgG/Cr对24 h尿IgG的ROC曲线 Fig.1 ROC curve of urinary IgG/Cr for 24 h urinary IgG in patients with glomerular disease |
3 讨论
在肾小球疾病中,尿蛋白不仅是疾病发生的“因”,也是疾病进展后的“果”。其中IgG作为尿蛋白的重要组成部分,对IMN、高血压肾病、糖尿病肾病等肾小球疾病的评估起重要作用。2019年吴昊等[9]提出IMN患者24 h尿IgG可作为反映IMN病情严重程度的无创性指标。而24 h尿液可能因过度收集或收集不足而出现误差,因此考虑应用瞬时尿液测量值反映病情。SINGH等[10]证实了尿中IgG与尿蛋白总量呈线性相关,与本研究结果一致。本研究中Spearman相关分析结果显示,尿IgG/Cr比值与24 h尿IgG显著正相关,在控制年龄、性别、血红蛋白、血清白蛋白等其他指标后其偏相关性系数未见明显下降。
本研究中尿IgG与血压、血脂水平呈正相关,与血清白蛋白呈负相关(均P < 0.05)。血清白蛋白最终经过肾脏代谢,血清白蛋白减少会提升尿IgG代谢水平,与KAMAL等[2]研究结果一致。但NARITA等[11]却认为循环中蛋白负荷增加时,尿蛋白的排泄率会相应增加,这可能由于蛋白负荷会影响肾脏血流动力学,增加入球小动脉的压力,进而提升尿蛋白的排泄率。研究显示24 h尿IgG与eGFR呈显著负相关,与2012年MOHAN等[12]得出的尿IgG与肾病患者eGFR呈负相关的结论一致。另外,尿IgG排出量与血压及血脂水平相关,可能是因为肾小球疾病患者多存在血压及血脂异常,影响肾脏灌注,进而对尿IgG排出产生影响[13]。可见,尿IgG对疾病的预后评估有一定价值,并且是影响肾功能的独立危险因素,对于排出大量IgG的肾脏疾病患者应积极给予降尿蛋白治疗[14]。
本研究结果显示,尿IgG/Cr与24 h尿IgG显著正相关,尿IgG/Cr可作为影响24 h尿IgG的独立危险因素,当尿IgG/Cr > 133.5 mg/g时,24 h尿IgG含量较高,患者预后较差。IMN中足细胞损伤、肾小球基底膜弥漫增厚,导致尿蛋白异常流出。KDIGO指南中应用24 h尿IgG作为IMN危险分层的一项指标[5]。高血压肾病、糖尿病肾病患者尿IgG含量也会明显升高,那么尿IgG/Cr检测对于继发性肾脏损伤仍具有较高的应用价值[15]。
综上所述,随机尿IgG/Cr与24 h尿IgG呈显著正相关,随机尿IgG/Cr可以作为24 h尿IgG的替代指标对肾小球疾病进行评估,尿IgG/Cr对24 h尿IgG有着良好的判断价值,对药物的疗效与疾病预后有着良好的预测作用。本研究存在一定局限性,样本量较少、研究时间较短,结果有待规模更大的前瞻性研究进一步验证。另外,本研究忽略了每个非选择性尿蛋白成分的相互作用,后续研究应重视随访过程中尿蛋白总量及相关成分占比的变化。
| [1] |
ZHANG WR, PARIKH CR. Biomarkers of acute and chronic kidney disease[J]. Annu Rev Physiol, 2019, 81: 309-333. DOI:10.1146/annurev-physiol-020518-114605 |
| [2] |
KAMAL NM, ELSAYED AM, AMIN E, et al. Urinary immunoglobulin G versus microalbuminuria as an indicator of diabetic nephropathy in type 2 diabetic patients[J]. Egypt J Intern Med, 2018, 30(2): 58-62. DOI:10.4103/ejim.ejim_80_17 |
| [3] |
GLUHOVSCHI C, GLUHOVSCHI G, PETRICA L, et al. Urinary biomarkers in the assessment of early diabetic nephropathy[J]. J Diabetes Res, 2016, 2016: 4626125. DOI:10.1155/2016/4626125 |
| [4] |
BAZZI C, RIZZA V, CASELLATO D, et al. Fractional excretion of IgG in idiopathic membranous nephropathy with nephrotic syndrome: a predictive marker of risk and drug responsiveness[J]. BMC Nephrol, 2014, 15: 74. DOI:10.1186/1471-2369-15-74 |
| [5] |
ROVIN BH, CASTER DJ, CATTRAN DC, et al. Management and treatment of glomerular diseases (part 2): conclusions from a Kidney Disease: improving Global Outcomes (KDIGO) Controversies Conference[J]. Kidney Int, 2019, 95(2): 281-295. DOI:10.1016/j.kint.2018.11.008 |
| [6] |
BAZZI C, RIZZA V, CASELLATO D, et al. Urinary IgG and α2-macroglobulin are powerful predictors of outcome and responsiveness to steroids and cyclophosphamide in idiopathic focal segmental glomerulosclerosis with nephrotic syndrome[J]. Biomed Res Int, 2013, 2013: 941831. DOI:10.1155/2013/941831 |
| [7] |
刘然, 朱红, 杨菊红, 等. 尿白蛋白与肌酐比值可以完全替代24 h尿微量白蛋白吗?[J]. 中华高血压杂志, 2020, 28(7): 700. DOI:10.16439/j.cnki.1673-7245.2020.07.029 |
| [8] |
BRANTEN AJW, DU BUF-VEREIJKEN PW, KLASEN IS, et al. Urinary excretion of beta2-microglobulin and IgG predict prognosis in idiopathic membranous nephropathy: a validation study[J]. J Am Soc Nephrol, 2005, 16(1): 169-174. DOI:10.1681/ASN.2004040287 |
| [9] |
吴昊, 侯洁, 董丹, 等. 特发性膜性肾病血、尿IgG水平检测的临床意义[J]. 中国实验诊断学, 2019, 23(5): 855-856. DOI:10.3969/j.issn.1007-4287.2019.05.029 |
| [10] |
SINGH YG, DADHEECH AG, MEENU R, et al. Correlation of urinary markers and urine creatinine in glomerulopathy at the onset of type-Ⅱ diabetic subjects[J]. Int J Clin Biochem Res, 2016, 2(3): 130-139. |
| [11] |
NARITA T, SASAKI H, HOSOBA M, et al. Parallel increase in urinary excretion rates of immunoglobulin G, ceruloplasmin, transferrin, and orosomucoid in normoalbuminuric type 2 diabetic patients[J]. Diabetes Care, 2004, 27(5): 1176-1181. DOI:10.2337/diacare.27.5.1176 |
| [12] |
MOHAN S, KALIA K, MANNARI J. Association between urinary IgG and relative risk for factors affecting proteinuria in type 2 diabetic patients[J]. Indian J Clin Biochem, 2012, 27(4): 333-339. DOI:10.1007/s12291-012-0227-6 |
| [13] |
NARITA T, HOSOBA M, KAKEI M, et al. Increased urinary excretions of immunoglobulin g, ceruloplasmin, and transferrin predict development of microalbuminuria in patients with type 2 diabetes[J]. Diabetes Care, 2006, 29(1): 142-144. DOI:10.2337/diacare.29.1.142 |
| [14] |
徐丹, 陆晨. 尿蛋白、尿β2-MG及尿IgG在特发性膜性肾病预后意义[J]. 新疆医学, 2016, 46(2): 227-230. |
| [15] |
李铮. 早期肾脏损伤尿液检测指标的应用现状及研究进展[J]. 医疗装备, 2021, 34(7): 190-191. DOI:10.3969/j.issn.1002-2376.2021.07.092 |
 2022, Vol. 51
2022, Vol. 51