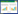文章信息
- 佟丽斐, 张霞, 杨玉蝶, 李起征, 刘鹏
- TONG Lifei, ZHANG Xia, YANG Yudie, LI Qizheng, LIU Peng
- 敲低lncRNA SNHG7通过抑制ROCK1降低前列腺癌细胞增殖和迁移能力
- Long noncoding RNA SNHG7 knockdown reduces prostate cancer cell proliferation and migration by inhibiting ROCK1
- 中国医科大学学报, 2022, 51(4): 301-305
- Journal of China Medical University, 2022, 51(4): 301-305
-
文章历史
- 收稿日期:2021-08-27
- 网络出版时间:2022-04-29 14:52
2. 大连医科大学附属大连市第五人民医院肿瘤内科, 辽宁 大连 116021;
3. 大连医科大学附属第一医院肿瘤科, 辽宁 大连 116011;
4. 大连医科大学附属大连市中心医院肿瘤内科, 辽宁 大连 116033
2. Department of Oncology, The Fifth People's Hospital of Dalian, Dalian Medical University, Dalian 116021, China;
3. Department of Oncology, The First Affiliated Hospital of Dalian Medical University, Dalian 116011, China;
4. Department of Oncology, Dalian Municipal Central Hospital, Dalian Medical University, Dalian 116033, China
前列腺癌是一种危及生命的男性恶性肿瘤,2018年约新增130万例,死亡35.9万人[1]。尽管随着诊断和治疗的不断进展,患者的生存时间极大延长,但部分高度恶性患者的5年总生存率仍很低[2]。因此,研究前列腺癌恶性发生、发展的分子机制,有助于临床减缓甚至抑制前列腺癌的恶性进展。近年来,大量证据证实长链非编码RNA(long noncoding RNA,lncRNA)在前列腺癌中发挥关键作用[3-4]。lncRNA可以竞争性结合微RNA,或作为桥接分子与其他功能蛋白形成功能复合体,从而调控肿瘤生长、转移过程关键基因的表达[3]。最近研究[5-7]发现,lncRNA小核仁RNA宿主基因7(small nucleolar RNA host gene 7,SNHG7)在多种肿瘤中呈异常高表达,而SNHG7异常高表达与乳腺癌、肺腺癌、胶质瘤的不良预后相关。尽管近期有研究[8]发现SNHG7在前列腺癌中高表达,但SNHG7在前列腺癌恶性进展中的功能仍有待进一步探索。
Rho关联含卷曲螺旋蛋白激酶1(Rho-associated coiled-coil domain containing protein kinase 1,ROCK1)是转化生长因子β/Smads信号通路调控因子,编码一种蛋白丝氨酸/苏氨酸激酶,当与Rho的鸟苷三磷酸结合时将被激活[9]。前期研究[10]表明,ROCK1参与多种疾病的发病过程。此外,ROCK1在多种肿瘤的发病机制中发挥重要作用,激活ROCK1信号通路已被证实可促进胰腺癌细胞的侵袭和转移[10],ROCK1还可通过抑制PTEN/FAK通路促进非小细胞肺癌的发生、发展[11]。尽管已经在多种肿瘤中明确其作用,但ROCK1在前列腺癌中的具体调控机制尚不清楚。本研究通过Western blotting、Transwell实验、荧光原位杂交实验等深入探讨SNHG7对前列腺癌细胞的恶性调节能力及可能机制,从而为前列腺癌的治疗提供有效策略。
1 材料与方法 1.1 细胞培养人正常前列腺上皮细胞系RWPE、前列腺癌细胞系PC-3购自中国科学院上海分院,细胞培养于RPMI 1640培养基(北京赛默飞),并添加10%胎牛血清(美国Gemini Bio-products)和100 U青霉素和链霉素双抗(北京索莱宝)。VCaP和DU145细胞培养于DMEM培养基,并添加10%胎牛血清和100 U青霉素和链霉素双抗。细胞于37 ℃、5% CO2培养箱中培养。
1.2 转染使用Lipofectamine 3000试剂盒(美国Invitrogen)转染SNHG7,根据说明书进行操作。SNHG7敲低质粒和ROCK1过表达质粒由上海吉玛公司合成(si-NC和pcDNA3.1分别为敲低和过表达空白载体,即阴性对照组)。细胞生长融合度达到90%时进行传代,传代按照1∶3比例进行。待细胞生长铺满皿底50%左右进行转染,转染过程根据说明书添加Lipofectamine 3000和P3000,转染后6 h换液,换液后24~48 h进行PCR检测,48~72 h进行Western blotting。SNHG7敲低序列(si-SNHG7):5’- GCUGGAAUAAAGAGUAACAUU-3’;阴性对照(si-NC)序列:5’-UUCUCCGAACGUGUCACGUTT-3’。
1.3 MTT实验将5×103个细胞置于96孔板中,37 ℃培养。待细胞进行SNHG7转染后,每孔加入10 μL MTT溶液,于37 ℃孵育4 h。在490 nm处测定各样品的分光光度。所有实验重复3次,计算平均值。
1.4 Transwell实验通过Transwell实验(美国Costar)体外评估前列腺癌细胞的侵袭和迁移能力。细胞转染后,将1×105个细胞接种于上室,并加入300 μL培养基,下室加入等量培养基。48 h后擦除膜表面的细胞,使用甲醛固定20 min,随后PBS清洗3遍,最后用0.5%结晶紫染色。在显微镜下随机分为5个区,计数浸润和迁移细胞数目。
1.5 总RNA提取和PCR按照说明书使用TRIzol试剂分离总RNA。使用PrimeScript试剂盒(日本TaKaRa),根据说明书进行逆转录和实时PCR。使用SYBR® Premix Ex TaqTM Ⅱ在Bio-Rad CFX 96实时PCR系统上进行实时PCR。GAPDH为内参,采用2-ΔΔCt法测定基因相对表达量。引物序列:SNHG7,正义5’-GTTGGGGTGTTGGCATTCTTGTT-3’,反义5’-GCGCCCAATACGACCAAATC-3’;ROCK1,正义5’-CTGCAACTGGAACTCAACCAAGAA-3’,反义5’-TTAGCACGCAATTGCTCAATATCAC-3’;GAPDH,正义5’-CGTCGCTAGCGATCGTTACA-3’,反义5’-CTAAATGCTAGTCTTTACGA-3’。
1.6 Western blotting将SNHG7转染后的前列腺癌细胞溶解于含有蛋白酶抑制剂的RIPA缓冲液。蛋白(20 μg)经过10%SDS-聚丙烯酰胺凝胶电泳,转移到聚偏二乙烯膜上。使用针对ROCK1(中国CST公司)和GAPDH(中国CST公司)的一抗进行孵育,4 ℃过夜,翌日TBST清洗,每次5 min;随后荧光二抗室温孵育2 h(中国CST公司)。使用增强化学发光试剂进行发光成像(型号:FD8020,杭州富德生物科技有限公司)。
1.7 荧光原位杂交实验将细胞均匀铺在6孔板中,使用4%多聚甲醛固定20 min,PBS清洗3次,每次5 min;随后使用甘氨酸处理5 min,PBS再次冲洗5 min;使用0.5% Triton-100对细胞进行透膜10 min;PBS清洗3次,每次3 min;滴加杂交液预处理1 h,然后使用生物素标记的SNHG7探针(武汉塞维尔)进行细胞孵育,4 ℃过夜;抗生物素抗体(北京赛默飞)进行杂交过夜,最后滴加荧光二抗(北京CST),进行DAPI(北京碧云天)显色。
1.8 统计学分析采用GraphPad Prism 5软件进行统计学分析。每个实验重复3次,结果以x±s表示。采用t检验进行2组间比较。P < 0.05为差异有统计学意义。
2 结果 2.1 SNHG7在前列腺癌中高表达并提示预后不良为了分析SNHG7在前列腺癌中的表达,首先通过癌症基因组图谱数据库(http://gepia.cancer-pku.cn)对其进行癌和癌旁组织表达差异分析。结果显示,SNHG7在前列腺癌组织中高表达(图 1A)。此外,生存分析提示,高表达SNHG7与患者生存时间较短明显相关(图 1B)。细胞学实验发现,与人正常前列腺上皮细胞(RWPE)相比,前列腺癌细胞(PC-3、VCaP和DU145)中SNHG7明显高表达(图 1C)。这些结果提示,SNHG7在前列腺癌的发生、发展中发挥重要的作用。
|
| A, The Cancer Genome Atlas (TCGA) database analysis of SNHG7 expression differences in prostate cancer versus adjacent tissues (tumor: 492, normal: 52);B, TCGA database analysis of the relationship between SNHG7 expression and patient survival time; C, SNHG7 expression in different prostate cancer cell lines. *P < 0.05 vs RWPE; **P < 0.01 vs RWPE. 图 1 SNHG7在前列腺癌中高表达并提示预后不良 Fig.1 SNHG7 is highly expressed in prostate cancer and indicates a poor prognosis |
2.2 SNHG7主要位于细胞质
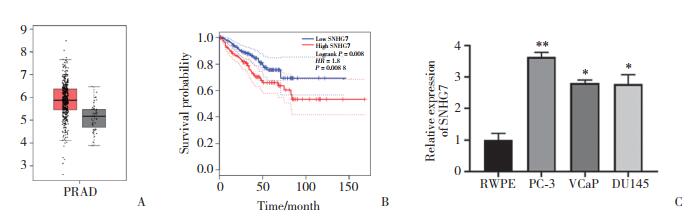
鉴于SNHG7在肿瘤组织和细胞中高表达,为进一步了解其功能和机制,通过荧光原位杂交实验检测SNHG7的亚细胞分布情况。结果提示,SNHG7主要位于细胞质。见图 2。
|
| Green fluorescence, SNHG7 probe; DAPI, nuclear blue staining; Merge, green and blue fusion image. 图 2 SNHG7主要位于细胞质中×400 Fig.2 SNHG7 is mainly located in the cytoplasm ×400 |
2.3 敲低SNHG7抑制了前列腺癌细胞的增殖和迁移能力
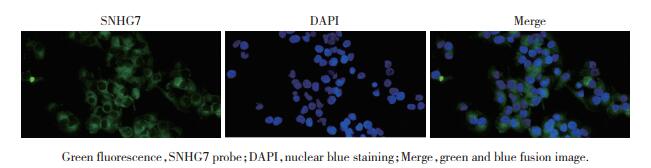
为了进一步分析SNHG7的功能,构建SNHG7敲低细胞系。通过PCR对敲低细胞系进行SNHG7检测(图 3A),结果显示,成功构建了敲低细胞系。随后使用SNHG7敲低细胞系进行MTT检测,评估SNHG7对PC-3细胞增殖的影响,结果发现,其抑制了细胞增殖(图 3B)。Transwell迁移实验也发现,其抑制了前列腺癌细胞迁移(图 3C)。这些结果提示,SNHG7在前列腺癌细胞的增殖和迁移中发挥重要作用。
|
| A, SNHG7 expression in PC-3 cells after transfection with si-NC and si-SNHG7;B, effects of si-NC and si-SnHG7 on cell proliferation evaluated by MTT assay; C, migration capacity after SNHG7 knockdown detected by transwell assay (×400). **P < 0.01 vs si-NC. 图 3 敲低SNHG7可抑制前列腺癌细胞的增殖和迁移 Fig.3 SNHG7 knockdown inhibits prostate cancer cell proliferation and migration |
2.4 SNHG7调控ROCK1的表达
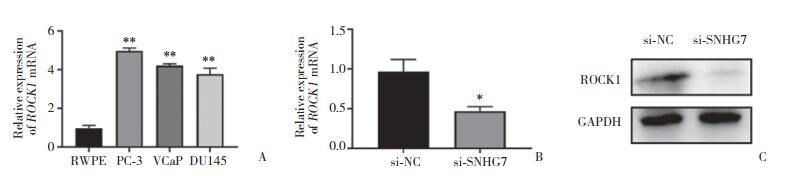
为了分析SNHG7能否通过ROCK1调节前列腺癌细胞的恶性进展,采用PCR检测ROCK1的表达,结果发现,ROCK1在多种前列腺癌细胞中高表达(图 4A)。而当敲低SNHG7后,ROCK1 mRNA表达减少(图 4B),蛋白表达减少(图 4C)。这说明SNHG7的对前列腺癌细胞恶性能力的调控可能是ROCK1介导的。
|
| A, differences in ROCK1 mRNA expression among different prostate cancer cell lines; B, ROCK1 mRNA expression decreased after SHNG7 knockdown; C, ROCK1 protein expression changed after SHNG7 knockdown. *P < 0.05 vs si-NC; **P < 0.01 vs RWPE. 图 4 敲低SNHG7可抑制ROCK1的表达 Fig.4 SNHG7 knockdown inhibited ROCK1 expression |
2.5 SNHG7通过ROCK1调控前列腺癌细胞的增殖和迁移
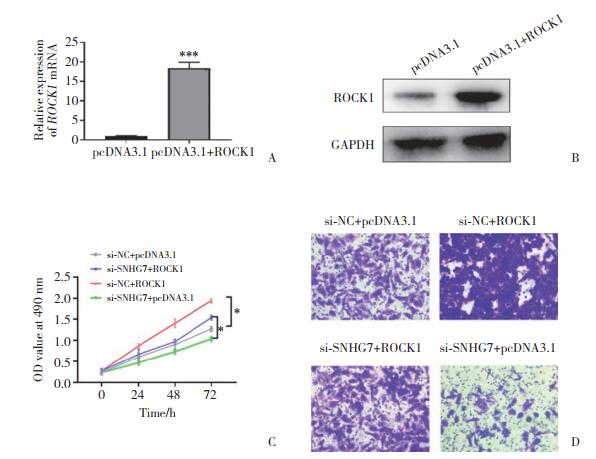
进一步分析SNHG7与ROCK1及前列腺癌细胞增殖和迁移能力的关系,进行挽救实验。首先构建ROCK1过表达细胞系,通过PCR(图 5A)和Western blotting(图 5B)检测转染后ROCK1的表达,结果证实,ROCK1过表达细胞系成功构建。随后使用SNHG7敲低细胞系同时进行ROCK1敲低,结果发现,前列腺癌PC-3细胞的增殖(图 5C)和迁移能力(图 5D)恢复。以上结果表明,SNHG7通过ROCK1调控前列腺癌细胞的增殖和迁移。
|
| A, ROCK1 mRNA expression in PC-3 cells transfected with ROCK1 plasmid; B, protein expression after ROCK1 overexpression; C, MTT assay was used to detect PC-3 cell proliferation after co-transfection with si-SnHG7 and ROCK1 overexpressed plasmid; D, MTT assay was used to detect PC-3 cell migration after co-transfection with si-SNHG7 and ROCK1 overexpressed plasmid (×400). *P < 0.05 (si-SNHG7+ROCK1 vs si-SNHG7+pcDNA3.1 and si-NC+ROCK1 vs si-SNHG7+ROCK1). ***P < 0.001 vs pcDNA3.1. 图 5 SNHG7通过ROCK1调控前列腺癌细胞的增殖和迁移 Fig.5 SNHG7 regulates prostate cancer cell proliferation and migration through ROCK1 |
3 讨论
近几十年来,lncRNA在疾病特别是癌症中的重要作用越来越受到人们的关注。研究[12]已经发现,许多lncRNA作为癌基因或肿瘤抑制因子,可以调控前列腺癌的发生和转移,但不同lncRNA在不同肿瘤中的作用尚不明确。lncRNA SNHG7是近年发现的新型非编码RNA,多项研究[13]表明,lncRNA SNHG7在多种癌症中过表达,包括肺癌、乳腺癌、结直肠癌和膀胱癌,通过多种途径促进肿瘤的发生。最近有研究[14]报道了SNHG7加速前列腺癌的恶性进展,但SNHG7在其中的调节机制需要进一步探索。
本研究发现,与癌旁组织相比,lncRNA SNHG7在癌组织中明显上调,并且SNHG7高表达提示患者生存时间缩短,体外细胞实验同样证明其在多种肿瘤细胞系中高表达。这些结果提示,SNHG7在前列腺癌的发生、发展中可能起到重要作用。为了阐明SNHG7异常高表达的意义,本研究通过细胞增殖实验和Transwell实验检测细胞增殖和迁移能力,结果发现,SNHG7敲低后前列腺癌PC-3细胞的增殖和迁移能力都被抑制。近年发现ROCK1与多种肿瘤的生长和转移密切相关,包括骨肉瘤、胰腺癌甚至血液系统肿瘤。ROCK1功能多样化,广泛参与多种细胞过程,包括凋亡、侵袭、纤维化等[15]。然而,SNHG7与ROCK1之间的调控关系尚不清楚。为此,本研究构建了SNHG7敲低前列腺癌细胞系,通过共转染实验发现,敲低SNHG7后ROCK1的表达明显减少;并且通过MTT实验和Transwell实验发现,SNHG7敲低后细胞的增殖和迁移能力可被过表达ROCK1恢复。
综上所述,SNHG7对于前列腺癌生长、转移的调控是通过ROCK1介导的,以SNHG7或ROCK1为靶点的肿瘤治疗方式可能成为治疗前列腺癌的一种有效策略。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
NUHN P, DE BONO JS, FIZAZI K, et al. Update on systemic prostate cancer therapies: management of metastatic castration-resistant prostate cancer in the era of precision oncology[J]. Eur Urol, 2019, 75(1): 88-99. DOI:10.1016/j.eururo.2018.03.028 |
| [3] |
AIRD J, BAIRD AM, LIM MCJ, et al. Carcinogenesis in prostate cancer: the role of long non-coding RNAs[J]. Noncoding RNA Res, 2018, 3(1): 29-38. DOI:10.1016/j.ncrna.2018.01.001 |
| [4] |
HELSMOORTEL H, EVERAERT C, LUMEN N, et al. Detecting long non-coding RNA biomarkers in prostate cancer liquid biopsies: hype or hope?[J]. Noncoding RNA Res, 2018, 3(2): 64-74. DOI:10.1016/j.ncrna.2018.05.001 |
| [5] |
CHENG G, ZHENG J, WANG L. LncRNA SNHG7 promotes glioma cells viability, migration and invasion by regulating miR-342-3p/AKT2 axis[J]. Int J Neurosci, 2021, 131(12): 1190-1202. DOI:10.1080/00207454.2020.1790556 |
| [6] |
ZHANG H, ZHANG XY, KANG XN, et al. LncRNA-SNHG7 enhances chemotherapy resistance and cell viability of breast cancer cells by regulating miR-186[J]. Cancer Manag Res, 2020, 12: 10163-10172. DOI:10.2147/cmar.s270328 |
| [7] |
LI ZH, YU NS, DENG Q, et al. LncRNA SNHG7 mediates the chemoresistance and stemness of breast cancer by sponging miR-34a[J]. Front Oncol, 2020, 10: 592757. DOI:10.3389/fonc.2020.592757 |
| [8] |
HAN Y, HU H, ZHOU J. Knockdown of lncRNA SNHG7 inhibited epithelial-mesenchymal transition in prostate cancer though miR-324-3p/WNT2B axis in vitro[J]. Pathol Res Pract, 2019, 215(10): 152537. DOI:10.1016/j.prp.2019.152537 |
| [9] |
WANG J, ZHANG SW, LI XH, et al. LncRNA SNHG7 promotes cardiac remodeling by upregulating ROCK1 via sponging miR-34-5p[J]. Aging, 2020, 12(11): 10441-10456. DOI:10.18632/aging.103269 |
| [10] |
ZHOU XF, GUO XJ, CHEN MY, et al. HIF-3α promotes metastatic phenotypes in pancreatic cancer by transcriptional regulation of the RhoC-ROCK1 signaling pathway[J]. Mol Cancer Res, 2018, 16(1): 124-134. DOI:10.1158/1541-7786.mcr-17-0256 |
| [11] |
HU C, ZHOU H, LIU Y, et al. ROCK1 promotes migration and invasion of non-small-cell lung cancer cells through the PTEN/PI3K/FAK pathway[J]. Int J Oncol, 2019, 55(4): 833-844. DOI:10.3892/ijo.2019.4864 |
| [12] |
LINGADAHALLI S, JADHAO S, SUNG YY, et al. Novel lncRNA LINC00844 regulates prostate cancer cell migration and invasion through AR signaling[J]. Mol Cancer Res, 2018, 16(12): 1865-1878. DOI:10.1158/1541-7786.mcr-18-0087 |
| [13] |
BIAN Z, JI W, XU B, et al. The role of long noncoding RNA SNHG7 in human cancers (Review)[J]. Mol Clin Oncol, 2020, 13(5): 45. DOI:10.3892/mco.2020.2115 |
| [14] |
QI H, WEN B, WU Q, et al. Long noncoding RNA SNHG7 accelerates prostate cancer proliferation and cycle progression through cyclin D1 by sponging miR-503[J]. Biomed Pharmacother, 2018, 102: 326-332. DOI:10.1016/j.biopha.2018.03.011 |
| [15] |
WHATCOTT CJ, NG S, BARRETT MT, et al. Inhibition of ROCK1 kinase modulates both tumor cells and stromal fibroblasts in pancreatic cancer[J]. PLoS One, 2017, 12(8): e0183871. DOI:10.1371/journal.pone.0183871 |
 2022, Vol. 51
2022, Vol. 51