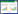文章信息
- 陈欢, 张秀春, 阎旭, 赵传胜
- 强直性肌营养不良1型1例报道及文献复习
- Myotonic dystrophy type 1:a case report and literature review
- 中国医科大学学报, 2022, 51(3): 282-285
- Journal of China Medical University, 2022, 51(3): 282-285
-
文章历史
- 收稿日期:2021-06-25
- 网络出版时间:2022-01-13 12:19
2. 中国医科大学附属第一医院神经内科, 沈阳 110001;
3. 沈阳市第一人民医院神经内科, 沈阳 110041
强直性肌营养不良1型(myotonic dystrophy type 1,DM1)是一种常染色体显性单基因遗传病,是成人肌营养不良最常见的类型[1]。DM1患者常合并多系统损伤,部分患者起病形式不典型,因此早期诊断相对困难[2]。DM1合并感觉障碍研究鲜有报道,本文报道1例以颈椎间盘突出病变作为首诊的DM1患者的临床诊治经过,并进行文献复习。
1 临床资料患者,男,51岁,7年前无明显诱因逐渐出现四肢无力,表现为双上肢持重物困难,双下肢走路不稳,无走路拖沓,伴四肢末端疼痛,未系统诊治,而后症状逐渐加重,出现走路困难至无法独立行走,2020年10月20日就诊于外院骨科,颈椎MRI检查结果显示,C2~7椎间盘突出,伴椎管狭窄、脊髓受压,C4~6水平脊髓内高信号,脊髓变性样改变。对症治疗症状未见缓解。完善肌电图检查提示周围神经轴索合并髓鞘损害。
2020年10月27日就诊于中国医科大学附属第一医院神经内科,以“四肢无力、疼痛7年,进行性加重1年”为主诉入院。患者无饮水呛咳及吞咽困难,大小便正常,近半年体质量无明显下降。既往糖尿病病史7年,长期口服二甲双胍缓释片控制血糖,2004年肠梗阻手术史,否认白内障、青光眼病史,否认其他疾病及外伤手术史。未婚,弟、妹各1人,死于心脏衰竭,兄、姐各1人,均健康。父母已故,死亡原因不详。
体格检查:神志清楚,言语欠清,发音构音不全。双眼向各方向运动充分,无眼震。双侧额纹以及鼻唇沟对称,软腭及悬雍垂运动正常,咽反射存在,伸舌居中。双上肢肌力Ⅲ级,双下肢肌力Ⅳ级,四肢肌张力略增高。T2以下痛觉减退,四肢末端痛觉过敏,其他神经科查体未见明显异常。
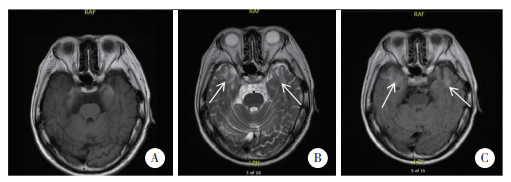
辅助检查:头磁共振平扫提示双侧颞极区可见片状长T2信号,FLAIR呈高信号(图 1)。通气功能检查显示混合性通气功能障碍,小气道功能障碍,通气储量百分比为89.4%。心脏超声检查结果显示心内结构及血流未见异常,静息状态下左心室整体收缩功能正常。进一步完善肌电图检查结果显示,针电极肌电图检查显示右拇短展肌、右胫前肌插入时可见肌强直电位;周围神经呈轴索合并髓鞘损害。进一步对患者问诊和查体发现肌丘(+),同时有双手握紧张开费力及性功能下降。化验结果显示血沉21 mm/h,血浆纤维蛋白原4.36 g/L,血浆糖化血红蛋白11.4%,血清γ-谷氨酰基转移酶137 U/L,血清白蛋白36.6 g/L,血清甘油三酯2.31 mmol/L,血清低密度脂蛋白胆固醇3.76 mmol/L,空腹血糖14.18 mmol/L,其他化验结果未见异常。
|
| A,T1加权像;B,T2加权像;C,Flair像. 图 1 颅脑MRI检查结果 |
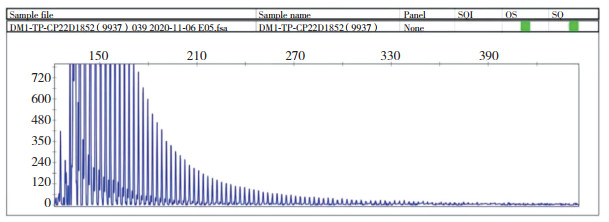
基因检测结果显示,检测到DMPK基因3’UTR区的CTG重复数目超过50次,属于全突变范围,符合DM1的基因突变特征(图 2)。
|
| 图 2 DM1型基因检测结果 |
患者临床诊断为DM1。住院期间给予营养神经、降血糖等治疗,出院时症状无明显改善。目前尚无有效治疗手段,建议患者出院后继续功能康复训练,对症治疗。出院后动态随访1年,患者病情无明显变化。
2 讨论强直性肌营养不良为常染色体显性遗传病,是成人肌营养不良的常见类型,发病率约为1/8 000[3]。强直性肌营养不良分为DM1和DM2 2种,DM1是由19q13号染色体上的DMPK基因CTG扩增引起的,DM2是由位于3q21号染色体上的CNBP基因1号内含子内的CCTG扩增引起的,其中,DM1较DM2的发病率高[4]。
DM1是多系统受累的一组疾病,以进行性肌无力和肌强直为主要特征,常常伴发其他系统受累表现,如白内障、心律失常、消化功能障碍、呼吸功能不全、内分泌紊乱以及其他神经系统退行性病变[5],因此导致了DM1诊断的复杂性。本例患者因四肢无力、疼痛就诊,颈椎MRI提示C2~7椎间盘突出,查体提示T2以下痛觉减退,患者因此就诊于骨科而延误了诊治。本例患者累及的感觉障碍包括感觉过敏和感觉减退。其中,疼痛是DM1患者的常见表现[6]。有研究[7]报道DM1患者较为常见的疼痛部位为下背部、后颈部和手的腹侧,疼痛程度可随着疾病的进展逐渐加重。疼痛症状的可能原因是由DM1的肌肉病变所致,随着疾病的进展,肌肉组织被脂肪组织浸润取代,逐渐导致功能障碍和感觉异常[7-8]。疼痛的另一种可能原因为感觉神经受累所致。长期以来,DM1是否累及周围神经一直存在争议。以“强直性肌营养不良”“周围神经病变”“感觉”为关键词检索中国知网和万方数据库,以“myotonic dystrophy”“peripheral neuropathy”“sensory”为关键词检索Pubmed数据库近25年文献,共找到4篇DM1累及感觉神经相关文献[9-12]。BURAKGAZI等[9]报道了12例DM1患者,仅1例患者肌电图检查提示感觉神经传导障碍,表现为双侧腓肠神经、腓浅神经感觉神经诱发电位未引出,其余11例患者感觉神经传导测定结果在正常范围。BAE等[11]研究也得出了类似结果,18例DM1患者中,仅1例患者肌电图检查出现周围神经轴索损害,表明了DM1患者较少累及周围神经。2001年巴西的一项研究[12]报道了25例DM1患者,有6例患者肌电图检查提示轻度至中度周围神经轴索损害,但其中4例患者合并糖尿病,提示了周围神经损害可能与糖尿病相关。HERMANS等[10]研究显示93例DM1患者中,16例患者存在周围神经受累,主要表现为双下肢神经脱髓鞘损害,这与远端肌肉力量下降和跟腱反射缺失有关,这些患者通常感觉障碍不明显,其中仅有6例出现轻微感觉症状。因此可见DM1较少引起感觉神经受累,即使有感觉神经传导受损,也极少引起相应感觉障碍症状。有研究[11]指出,DM1患者中大多数神经传导异常更大可能是由肌病改变、偶发性神经病变或神经根病变所致,而不是神经原发性受累所致。因此,DM1患者如果感觉症状或体征严重时,应排除其他原因[10]。
DM1患者也常常累及内分泌系统,随着疾病的进展,糖尿病的发病率可逐渐升高[13]。糖尿病是引起周围神经受累和疼痛的常见疾病[14],以四肢末端痛觉过敏较为常见,约有10%~20%糖尿病患者会出现疼痛症状,下肢较上肢多见,女性多于男性[15-16]。研究[16]表明糖基化诱导的体内感觉神经元CaV3.2通道的改变可能直接导致糖尿病患者出现痛觉过敏,引起疼痛症状。因此,对于合并肌肉症状和疼痛症状的糖尿病患者,对于DM1的诊断也具有一定的提示意义。
颈椎间盘突出症是指急性损伤或慢性劳损导致颈椎间盘突出,压迫后方脊髓和(或)神经根,产生相应的运动、感觉异常等症状。颈椎间盘突出部位不同,临床表现不尽相同。若压迫神经根会产生上肢放射痛或麻木等根性症状,甚至出现肌力下降[17]。当椎间盘压迫脊髓,引起脊髓变性时部分患者可出现受累平面以下感觉障碍或病理反射阳性[18]。有研究[19]报道了1例合并上胸髓变性的DM1患者,表现为进行性下肢无力伴疼痛,查体可见胸部平面以下痛觉减退,因脊髓受压节段和压迫程度不同,感觉障碍平面及临床表现不同。DM1造成脊髓变性可能原因是由于黄韧带和后纵韧带肥厚,颈椎前凸消失,脊髓受压,逐渐发展为上胸椎脊髓病。本研究患者有T2平面以下感觉缺失,为DM1合并颈椎间盘突出所引起的特征性感觉障碍。到目前为止,没有更多的证据支持DM1与椎间盘突出的关系。
强直性肌营养不良的确诊依赖于基因检测和肌肉活检,但早期的识别也尤为重要。典型的肌强直或肌肉萎缩一般诊断不难,但强直性肌营养不良是多系统受累的疾病,时常以其他系统受累起病,如白内障、非酒精性脂肪肝、心律失常、糖尿病、正常颅压脑积水等[20-23],对早期正确诊断造成一定的干扰。肌电图是早期诊断手段之一,DM1患者肌电图的主要特点为肌强直电位放电伴肌源性损害,常有运动单位时限缩短,多相波增多[24];出现典型的肌电图改变可怀疑本病的可能。部分患者早期的头部磁共振检查也对DM1的诊断具有重要意义。成年型DM1患者磁共振常见表现为脑室周围、深部白质及皮层下白质T2、FLAIR信号增高,常累及颞叶,常伴有脑萎缩和血管周围间隙扩张,尤其是血管周围间隙扩张,常常在疾病早期出现,对诊断有提示作用[20]。肌肉磁共振检查也是可靠的检查手段,71.4%DM1患者下肢至少有一块肌肉存在脂肪浸润,于T1加权像上呈高信号[25]。同时,上肢肌肉磁共振检查发现,DM1患者不仅累及前臂肌肉,而且累及近端肌肉,对上肢肌肉受累情况的评估也具有重要意义[26]。一旦怀疑DM1,配合肌肉活检和基因检测,若出现肌肉病理改变为细胞核内移、固缩或肌纤维大小变异、萎缩,基因分析中有致病基因三核苷酸重复序列异常扩增,即可明确诊断[24, 27]。
综上所述,DM1临床表现多样,首发症状也不尽相同,少数DM1患者可引起感觉神经受累,尤其当合并传导束型感觉障碍的患者往往骨科就诊,以颈椎间盘突出为首诊,早期诊断较为困难。因此早期完善肌电图、磁共振等检查对诊断具有提示意义。对于怀疑DM1的患者,当感觉症状或体征严重时,也应首先排除其他病因。
DM1造成脊髓变性的可能原因是由于黄韧带和后纵韧带肥厚,颈椎前凸消失,脊髓逐渐受压变性,需要进一步研究来明确其相关性。神经内科、骨科医师应提高对DM1的认知,使患者尽早确诊并治疗,从而改善患者的预后。
| [1] |
BASSEZ G, AUDUREAU E, HOGREL JY, et al. Improved mobility with metformin in patients with myotonic dystrophy type 1:a randomized controlled trial[J]. Brain, 2018, 141(10): 2855-2865. DOI:10.1093/brain/awy231 |
| [2] |
HEATWOLE C, BODE R, JOHNSON N, et al. Patient-reported impact of symptoms in myotonic dystrophy type 1(PRISM-1)[J]. Neurology, 2012, 79(4): 348-357. DOI:10.1212/wnl.0b013e318260cbe6 |
| [3] |
SMITH CA, GUTMANN L. Myotonic dystrophy type 1 management and therapeutics[J]. Curr Treat Options Neurol, 2016, 18(12): 52. DOI:10.1007/s11940-016-0434-1 |
| [4] |
YUM K, WANG ET, KALSOTRA A. Myotonic dystrophy: disease repeat range, penetrance, age of onset, and relationship between repeat size and phenotypes[J]. Curr Opin Genet Dev, 2017, 44: 30-37. DOI:10.1016/j.gde.2017.01.007 |
| [5] |
LU H, LI Y, SADOWSKY M, et al. Clinical characteristics of 37 Chinese patients with myotonic dystrophy type 1[J]. Brain Circ, 2016, 2(2): 95-98. DOI:10.4103/2394-8108.186282 |
| [6] |
MIRÓ J, GERTZ KJ, CARTER GT, et al. Pain location and intensity impacts function in persons with myotonic dystrophy type 1 and facioscapulohumeral dystrophy with chronic pain[J]. Muscle Nerve, 2014, 49(6): 900-905. DOI:10.1002/mus.24079 |
| [7] |
SOLBAKKEN G, LØSETH S, FROHOLDT A, et al. Pain in adult myotonic dystrophy type 1:relation to function and gender[J]. BMC Neurol, 2021, 21(1): 101. DOI:10.1186/s12883-021-02124-9 |
| [8] |
SONG J, FU J, MA M, et al. Lower limb muscle magnetic resonance imaging in Chinese patients with myotonic dystrophy type 1[J]. Neurol Res, 2020, 42(2): 170-177. DOI:10.1080/01616412.2020.1716494 |
| [9] |
BURAKGAZIAS. Electrodiagnostic findings in myotonic dystrophy: a study on 12 patients[J]. Neurol Int, 2019, 11(4): 8205. DOI:10.4081/ni.2019.8205 |
| [10] |
HERMANS MC, FABER CG, VANHOUTTE EK, et al. Peripheral neuropathy in myotonic dystrophy type 1[J]. J Peripher Nerv Syst, 2011, 16(1): 24-29. DOI:10.1111/j.1529-8027.2011.00313.x |
| [11] |
BAE JS, KIM OK, KIM SJ, et al. Abnormalities of nerve conduction studies in myotonic dystrophy type 1:primary involvement of nerves or incidental coexistence?[J]. J Clin Neurosci, 2008, 15(10): 1120-1124. DOI:10.1016/j.jocn.2007.11.002 |
| [12] |
PFEILSTICKER BH, BERTUZZO CS, NUCCI A. Electrophysiological evaluation in myotonic dystrophy: correlation with CTG length expansion[J]. Arq Neuropsiquiatr, 2001, 59(2-a): 186-191. DOI:10.1590/s0004-282x2001000200006 |
| [13] |
DAHLQVIST JR, ØRNGREEN MC, WITTING N, et al. Endocrine function over time in patients with myotonic dystrophy type 1[J]. Eur J Neurol, 2015, 22(1): 116-122. DOI:10.1111/ene.12542 |
| [14] |
KIRTHI V, PERUMBALATH A, BROWN E, et al. Prevalence of peripheral neuropathy in pre-diabetes: a systematic review[J]. BMJ Open Diab Res Care, 2021, 9(1): e002040. DOI:10.1136/bmjdrc-2020-002040 |
| [15] |
TSENG CH, CHONG CK, SHEU JJ. Prevalence and risk factors of sensory symptoms in diabetes patients in Taiwan[J]. Front Endocrinol, 2021, 11: 580426. DOI:10.3389/fendo.2020.580426 |
| [16] |
JOKSIMOVIC SL, EVANS JG, MCINTIRE WE, et al. Glycosylation of CaV3.2 channels contributes to the hyperalgesia in peripheral neuropathy of type 1 diabetes[J]. Front Cell Neurosci, 2020, 14: 605312. DOI:10.3389/fncel.2020.605312 |
| [17] |
余柯晓, 陈亮, 楚磊, 等. 单节段颈椎间盘突出症致双神经根卡压的临床研究[J]. 现代医药卫生, 2020, 36(19): 3149-3153. DOI:10.3969/j.issn.1009-5519.2020.19.045 |
| [18] |
SASAI K, ADACHI T, TOGANO K, et al. Two-level disc herniation in the cervical and thoracic spine presenting with spastic paresis in the lower extremities without clinical symptoms or signs in the upper extremities[J]. Spine J, 2006, 6(4): 464-467. DOI:10.1016/j.spinee.2005.10.018 |
| [19] |
SON HK, CHA YS, SUH H, et al. Upper thoracic myelopathy caused by delayed neck extensor weakness in myotonic dystrophy[J]. Ann Rehabil Med, 2012, 36(4): 569-572. DOI:10.5535/arm.2012.36.4.569 |
| [20] |
BIELEN J, SCHEPERS S, TERMOTE B, et al. Imaging in myotonic dystrophy type 1-case reports[J]. J Belg Soc Radiol, 2016, 100(1): 81. DOI:10.5334/jbr-btr.994 |
| [21] |
ONODA H, IMAMURA T, USHIJIMA R, et al. A young patient presenting with atrioventricular block diagnosed as myotonic dystrophy[J]. Intern Med, 2020, 59(12): 1531-1533. DOI:10.2169/internalmedicine.4259-19 |
| [22] |
WANG JY, LIU M, SHANG WJ, et al. Myotonic dystrophy type 1 accompanied with normal pressure hydrocephalus: a case report and literature review[J]. BMC Neurol, 2020, 20(1): 53. DOI:10.1186/s12883-020-01636-0 |
| [23] |
TANAKA N, KIMURA T, FUJIMORI N, et al. Non-alcoholic fatty liver disease later diagnosed as myotonic dystrophy[J]. World J Hepatol, 2020, 12(9): 685-692. DOI:10.4254/wjh.v12.i9.685 |
| [24] |
卜碧涛, 李悦. 强直性肌营养不良[J]. 中华神经科杂志, 2019, 52(8): 654-658. DOI:10.3760/cma.j.issn.1006-7876.2019.08.010 |
| [25] |
PERIC S, MAKSIMOVIC R, BANKO B, et al. Magnetic resonance imaging of leg muscles in patients with myotonic dystrophies[J]. J Neurol, 2017, 264(9): 1899-1908. DOI:10.1007/s00415-017-8574-0 |
| [26] |
HAYASHI K, HAMANO T, KAWAMURA Y, et al. Muscle MRI of the upper extremity in the myotonic dystrophy type 1[J]. Eur Neurol, 2016, 76(1-2): 87-94. DOI:10.1159/000448328 |
| [27] |
OZIMSKI LL, SABATER-ARCIS M, BARGIELA A, et al. The hallmarks of myotonic dystrophy type 1 muscle dysfunction[J]. Biol Rev CambPhilos Soc, 2021, 96(2): 716-730. DOI:10.1111/brv.12674 |
 2022, Vol. 51
2022, Vol. 51