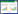文章信息
- 李永志, 张铖, 裴俊鹏, 张万川, 张春东, 戴冬秋
- LI Yongzhi, ZHANG Cheng, PEI Junpeng, ZHANG Wanchuan, ZHANG Chundong, DAI Dongqiu
- 长链非编码RNA MCF2L-AS1促进胃癌的增殖、侵袭和迁移
- Long noncoding RNA MCF2L-AS1 promotes proliferation, invasion, and migration of gastric cancer
- 中国医科大学学报, 2022, 51(3): 243-248
- Journal of China Medical University, 2022, 51(3): 243-248
-
文章历史
- 收稿日期:2021-01-11
- 网络出版时间:2022-01-13 11:35
2. 东京大学医学部胃食道外科, 东京113-0033;
3. 中国医科大学附属第四医院肿瘤治疗中心, 沈阳 110032
2. Department of Gastrointestinal Surgery, Graduate School of Medicine, University of Tokyo, Tokyo 113-0033, Japan;
3. Cancer Center, The Fourth Affiliated Hospital of China Medical University, Shenyang 110032, China
胃癌是全球五大常见癌症之一[1]。胃癌与幽门螺杆菌[2]、高盐饮食、低水果饮食、饮酒和吸烟等因素相关[3]。近年来胃癌的发病率和死亡率缓慢下降[4],但全球胃癌患者的5年生存率仍很低[5-6]。因此,研究胃癌进展的生物学分子机制对胃癌的早期诊断和治疗具有重大意义。
长链非编码RNA(long noncoding RNA,lncRNA)在细胞核或细胞质中调节基因的表达[7]。它们编码蛋白质能力较弱[8]。lncRNA参与转录调控[9-10]、胚胎发育和疾病进展等过程[11-12],lncRNA的失调可促进肿瘤的进展[13-14]。
MCF2L基因的变异与骨关节炎有关[15]。MCF2L反义RNA 1(MCF2L-AS1)是新鉴定出来的位于染色体13q34上的lncRNA,可以调节骨细胞的分化[16]。
本研究通过生物信息学分析和实时定量PCR发现,相对于癌旁非癌胃组织,MCF2L-AS1在胃癌组织中表达升高。本研究还对MCF2L-AS1在胃癌中调节增殖、侵袭和转移的作用进行分析,并通过癌症基因组图谱(the cancer genome atlas,TCGA)和基因本体论(the gene ontology,GO)数据库对与MCF2L-AS1相关的mRNA进行了富集分析,以探索MCF2L-AS1可能参与的生物学过程。
1 材料与方法 1.1 材料本研究使用的2种胃癌细胞系(HGC-27,AGS)和非癌胃细胞系(GES-1)购自中国科学院。RPMI-1640培养基和高糖DMEM培养基购自美国Invitrogen公司。胎牛血清购自美国Gibco公司。TRIzol试剂和Lipofectamine 3000试剂购自美国Invitrogen公司。TaKaRa反转录试剂盒、TaKaRa实时荧光定量试剂盒购自宝生物工程(大连)有限公司。siRNA购自上海吉玛制药技术有限公司。细胞计数试剂盒8和transwell小室购自美国康宁公司。Matrigel(基质胶)购自北京索莱宝科技有限公司。
1.2 生物信息学分析利用TCGA数据库,分析lncRNA MCF2L-AS1在375例胃癌组织和32例癌旁非癌胃组织中的表达水平差异。
1.3 细胞培养HGC-27细胞用含有10%胎牛血清的RPMI-1640培养基培养,而AGS和GES-1细胞用含有10%胎牛血清及100 μg/mL链霉素和100 U/mL青霉素的高糖DMEM培养基培养。在37 ℃和5%CO2的细胞培养箱中培养细胞,培养基每2~3 d更换1次。
1.4 RNA的提取和逆转录使用TRIzol试剂提取细胞总RNA,并使用分光光度计检测RNA的浓度和纯度。按照试剂盒说明书,使用TaKaRa反转录试剂盒对提取的总RNA进行逆转录,得到cDNA。
1.5 实时PCR检测按照TaKaRa试剂说明书配置试剂混合物,采用TaKaRa实时荧光定量试剂盒对cDNA进行实时荧光定量检测。以GAPDH为内参,每个样品重复3次。之后读取Ct值,计算靶基因的表达量。lncRNA MCF2L-AS1与内参GAPDH的引物序列见表 1。
| Gene | Sequence(5’-3’) |
| MCF2L-AS1 | F: GATCAACGTTCAATCCACCG |
| R: CGTCAAGATAGCGCAGCTTCC | |
| GAPDH | F: CAGGAGGCATTGCTGATGAT |
| R: GAAGGCTGGGGCTCATTT | |
| si-MCF2L-AS1 #1 | Sense: UCCUUUUGUGGUUUGGUAUUAUATT |
| Antisense: UAUAAUACCAAACCACAAAAGGATT | |
| si-MCF2L-AS1 #2 | Sense: AGGUAACAUGCCCUUCCUUAAAGTT |
| Antisense: CUUUAAGGAAGGGCAUGUUACCUTT | |
| si-NC | Sense: UUCUCCGAACGUGUCACGUTT |
| Antisense: ACGUGACACGUUCGGAGAATT |
1.6 siRNA转染
针对MCF2L-AS1设计特异性siRNA(si-MCF2L-AS1 #1,si-MCF2L-AS1 #2)和阴性对照si-NC(表 1)。将处于对数生长期的细胞接种于培养板,融合> 50% 时根据试剂的转染操作说明进行操作,使用不含血清的培养基稀释siRNA和Lipofectamine 3000,静置5 min,混匀后再静置20 min。弃掉细胞瓶中原有培养基,并用不含血清的培养基洗2遍,之后加入siRNA和Lipofectamine 3000的混合液,将si-MCF2L-AS1 (#1,#2)与si-NC转染到HGC-27和AGS细胞中,4~6 h后更换含有血清的培养基,48 h后用实时PCR检测转染前后MCF2L-AS1的表达情况并进行进一步的实验。
1.7 CCK-8法检测细胞增殖情况取转染48 h后的细胞,计数并调整细胞悬液浓度,每孔加入100 μL细胞悬液,使每孔的细胞数为2 000,每个样品5个复孔,边缘孔加等量的无菌磷酸缓冲盐溶液(phosphate buffered saline,PBS),培养0、24、48、72 h后每孔加10 μL的CCK-8试剂,并继续在细胞培养箱中孵育2 h,用酶标仪测量各孔在450 nm处的光密度(optical density,OD)值。
1.8 Transwell法检测细胞迁移和侵袭能力取转染48 h后的细胞,将细胞用无血清培养基重悬,制成细胞悬液后调整细胞悬液浓度为1×105/mL,取200 μL的细胞悬液分别加入含基质胶和不含基质胶的小室内,使每个小室内含有20 000个细胞,在下室加入含10% 胎牛血清的培养基。温育48 h后,细胞迁移或侵袭至小室底部外表面,去除培养基后用PBS洗2遍,之后用多聚甲醛固定30 min,结晶紫染色15 min。晾干后在显微镜下随机选取6个视野计数并拍照。
1.9 基因富集分析利用TCGA和GO数据库预测与lncRNA MCF2L-AS1表达相关的mRNA,并进行基因富集分析。
1.10 统计学分析所有实验均重复进行3次,数据以x±s表示。采用SPSS 19.0软件进行统计学分析,采用成对t检验进行比较,P < 0.05为差异有统计学意义。
2 结果 2.1 lncRNA MCF2L-AS1在胃癌组织和细胞中高表达TCGA数据库的结果显示,375例胃癌组织中MCF2L-AS1的表达明显高于32例癌旁非癌胃组织,差异有统计学意义(P < 0.000 1,图 1A)。实时PCR结果显示,lncRNA MCF2L-AS1在HGC-27和AGS细胞中表达均明显高于GES-1细胞,差异有统计学意义(P < 0.05),见图 1B。
|
| A, MCF2L-AS1 is highly expressed in gastric cancer tissues; B, expression of MCF2L-AS1 between HGC-27 and AGS in gastric cancer cells and GES-1 in non-cancerous gastric cells. *P < 0.05. 图 1 lncRNA MCF2L-AS1在胃癌组织与细胞中的表达情况 Fig.1 Expression of long noncoding RNA MCF2L-AS1 in gastric cancer |
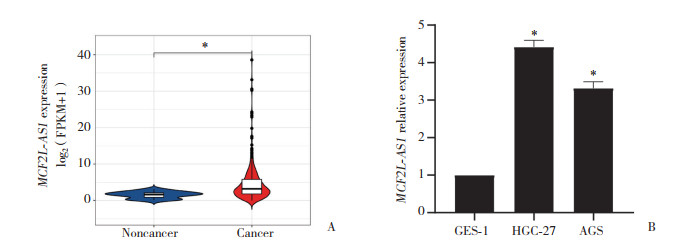
2.2 敲低MCF2L-AS1抑制HGC-27和AGS细胞的增殖迁移和侵袭
在HGC-27和AGS细胞中敲低MCF2L-AS1,实时PCR结果显示,si-MCF2L-AS1 #2敲低的效果更明显(图 2A)。因此后续研究采用si-MCF2L-AS1 #2作为敲低MCF2L-AS1的siRNA。

|
| A, real-time PCR; B, CCK-8;C, Transwell×100;D, statistical analysis of Transwell data. * P < 0.05. 图 2 敲低胃癌细胞中长链非编码RNA MCF2L-AS1对胃癌细胞增殖侵袭和迁移能力的影响 Fig.2 The effect of MCF2L-AS1 knockdown on the proliferation, invasion, and migration of gastric cancer cells |
CCK-8法检测MCF2L-AS1对HGC-27和AGS细胞增殖的影响。结果显示,与对照组相比,MCF2L-AS1敲低后的HGC-27和AGS细胞增殖能力下降(P < 0.05),见图 2B。
Transwell方法检测MCF2L-AS1对HGC-27和AGS细胞迁移和侵袭能力的影响。结果显示,与对照组相比,MCF2L-AS1敲低后HGC-27和AGS细胞迁移和侵袭能力均下降(P均 < 0.05),见图 2C、2D。
2.3 MCF2L-AS1与细胞周期等生物学过程密切相关利用TCGA和GO数据库预测了与MCF2L-AS1相关的mRNA,并通过富集分析发现MCF2L-AS1可能与细胞周期、微管细胞骨架组织、减数分裂的细胞周期和有丝分裂激酶B通路等密切相关,见图 3。
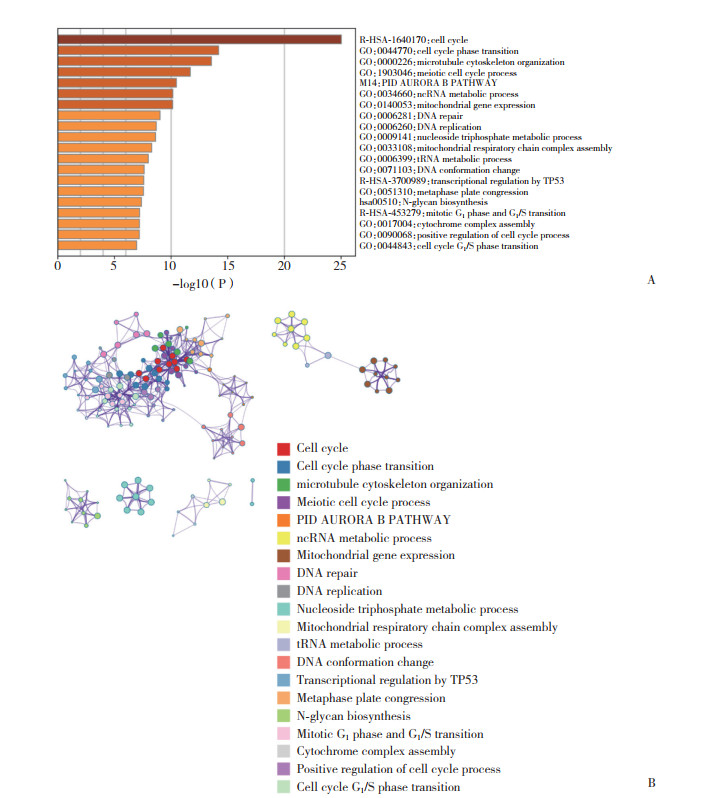
|
| A, MCF2L-AS1 may be closely related to cell cycle and microtubule cytoskeleton organization (Heatmap); B, MCF2L-AS1 may be closely related to cell cycle and microtubule cytoskeleton organization (Cluster). 图 3 与MCF2L-AS1相关的mRNA功能富集分析结果 Fig.3 Enrichment analysis results of mRNA associated with MCF2L-AS1 |
3 讨论
在过去的几十年中,尽管胃癌的诊断和治疗方法取得了显著进展,但由于癌症的复发和转移,全球胃癌患者的5年生存率仍然很低[5-6]。因此,详细研究胃癌发生发展的分子机制对于寻找治疗胃癌的新靶点和新策略至关重要。
lncRNA是一类RNA分子,其转录本 > 200个核苷酸。它们被RNA聚合酶Ⅱ转录,优先定位于细胞核中,调节顺式或反式基因的表达。而且,具有类似于mRNA共有序列的3’切割和聚腺苷酸化特征的lncRNA可以输出至细胞质执行细胞质功能[7]。在人类基因组中,lncRNA作为常见的表观遗传调控分子,在表观遗传学中发挥重要作用,并参与转录调控,包括RNA剪切和修饰、mRNA稳定和翻译、蛋白质稳定和运输、染色体形成和结构稳定性[9-10]。它们参与调节胚胎发育,组织分化,器官形成以及某些疾病的发生和发展[11-12]。lncRNA的失调可通过调节增殖、侵袭和转移来促进肿瘤发生并促进癌症的发展[13-14]。许多研究[17-18]表明,lncRNA在胃癌发生发展的复杂机制中发挥着不可或缺的作用[19-21]。
MCF2L基因编码一个鸟嘌呤核苷酸交换因子,与三磷酸鸟苷(guanosine triphosphate,GTP)结合的Rac1可与该因子特异性相互作用,并在Rho / Rac信号通路中起作用[15]。MCF2L反义RNA 1(MCF2L-AS1)是最近新发现的lncRNA。CHEN等[16]发现MCF2L-AS1能控制成骨分化,HUANG等[22]和ZHANG等[23]发现MCF2L-AS1在结直肠癌中过表达,并且促进结直肠癌的增殖侵袭和迁移。本研究探讨了MCF2L-AS1在胃癌中的表达情况,并分析了MCF2L-AS1在胃癌中的潜在作用。生物信息学分析结果显示,MCF2L-AS1在胃癌组织中的表达显著上调,实时PCR检测结果显示,在HGC-27和AGS细胞中发现MCF2L-AS1的表达水平的确明显高于非癌胃细胞GES-1。敲低MCF2L-AS1后,CCK-8实验发现胃癌细胞的增值能力明显减弱。进而通过transwell实验发现,敲低MCF2L-AS1后,胃癌细胞的侵袭和迁移能力也受到抑制。最后,采用TCGA和GO数据库对MCF2L-AS1相关的mRNA进行了富集分析,发现其可能与细胞周期等生物学过程密切相关。因此,推测lncRNA MCF2L-AS1在胃癌中过表达,并且这种过表达促进了胃癌的增殖侵袭和迁移。然而,MCF2L-AS1在胃癌中发挥作用的具体分子机制以及MCF2L-AS1所涉及的信号通路还有待进一步研究。
综上所述,本研究证实了MCF2L-AS1在胃癌中过表达,而且MCF2L-AS1通过促进胃癌的增殖、侵袭和迁移在胃癌中发挥促癌作用。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018:globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
PLUMMER M, FRANCESCHI S, VIGNAT J, et al. Global burden of gastric cancer attributable to helicobacter pylori[J]. Int J Cancer, 2015, 136(2): 487-490. DOI:10.1002/ijc.28999 |
| [3] |
SECRETAN B, STRAIF K, BAAN R, et al. A review of human carcinogens——part E: tobacco, areca nut, alcohol, coal smoke, and salted fis[J]. Lancet Oncol, 2009, 10(11): 1033-1034. DOI:10.1016/s1470-2045(09)70326-2 |
| [4] |
ZHANG J, LIU H, HOU L, et al. Circular RNA_LARP4 inhibits cell proliferation and invasion of gastric cancer by sponging miR-424-5p and regulating LATS1 expression[J]. Mol Cancer, 2017, 16(1): 151. DOI:10.1186/s12943-017-0719-3 |
| [5] |
AJANI JA, LEE J, SANO T, et al. Gastric adenocarcinoma[J]. Nat Rev Dis Primers, 2017, 3: 17036. DOI:10.1038/nrdp.2017.36 |
| [6] |
ALLEMANI C, WEIR HK, CARREIRA H, et al. Global surveillance of cancer survival 1995-2009:analysis of individual data for 25, 676, 887 patients from 279 population-based registries in 67 countries (CONCORD-2[J]. Lancet, 2015, 385(9972): 977-1010. DOI:10.1016/s0140-6736(14)62038-9 |
| [7] |
GOODALL GJ, WICKRAMASINGHE VO. RNA in cancer[J]. Nat Rev Cancer, 2021, 21(1): 22-36. DOI:10.1038/s41568-020-00306-0 |
| [8] |
KOPP F, MENDELL JT. Functional classification and experimental dissection of long noncoding RNAs[J]. Cell, 2018, 172(3): 393-407. DOI:10.1016/j.cell.2018.01.011 |
| [9] |
SUN Q, HAO Q, PRASANTH KV. Nuclear long noncoding RNAs: key regulators of gene expression[J]. Trends Genet, 2018, 34(2): 142-157. DOI:10.1016/j.tig.2017.11.005 |
| [10] |
QUINN JJ, CHANG HY. Unique features of long non-coding RNA biogenesis and function[J]. Nat Rev Genet, 2016, 17(1): 47-62. DOI:10.1038/nrg.2015.10 |
| [11] |
DEY BK, MUELLER AC, DUTTA A. Long non-coding RNAs as emerging regulators of differentiation, development, and disease[J]. Transcription, 2014, 5(4): e944014. DOI:10.4161/21541272.2014.944014 |
| [12] |
FERNANDES J, ACUÑA S, AOKI J, et al. Long non-coding RNAs in the regulation of gene expression: physiology and disease[J]. NcRNA, 2019, 5(1): 17. DOI:10.3390/ncrna5010017 |
| [13] |
PRENSNER JR, CHINNAIYAN AM. The emergence of lncRNAs in cancer biology[J]. Cancer Discov, 2011, 1(5): 391-407. DOI:10.1158/2159-8290.cd-11-0209 |
| [14] |
GUTSCHNER T, DIEDERICHS S. The hallmarks of cancer: a long non-coding RNA point of view[J]. RNA Biol, 2012, 9(6): 703-719. DOI:10.4161/rna.20481 |
| [15] |
DAY-WILLIAMS AG, SOUTHAM L, PANOUTSOPOULOU K, et al. A variant in MCF2L is associated with osteoarthritis[J]. Am J Hum Genet, 2011, 89(3): 446-450. DOI:10.1016/j.ajhg.2011.08.001 |
| [16] |
CHEN Q, WANG M, WU S. The lncRNA MCF2L-AS1 controls osteogenic differentiation by regulating miR-33a[J]. Cell Cycle, 2020, 19(9): 1059-1065. DOI:10.1080/15384101.2020.1747776 |
| [17] |
LIANG Y, ZHANG CD, ZHANG C, et al. DLX6-AS1/miR-204-5p/OCT1 positive feedback loop promotes tumor progression and epithelial-mesenchymal transition in gastric cancer[J]. Gastric Cancer, 2020, 23(2): 212-227. DOI:10.1007/s10120-019-01002-1 |
| [18] |
ZHANG C, ZOU Y, DAI DQ. Downregulation of microRNA-27b-3p via aberrant DNA methylation contributes to malignant behavior of gastric cancer cells by targeting GSPT1[J]. Biomed Pharmacother, 2019, 119: 109417. DOI:10.1016/j.biopha.2019.109417 |
| [19] |
LIU XH, SUN M, NIE FQ, et al. Lnc RNA HOTAIR functions as a competing endogenous RNA to regulate HER2 expression by sponging miR-331-3p in gastric cancer[J]. Mol Cancer, 2014, 13: 92. DOI:10.1186/1476-4598-13-92 |
| [20] |
SLACK FJ, CHINNAIYAN AM. The role of non-coding RNAs in oncology[J]. Cell, 2019, 179(5): 1033-1055. DOI:10.1016/j.cell.2019.10.017 |
| [21] |
ANASTASIADOU E, JACOB LS, SLACK FJ. Non-coding RNA networks in cancer[J]. Nat Rev Cancer, 2018, 18(1): 5-18. DOI:10.1038/nrc.2017.99 |
| [22] |
HUANG FK, ZHENG CY, HUANG LK, et al. Long non-coding RNA MCF2L-AS1 promotes the aggressiveness of colorectal cancer by sponging miR-874-3p and thereby up-regulating CCNE1[J]. J Gene Med, 2021, 23(1): e3285. DOI:10.1002/jgm.3285 |
| [23] |
ZHANG Z, YANG W, LI N, et al. LncRNA MCF2L-AS1 aggravates proliferation, invasion and glycolysis of colorectal cancer cells via the crosstalk with miR-874-3p/FOXM1 signaling axis[J]. Carcinogenesis, 2021, 42(2): 263-271. DOI:10.1093/carcin/bgaa093 |
 2022, Vol. 51
2022, Vol. 51