文章信息
- 王韫文, 赵敏
- WANG Yunwen, ZHAO Min
- 71例急性敌草快中毒患者死亡危险因素分析
- Analysis of risk factors for death in 71 cases of diquat poisoning
- 中国医科大学学报, 2022, 51(3): 203-208
- Journal of China Medical University, 2022, 51(3): 203-208
-
文章历史
- 收稿日期:2021-03-11
- 网络出版时间:2022-01-13 11:20
敌草快(diquat,DQ),化学名称为1,1’-亚乙基-2,2’-联吡啶二溴盐,是全球第三大灭生性除草剂,与百草枯(paraquat,PQ)同属一类,均为联吡啶类除草剂。因PQ水溶剂对人畜均有较强毒性,2016年7月1日起国内已全面停止销售和使用[1]。随着DQ逐渐广泛应用于农业生产中,其中毒人数较前明显增多。
DQ中毒病死率高,且目前暂无特效治疗方法,已成为现代中毒治疗学的研究热点之一。DQ中毒患者大多死于多器官衰竭,尤以肾脏衰竭为主。目前国内外缺乏针对DQ中毒患者进行的较大样本的系统临床特征分析。
本研究收集了2015年6月至2020年9月共5年期间我院急诊科接诊的71例DQ中毒患者的临床资料,系统调查并分析了临床特征与死亡危险因素,旨在为临床上早期识别危重症患者、防治急性DQ中毒提供依据。
1 材料与方法 1.1 研究对象2015年6月至2020年9月中国医科大学附属盛京医院急诊科共收治急性DQ中毒患者80例,收集其临床资料。纳入标准:急性DQ中毒,服毒至就诊时间≤72 h。排除标准:既往有呼吸系统、心脏、肝脏或肾脏疾病者;未能完整提供一般信息和临床资料者;患者本人拒绝救治,自行签字离院者。
依据排除标准排除无法提供服药时间患者3例,既往肾功能不全患者3例,既往肝功能不全患者2例,既往慢性阻塞性肺疾病患者1例,余71例患者纳入研究。
71例患者中,男31例,女40例,年龄17~65岁,平均(41.25±15.78)岁。来院时服药时间1.5~72 h,平均(13.19±10.25)h。患者所服DQ为20%水溶剂,服药量3~400 mL。
1.2 方法患者入院后立即采用碳酸氢钠/连二亚硫酸盐法检测尿液DQ浓度[2]。留取患者尿液10 mL,先后加入碳酸氢钠粉末(2 mg)和连二亚硫酸氢钠粉末(50 mg),充分摇匀,即刻比对半定量比色卡。DQ与连二亚硫酸盐反应产生颜色变化,呈黄绿色,而PQ则呈蓝紫色变化。颜色越深,表示尿中DQ浓度越高,见图 1。

|
| 图 1 尿敌草快浓度判定标准 Fig.1 Determination standard of the urine diquat concentration |
患者入院后均立即完善相关实验室检查,包括血细胞分析、肝功能、肾功能、肌钙蛋白、凝血五项、乳酸、血气分析等。
对所有患者均给予补液、抗炎、利尿,保护胃肠道黏膜,大剂量糖皮质激素冲击,保护重要脏器及营养支持治疗等。第一时间对未洗胃患者行洗胃及导泻治疗。同时尽早行血液灌流治疗,应用血液灌流器(330-Ⅱ,珠海健帆生物科技股份有限公司),当日灌流4罐(2 h/罐),次日灌流3罐,连用2 d,并在每日灌流结束后对患者尿液DQ浓度进行监测。
本研究为回顾性调查研究。统计患者的年龄、性别、服药剂量、服药至来院时间,以及入院后实验室检查结果等,并计算患者的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)评分、序贯器官衰竭评分(sequential organ failure assessment,SOFA)、急性生理与慢性健康评估(acute physiology and chronic health evaluation,APACHEⅡ)评分。
分别于患者出院后1个月和2个月时进行电话随访,以了解其生存及出院后状况。依据在院情况及随访期间是否死亡,将患者分为存活组(n = 46)和死亡组(n = 25),比较2组的一般资料、炎症程度及脏器功能等。
1.3 统计学分析采用SPSS 22.0软件进行统计分析。符合正态分布的计量资料以x±s表示,采用独立样本t检验进行组间比较;不符合正态分布者以M(P25~P75)表示,采用两独立样本的Mann-Whitney U检验比较。计数资料组间比较采用χ2检验。单因素分析采用二元logistic回归模型。诊断价值应用受试者操作特征(receiver operating characteristic,ROC)曲线及曲线下面积(area under carve,AUC)描述及比较,分析最佳截断值及指标的预测效能。P < 0.05为差异有统计学意义。
2 结果 2.1 2组患者临床资料比较 2.1.1 性别、年龄及服药时间2组患者性别、年龄、服药时间比较,差异无统计学意义(P > 0.05),见表 1。
| Item | Survival group(n = 46) | Death group(n = 25) | P |
| Gender(male/female) | 21/25 | 10/15 | 0.110 |
| Age(x±s,year) | 40.24±13.89 | 43.60±14.79 | 0.345 |
| Time(x±s,h) | 8.94±2.87 | 10.08±5.17 | 0.669 |
2.1.2 服药剂量与尿液DQ浓度
存活组患者服药剂量与尿液DQ浓度均低于与死亡组[20(10~80)mL vs 120(100~150)mL;(1.48±0.91)μg/L vs(3.00±1.18)μg/L],差异均有统计学意义(P < 0.01)。
结果还显示,服药剂量≤10 mL的21例患者经治疗后全部存活,存活率100%;> 100 mL的17例患者中,仅3例经救治后存活,存活率17%。提示随着服药剂量的增加,死亡率逐渐增高,救治存活率明显降低,见表 2。本研究还发现,随着尿液中DQ浓度的升高,患者的死亡率明显增加,见表 3。
| Toxic dose(mL) | Survival group[n(%)] | Death group[n(%)] | Total |
| ≤10 | 21(100.0) | 0(0) | 21 |
| > 10-30 | 7(87.5) | 1(12.5) | 8 |
| > 30-60 | 9(75.0) | 3(25.0) | 12 |
| > 60-100 | 6(46.1) | 7(53.9) | 13 |
| > 100 | 3(17.6) | 14(82.4) | 17 |
| Urine diquat concentration(μg/L) | Survival group[n(%)] | Death group[n(%)] | Total |
| < 3 | 4(100.0) | 0(0) | 4 |
| 3- < 10 | 23(95.8) | 1(4.2) | 24 |
| 10- < 30 | 7(58.3) | 5(41.7) | 12 |
| 30- < 100 | 8(47.1) | 9(52.9) | 17 |
| ≥100 | 3(23.1) | 10(76.9) | 13 |
2.1.3 实验室检查结果
存活组和死亡组患者的白细胞计数、谷丙转氨酶、凝血酶原时间、D-二聚体、肌钙蛋白Ⅰ、动脉氧分压、动脉二氧化碳分压、实际碳酸氢根、碱剩余、乳酸无统计学差异(P > 0.05)。存活组患者的血清肌酐(serum creatinine,Scr)、尿素和谷草转氨酶值低于死亡组,差异有统计学意义(P < 0.05),见表 4。
| Item | Survival group(n = 46) | Death group(n = 46) | P |
| Scr(μmol/L) | 62.8(49.2-84.0) | 223.1(124.2-341.5) | 0.006 |
| Urea(mmol/L) | 4.8(2.8-7.8) | 19.5(9.7-28.6) | 0.045 |
| AST(U/L) | 25.0(18.0-47.0) | 161.0(45.5-312.5) | 0.003 |
| WBC(×109/L) | 11.1(9.2-17.7) | 18.4(9.8-22.8) | 0.071 |
| ALT(U/L) | 40.0(25.0-82.3) | 85.0(48.5-192.0) | 0.061 |
| TnI(μg/L) | 0.01(0.01-0.01) | 0.01(0.01-0.01) | 0.765 |
| PT(s) | 11.9(11.0-12.7) | 12.0(11.3-15.2) | 0.108 |
| DD(μg/L) | 187.5(99.8-397.5) | 263.0(164.5-406.0) | 0.076 |
| PaO2(mmHg) | 97.0(91.0-105.5) | 97.0(91.5-105.5) | 0.990 |
| PaCO2(mmHg) | 34.03±4.67 | 32.67±5.50 | 0.276 |
| cHCO3-(mmol/L) | 23.0(20.8-24.2) | 22.6(16.6-23.9) | 0.193 |
| BE(mmol/L) | -0.7(-2.9-0.6) | -0.8(-5.9-0.2) | 0.286 |
| Lac(mmol/L) | 1.8(1.3-2.7) | 2.4(1.5-3.3) | 0.204 |
| Scr,serum creatinine;AST,aspartate transaminase;WBC,white blood cell;ALT,alanine transaminase;TnⅠ,troponin Ⅰ;PT,prothrormbin time;DD,d-dimer;BE,base excess;Lac,lactic acid. | |||
2.1.4 SIRS评分、SOFA评分及APACHEⅡ评分
患者入院后依据生命体征与实验室结果进行SIRS、SOFA、APACHEⅡ评分并比较。结果如表 5所示,存活组SIRS评分和APACHEⅡ评分均低于死亡组,差异有统计学意义(P < 0.01),但2组SOFA评分比较,差异无统计学意义(P > 0.05)。
| Item | Survival group(n = 46) | Death group(n = 25) | P |
| SIRS score | 2.0(1.0-3.0) | 3.0(2.0-4.0) | < 0.01 |
| SOFA score | 2.0(1.0-2.0) | 2.0(2.0-3.0) | > 0.05 |
| APACHEⅡ score | 2.0(2.0-4.0) | 7.0(6.0-9.0) | < 0.01 |
2.2 急性DQ中毒死亡的独立危险因素分析
为剔除混杂因素影响,将上述单因素分析差异有统计学意义的各变量进一步纳入多元logistic回归方程进行分析。结果显示,服药剂量、尿液DQ浓度、Scr值及APACHEⅡ评分是急性DQ中毒死亡的独立危险因素,谷草转氨酶值、SIRS评分未纳入方程中,见表 6。
| Variable | B | SE | P | EXP(B) |
| Toxic doses | 0.026 | 0.014 | 0.048 | 1.026 |
| Urine diquat concentration | 1.303 | 0.615 | 0.034 | 3.682 |
| Scr | 0.009 | 0.004 | 0.042 | 1.009 |
| AST | 0.961 | 0.031 | 0.452 | 0.999 |
| APACHEⅡ score | 0.461 | 0.193 | 0.017 | 1.586 |
| SIRS score | 0.461 | 0.573 | 0.093 | 2.615 |
2.3 ROC曲线分析
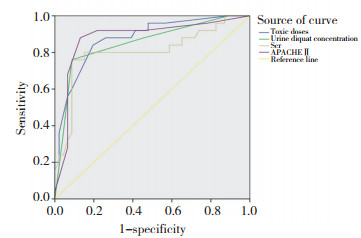
绘制ROC曲线并进行分析,结果如表 7、图 2所示,APACHEⅡ评分、Scr值、服药剂量与尿液DQ浓度预测急性DQ中毒死亡的ROC曲线下面积分别为0.879、0.804、0.877、0.853,APACHEⅡ评分预测DQ中毒死亡的AUC最大,对预后的判断优于其他指标。
| Indicator | AUC | Standard error | P | 95%CI | Youden index | Sensitivity | Specificity | PPV(%) | NPV(%) | Accuracy(%) |
| APACHEⅡ score | 0.879 | 0.049 | < 0.001 | 0.783-0.975 | 0.749 | 0.880 | 0.869 | 88 | 93 | 90 |
| Scr | 0.804 | 0.062 | < 0.001 | 0.683-0.925 | 0.652 | 0.761 | 0.891 | 79 | 87 | 84 |
| Toxic doses | 0.877 | 0.043 | < 0.001 | 0.792-0.962 | 0.673 | 0.760 | 0.913 | 71 | 88 | 86 |
| Urine diquat concentration | 0.853 | 0.051 | < 0.001 | 0.752-0.953 | 0.644 | 0.840 | 0.804 | 70 | 90 | 82 |
| PPV,positive predictive value;NPV,negative predictive value. | ||||||||||
|
| 图 2 预测死亡的ROC曲线图 Fig.2 ROC curve for predicting death |
3 讨论
作为PQ的有效替代品,近年来DQ逐步广泛应用于农业生产中。研究[3]表明,DQ的利用率和药效与PQ相当,且比PQ更环保。DQ中毒病例在临床工作中也越来越常见。目前,关于DQ中毒的流行病学、毒代动力学、临床诊治方面的相关报道[4]较少,缺乏相对大样本数据的研究。大多数DQ中毒患者为故意摄入浓缩DQ液体制剂,导致肝、肾、心脏和胃肠道并发症,进而危及生命。另外,DQ也可通过接触肺、眼或皮肤途径产生毒性反应。DQ在胃肠道的吸收较差(10%)[5],且由于食物和肠道微生物可对DQ起降解作用,使胃肠道的吸收进一步减少。DQ具有亲水的特性,因此在肺部和皮肤的吸收比并不高[6]。目前的研究[7-8]认为DQ的主要中毒机制与氧化还原反应有关,即通过产生活性氧自由基和活性氮自由基,引起氧化应激,从而导致细胞死亡。
DQ中毒起病急,且无特效解毒剂,第一时间准确判断患者的病情对于中毒的救治非常重要。本研究通过回顾性研究2015年至2020年在中国医科大学附属盛京医院就诊的71例DQ患者的临床资料,探讨了中毒死亡的相关危险因素。结果发现,患者服用中毒药物剂量越多,尿中DQ浓度越高,预后越差。然而在实际临床工作中,部分患者由于表述障碍,隐瞒病情或意识不清等原因,无法阐述确切的服药剂量,因而单凭服药剂量判断患者病情及预后并不完全准确。DQ中毒患者大多来自农村,由于条件所限,通常难以检测尿液DQ浓度,而且由于DQ中毒患者早期易伴有肾功能异常,发生排尿困难或无尿,导致延误诊治。
本研究中,首次将APACHEⅡ评分引入对DQ中毒患者预后判断的分析。APACHEⅡ评分是目前临床重症监护病房应用最广泛、最具权威的危重病情评价系统,对评估重症患者的病情并预测其病死率有重要意义[9]。已有文献[10]报道了APACHEⅡ评分对PQ中毒患者预后的临床价值,但目前国内尚无关于该评价系统用于DQ中毒患者的研究。本研究通过分析DQ中毒患者APACHEⅡ评分与预后的相关性,发现APACHEⅡ评分越高,患者的预后越差。另外,本研究通过对DQ中毒患者进行SIRS评分与SOFA评分,发现生存组与死亡组DQ中毒患者的SIRS评分有统计学差异(P < 0.05),提示炎症反应重的患者预后差。而生存组与死亡组SOFA评分无统计学差异,可能是由于DQ中毒患者大多于服药后短时间内来诊,多器官衰竭尚未完全出现。
本研究还分析了DQ中毒患者的一般资料与生化指标,发现Scr、谷草转氨酶的升高会显著增加DQ中毒患者的死亡风险。这是由于DQ中毒可致多器官功能损害,对肾脏及肝脏的损害尤为突出,这与DQ主要蓄积在肾脏及肝脏并从肾脏排泄有关[2]。DQ在肾脏主要蓄积于远端肾小管上皮细胞和集合管[11]。DQ中毒可造成少尿、无尿、蛋白尿、血尿、脓尿、氮质血症、急性肾功能衰竭、急性肾小管坏死等肾脏损害。研究[12]发现,DQ分子在结构上与强效肾毒素奥莱毒素相似,它对肾脏的损害可能与此有关。DQ中毒早期死亡患者多伴有肾功能异常,且肾损伤早于肺损伤出现。Scr值是目前急性肾损伤的重要检测指标之一[13],可反映肾脏的损伤程度,推断DQ中毒的严重程度。因而,早期检测Scr值并根据结果保护肾功能尤为重要。DQ中毒对肝脏的损害[7]可能是由于DQ显著增加了氧合谷胱甘肽的合成,并加剧其胆道排泄,产生氧化应激,损伤肝细胞[14-15]。谷草转氨酶是检测急性肝损伤的重要指标,血谷草转氨酶水平和肝功能的损伤程度具有高度相关性。因此,入院后检测血谷草转氨酶值有助于判断DQ中毒的严重程度及预后。
本研究为单中心回顾性分析,样本量相对较少,尤其是死亡组病例数相对较少,可能导致一定的偏倚,今后需要进行多中心及大样本研究,以进一步证实结论。
综上所述,本研究发现APACHEⅡ评分、Scr值、尿液DQ浓度与服药剂量是影响急性DQ中毒患者死亡的独立危险因素。临床工作中,应在患者就诊时尽早询问病史,加强实验室检查监测,以最大程度减少危重并发症及死亡的发生。
| [1] |
中华人民共和国农业部种植业管理司. 农业部、工业和信息化部、国家质量监督检验检疫总局公告第1745号[EB/OL]. (2012-04-24)[2017-05-07]. http://www.moa.gov.cn/govpublic/ZZYGLS/201204/t20120427_2613538.htm.
|
| [2] |
VOHRA R, SALAZAR A, CANTRELL FL, et al. The poison pen: bedside diagnosis of urinary diquat[J]. J Med Toxicol, 2010, 6(1): 35-36. DOI:10.1007/s13181-010-0033-6 |
| [3] |
HE YQ, CHENG JP, LIU LF, et al. Effects of pre-harvest chemical application on rice desiccation and seed quality[J]. J Zhejiang Univ Sci B, 2015, 16(10): 813-823. DOI:10.1631/jzus.b1500032 |
| [4] |
急性敌草快中毒诊断与治疗专家共识组. 急性敌草快中毒诊断与治疗专家共识[J]. 中华急诊医学杂志, 2020, 29(10): 1282-1289. DOI:10.3760/cma.j.issn.1671-0282.2020.10.002 |
| [5] |
BALDWIN RC, PASI A, MACGREGOR JT, et al. The rates of radical formation from the dipyridylium herbicides paraquat, diquat, and morfamquat in homogenates of rat lung, kidney, and liver: an inhibitory effect of carbon monoxide[J]. Toxicol Appl Pharmacol, 1975, 32(2): 298-304. DOI:10.1016/0041-008X(75)90220-3 |
| [6] |
FELDMANN RJ, MAIBACH HI. Percutaneous penetration of some pesticides and herbicides in man[J]. Toxicol Appl Pharmacol, 1974, 28(1): 126-132. DOI:10.1016/0041-008x(74)90137-9 |
| [7] |
YIN J, LIU M, REN W, et al. Effects of dietary supplementation with glutamate and aspartate on diquat-induced oxidative stress in piglets[J]. PLoS One, 2015, 10(4): e0122893. DOI:10.1371/journal.pone.0122893 |
| [8] |
MAGALHÃES N, CARVALHO F, DINIS-OLIVEIRA RJ. Human and experimental toxicology of diquat poisoning: toxicokinetics, mechanisms of toxicity, clinical features, and treatment[J]. Hum Exp Toxicol, 2018, 37(11): 1131-1160. DOI:10.1177/0960327118765330 |
| [9] |
MOK SRS, MOHAN S, ELFANT AB, et al. The acute physiology and chronic health evaluationⅣ, a new scoring system for predicting mortality and complications of severe acute pancreatitis[J]. Pancreas, 2015, 44(8): 1314-1319. DOI:10.1097/mpa.0000000000000432 |
| [10] |
邓佩, 邱泽武, 彭晓波, 等. 急性百草枯中毒患者预后相关因素分析[J]. 临床急诊杂志, 2018, 19(5): 309-312. DOI:10.13201/j.issn.1009-5918.2018.05.008 |
| [11] |
WU B. Production of monoclonal antibody against diquat and its application for forensic medicine[J]. Nihon Hoigaku Zasshi, 1991, 45(5-6): 423-431. |
| [12] |
DINIS-OLIVEIRA RJ, SOARES M, ROCHA-PEREIRA C, et al. Human and experimental toxicology of orellanine[J]. Hum Exp Toxicol, 2016, 35(9): 1016-1029. DOI:10.1177/0960327115613845 |
| [13] |
吴煜峥, 菅向东, 王文君, 等. 敌草快毒理学研究进展[J]. 毒理学杂志, 2018, 32(5): 413-419. DOI:10.16421/j.cnki.1002-3127.2018.05.016 |
| [14] |
JONES GM, VALE JA. Mechanisms of toxicity, clinical features, and management of diquat poisoning: a review[J]. J Toxicol Clin Toxicol, 2000, 38(2): 123-128. DOI:10.1081/clt-100100926 |
| [15] |
WU KC, ZHANG Y, KLAASSEN CD. Nrf2 protects against diquat-induced liver and lung injury[J]. Free Radic Res, 2012, 46(10): 1220-1229. DOI:10.3109/10715762.2012.700709 |
 2022, Vol. 51
2022, Vol. 51