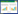文章信息
- 于昕博, 黄昌伟, 路天琦, 袁莹, 李晓东
- YU Xinbo, HUANG Changwei, LU Tianqi, YUAN Ying, LI Xiaodong
- PAK4与RCBTB1相互作用促进胰腺癌细胞增殖
- Interaction between PAK4 and RCBTB1 promotes the proliferation of pancreatic cancer cells
- 中国医科大学学报, 2022, 51(2): 115-120
- Journal of China Medical University, 2022, 51(2): 115-120
-
文章历史
- 收稿日期:2021-05-21
- 网络出版时间:2021-12-30 20:09
2. 中国医科大学生命科学学院分子细胞生物学教研室, 国家卫生健康委员会细胞生物学重点实验室暨教育部细胞生物学重点实验室, 沈阳 110122
2. Department of Cell Biology, School of Life Sciences, Key Laboratory of Cell Biology of National Health Commission, Key Laboratory of Medical Cell Biology of Ministry of Education, China Medical University, Shenyang 110122, China
胰腺癌恶性度极高,是常见的消化系统肿瘤之一。目前胰腺癌在中国发病率显著上升,已成为我国十大肿瘤之一[1]。然而,胰腺癌起病隐匿、预后极差,在我国高居肿瘤致死率第六位[2]。因此,对胰腺癌的研究更显迫切。p21激活激酶4 (p21-activated kinase 4,PAK4) 是PAK家族的Ⅱ类代表性成员,其羧基末端包含具有催化活性的丝/苏氨酸激酶域,通过结合和磷酸化下游靶蛋白,在多种信号通路中发挥重要作用[3]。PAK4在膀胱癌、骨肉瘤等多种肿瘤中存在基因扩增、蛋白过表达,被认为是肿瘤细胞信号转导的关键因子之一[4-5]。已有研究[6-8]显示,PAK4在正常胰腺组织中不表达或低表达,而在胰腺癌中过表达,参与细胞迁移、侵袭、耐药等过程,尤其在胰腺癌细胞的增殖中发挥重要作用。RCC1和BTB结构域包含蛋白1 (RCC1 and BTB domain containing protein 1,RCBTB1) 是一种细胞增殖相关蛋白,包括RCC1结构域和BTB结构域,其中RCC1结构域可发挥小G蛋白Ras相关核蛋白鸟嘌呤交换因子的作用,而BTB结构域则与蛋白相互作用有关[9]。近期研究[10]发现,RCBTB1刺激平滑肌肉瘤细胞体外有丝分裂和脂肪肉瘤细胞增殖,表现为促进细胞增殖的癌基因效应。本课题组前期研究通过质谱法筛选出PAK4互作蛋白RCC1。而RCBTB1包含RCC1结构域并促进细胞增殖,与前期研究[5, 11]报道的PAK4促进多种肿瘤细胞增殖的效应一致,提示PAK4可能通过与RCBTB1的RCC1结构域相互作用促进细胞增殖。本研究探讨了PAK4与RCBTB1的相互作用及其在胰腺癌细胞增殖过程中的作用和机制,以丰富PAK4在胰腺癌发生、发展过程中的作用,为研究胰腺癌细胞增殖机制提供新的基础。
1 材料与方法 1.1 细胞培养胰腺癌细胞株Panc-1由本实验室保存,细胞培养于含10%胎牛血清的DMEM培养液中,培养条件为37 ℃、5% CO2,实验选用对数生长期细胞。
1.2 主要试剂和仪器DMEM (美国Gibco公司);胎牛血清(中国Hyclone公司);引物(中国Invitrogen公司);限制性内切酶、电泳凝胶回收试剂盒(日本TaKaRa公司);质粒提取及纯化试剂盒(中国Promega公司);PAK4 (美国Proteintech公司);ECL发光试剂盒(中国Tanon公司);DAPI、碘化丙啶(美国Sigma-Aldrich公司);山羊血清(中国中杉金桥生物技术有限公司);CCK-8试剂盒(日本同仁化学研究所)。
1.3 实验方法 1.3.1 PCR及表达质粒构建PCR扩增体系包含1 mg/L DNA模板0.5 μL,5 U/μL Pyrobest DNA聚合酶0.125 μL,上下游引物各1.0 μL,2.5 mmol/L dNTP mixture 2.0 μL,10×PCR buffer 2.5 μL,重蒸馏水补至25 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性1 min,60 ℃退火1 min,72 ℃延伸2 min,30次循环;72 ℃延伸10 min。扩增结束后,进行琼脂糖凝胶电泳及成像分析。收集DNA;加入载体、DNA裂解酶、DNA连接酶构建表达质粒;收集表达质粒,酶切后琼脂糖凝胶电泳,验证质粒是否构建成功。
1.3.2 免疫共沉淀实验收集细胞、提取蛋白并测定浓度,将蛋白分为Input、IgG组和IP组。IgG组和IP组分别加入IgG及相应抗体,4 ℃孵育3 h,加入IP-beads,孵育过夜;500 g离心2 min,弃上清,RIPA细胞裂解液洗涤3次,10 min/次;吸干IP-beads,加入2×loading buffer,与Input一起煮沸变性,13 000 g离心2 min;取上清液,进行Western blotting检测。
1.3.3 免疫荧光实验细胞接种于12孔板;加入4%多聚甲醛固定20 min;PBST (Triton X-100溶于PBS) 透膜20 min;羊血清工作液封闭2 h;一抗孵育过夜;PBST (TWEEN-20溶于PBS) 洗涤3次,10 min/次;二抗避光孵育1 h;PBST洗涤3次,10 min/次;DAPI避光孵育15 min;PBST洗涤3次,10 min/次;封片,于激光共焦扫描显微镜下观察。
1.3.4 CCK-8实验胰酶消化细胞并重悬为1.5×104/mL浓度的细胞悬液;100 μL/孔接种到96孔板,培养过夜;每孔加入10 μL CCK-8溶液,37 ℃孵育2 h;使用超微量微孔板分光光度计在450 nm波长下测定每孔光密度值。
1.3.5 碘化丙啶染色和流式细胞术胰酶消化细胞并重悬为细胞悬液;加入5 mL 75%冷乙醇,4 ℃过夜;4 ℃、1 000 g离心5 min,弃乙醇;生理盐水(含1%牛血清蛋白) 洗涤2次,4 ℃、1 000 g离心5 min,弃上清;800 μL生理盐水重悬细胞;4 ℃、1 000 g离心5 min,弃上清;加入250 mL碘化丙啶溶液,4 ℃避光孵育30 min;采用流式细胞术对样品进行检测。
1.3.6 Western blotting收集细胞并提取蛋白;Bradford法蛋白定量;10% SDS-PAGE琼脂糖凝胶电泳分离20 μg总蛋白;湿转法将蛋白转移至PVDF膜上,4℃恒压过夜;5%脱脂奶粉封闭1 h;一抗孵育过夜;二抗孵育2 h;ECL显色拍照,GAPDH为内参。
1.4 统计学分析采用Graphpad Prism 8软件进行统计学分析,细胞增殖实验独立重复3次,结果取均值并进行t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 PCR获取RCBTB1基因编码区全长片段并构建表达质粒通过PCR获得RCBTB1基因编码区全长片段(1 595 bp),并成功插入pCDNA3.1-Flag载体。见图 1。
|
| A,the cDNA library obtained from reverse transcription of pancreatic cancer cells was amplified by PCR (M,marker;1-4,cDNA amplification);B,identification of recombinant RCBTB1 plasmid by digestion (M,marker;1,cDNA amplification;2,RCBTB1 fragment). 图 1 PCR扩增目的基因RCBTB1及其原核表达载体的构建 Fig.1 RCBTB1 of PCR amplified target gene and its prokaryotic expression vector |
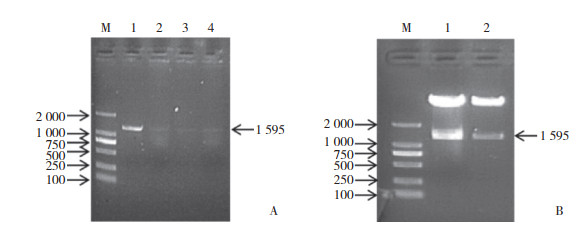
2.2 免疫共沉淀实验确定PAK4与RCBTB1在细胞内的相互作用
胰腺癌细胞Panc-1裂解后用PAK4抗体进行免疫沉淀(IgG为对照),之后分别用RCBTB1抗体与PAK4抗体检测沉淀物蛋白表达。结果表明,PAK4与RCBTB1在胰腺癌细胞内存在相互作用。见图 2。
|
| 图 2 PAK4与RCBTB1在胰腺癌细胞内的相互作用 Fig.2 Interaction of PAK4 and RCBTB1 in pancreatic cancer cells |
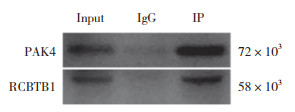
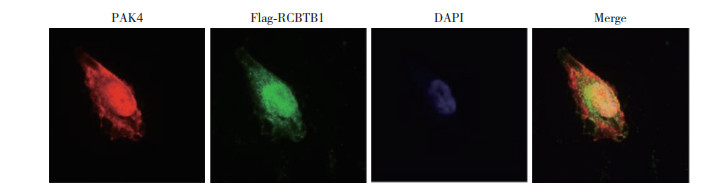
2.3 免疫荧光实验探究PAK4与RCBTB1的定位和共定位位置
在胰腺癌细胞中转染Flag-RCBTB1质粒,PAK4/Alexa-546、Flag/Alexa-488抗体免疫荧光处理后,在激光扫描共聚焦显微镜下观察。结果显示,PAK4 (红色) 与RCBTB1 (绿色) 在细胞核(DAPI,蓝色) 中以及核周胞质区域有显著共定位。见图 3。
|
| 图 3 PAK4与RCBTB1的定位和共定位位置 Fig.3 Localization and co-localization of PAK4 and RCBTB1 |
2.4 CCK-8实验探究过表达PAK4、RCBTB1对胰腺癌细胞增殖的影响
在胰腺癌细胞Panc-1中分别转染Flag-PAK4、Flag-RCBTB1、同时转染Flag-PAK4和Flag-RCBTB1 (单独转染Flag作为对照),CCK-8实验结果显示,过表达PAK4、过表达RCBTB1均促进细胞增殖,同时过表达PAK4和RCBTB1显著促进细胞增殖。在胰腺癌细胞Panc-1中转染si-PAK4 (si-Control作为对照),同时共转染Flag-RCBTB1,利用CCK-8试剂盒检测细胞增殖。结果表明,胰腺癌细胞沉默PAK4表达后,过表达RCBTB1不能促进细胞增殖。见图 4。表明PAK4通过与RCBTB1相互作用促进细胞增殖。
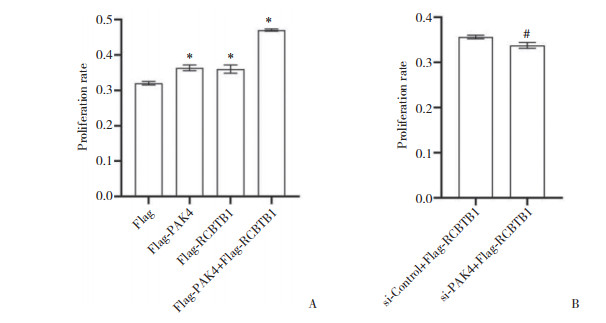
|
| A, determination of cell proliferation after overexpression of PAK4 or RCBTB1 and co-overexpression of PAK4 and RCBTB1;B, determination of proliferation of PAK4-silenced cell after overexpression of RCBTB1. * P < 0.05 vs Flag; # P < 0.05 vs si-Control+Flag-RCBTB1. 图 4 PAK4、RCBTB1过表达及两者同时过表达和沉默PAK4并过表达RCBTB1对细胞增殖的影响 Fig.4 Effects of overexpression of PAK4 or RCBTB1, co-overexpression of PAK4 and RCBTB1, and PAK4 silence and oveexpression of RCBTB1 on cell proliferation |
2.5 流式细胞术检测过表达PAK4、RCBTB1对胰腺癌细胞周期的影响
在胰腺癌细胞Panc-1中分别转染Flag-PAK4、Flag-RCBTB1,同时转染Flag-PAK4和Flag-RCBTB1 (单独转染Flag作为对照)。流式细胞术结果显示,转染Flag、Flag-PAK4、Flag-RCBTB1及同时转染Flag-PAK4和Flag-RCBTB1的细胞G0~G1期分别为73.36%、70.81%、70.85%、67.88%,S期分别为17.46%、20.00%、19.21%、27.27%,表明过表达PAK4、RCBTB1均促进细胞进入S期,同时过表达PAK4和RCBTB1显著促进细胞进入S期。在胰腺癌细胞Panc-1中转染si-PAK4 (si-Control作为对照),同时共转染Flag-RCBTB1。流式细胞术结果显示,共转染si-Control和Flag-RCBTB1、共转染si-PAK4和Flag-RCBTB1的细胞G0~G1期分别为70.44%、72.13%,S期分别为19.51%、18.54%,表明当胰腺癌细胞沉默PAK4表达后,过表达RCBTB1促进的细胞进入S期效果不明显。见图 5。
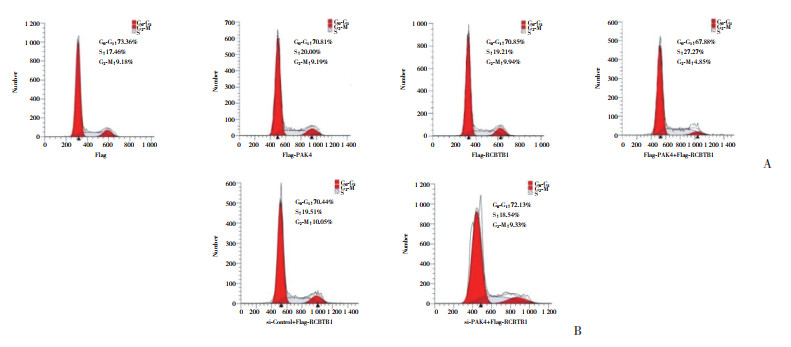
|
| A, determination of cell cycle after overexpression of PAK4 or RCBTB1 and co-overexpression of PAK4 and RCBTB1;B, determination of cell cycle of PAK4-silenced cell after overexpression of RCBTB1. 图 5 PAK4、RCBTB1过表达及二者同时过表达和沉默PAK4并过表达RCBTB1对细胞周期的影响 Fig.5 Effects of overexpression of PAK4 or RCBTB1, co-overexpression of PAK4 and RCBTB1, and PAK4 silence and overexpression of RCBTB1 on cell cycle |
2.6 Western blotting检测cyclin D1表达水平
在胰腺癌细胞Panc-1中分别转染Flag-PAK4、Flag-RCBTB1,同时转染Flag-PAK4和Flag-RCBTB1 (单独转染Flag作为对照)。Western blotting结果显示,过表达PAK4、过表达RCBTB1时cyclin D1表达均增加,同时过表达PAK4和RCBTB1时cyclin D1表达显著增加。在胰腺癌细胞Panc-1中转染si-PAK4 (si-Control作为对照),同时共转染Flag-RCBTB1。Western blotting结果显示,沉默PAK4和过表达RCBTB1时cyclin D1表达未增加。见图 6。表明PAK4通过与RCBTB1相互作用促进cyclin D1表达。
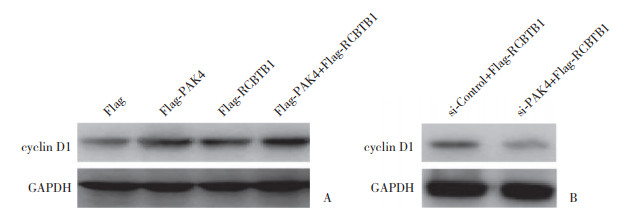
|
| A, determination of cyclin D1 expression after overexpression of PAK4 or RCBTB1 and co-overexpression of PAK4 and RCBTB1;B, determination of cyclin D1 expression of PAK4-silenced cell after overexpression of RCBTB1. 图 6 PAK4、RCBTB1过表达及二者同时过表达和沉默PAK4并过表达RCBTB1对cyclin D1表达的影响 Fig.6 Effects of overexpression of PAK4 or RCBTB1, co-overexpression of PAK4 and RCBTB1, and PAK4 silence and overexpression of RCBTB1 on expression of cyclin D1 |
3 讨论
胰腺癌恶性度高,早期确诊率极低,病程发展迅速,手术死亡率较高。研究[12]表明,胰腺癌患者5年生存率仅为9%,大部分患者初次诊断后生存期小于1年。
PAK4是关键的肿瘤细胞信号转导因子之一,在多种肿瘤的发生、发展过程中发挥重要作用。PAK4可通过激活蛋白激酶B/胞外信号调节蛋白激酶途径促进核因子κB的核积累和转录活性,从而促进胰腺癌细胞增殖[8]。RCBTB1是新发现的PAK4相互作用蛋白,已有证据表明其在肉瘤细胞增殖过程中发挥作用[10]。研究[13]报道,PAK4可介导纺锤体上Ras相关核蛋白依赖性复合物的装配,在细胞增殖过程中发挥重要作用。以上证据提示,PAK4与RCBTB1的相互作用可能在胰腺癌细胞增殖过程中发挥重要作用。
本研究采用免疫共沉淀实验证实了胰腺癌细胞内源表达的PAK4与RCBTB1的相互作用,免疫荧光实验结果表明二者在胰腺癌细胞核核周区域存在显著的共定位,以上均证实PAK4与RCBTB1在胰腺癌细胞内的相互作用。PAK4与RCBTB1明显共定位于细胞核和核周胞质中,且结合RCBTB1家族成员的生物学功能,提示两者可能对胰腺癌细胞有丝分裂和细胞周期进程产生影响。CCK-8实验结果显示,过表达PAK4或RCBTB1均可促进胰腺癌细胞增殖,两者同时过表达时促进作用更为显著;沉默PAK4表达后,RCBTB1促进增殖的作用消失,以上结果均表明两者的相互作用促进胰腺癌细胞增殖。在此基础上,本研究还检测了胰腺癌细胞周期及相关细胞周期因子的改变,发现无论是过表达PAK4还是RCBTB1,均可促进胰腺癌细胞S期的比例,且cyclin D1表达明显升高,当两者同时过表达时这种作用更为明显;而当沉默PAK4表达后,即便过表达RCBTB1,也不会促进胰腺癌细胞进入S期。
综上所述,本研究结果表明,PAK4与RCBTB1相互作用可以通过增加胰腺癌细胞cyclin D1表达,促进细胞进入S期,从而促进细胞增殖。本研究结果揭示了PAK4与RCBTB1的相互作用促进胰腺癌细胞增殖及可能的机制,为PAK4介导胰腺癌发生、发展提供了新的理论基础。
| [1] |
邹小农, 赵平. 中国癌症态势七十年分析[J]. 中国肿瘤临床与康复, 2019, 26(10): 1153-1161. DOI:10.13455/j.cnki.cjcor.2019.10.01 |
| [2] |
曹毛毛, 陈万青. 中国恶性肿瘤流行情况及防控现状[J]. 中国肿瘤临床, 2019, 16(3): 145-149. DOI:10.3969/j.issn.1000-8179.2019.03.246 |
| [3] |
RANE CK, MINDEN A. P21 activated kinase signaling in cancer[J]. Semin Cancer Biol, 2019, 54: 40-49. DOI:10.1016/j.semcancer.2018.01.006 |
| [4] |
CHANDRASHEKAR DS, CHAKRAVARTHI BVSK, ROBINSON AD, et al. Therapeutically actionable PAK4 is amplified, overexpressed, and involved in bladder cancer progression[J]. Oncogene, 2020, 39(20): 4077-4091. DOI:10.1038/s41388-020-1275-7 |
| [5] |
LI ZF, YAO YD, ZHAO YY, et al. Effects of PAK4/LIMK1/Cofilin-1 signaling pathway on proliferation, invasion, and migration of human osteosarcoma cells[J]. J Clin Lab Anal, 2020, 34(9): e23362. DOI:10.1002/jcla.23362 |
| [6] |
KING H, THILLAI K, WHALE A, et al. PAK4 interacts with p85 alpha: implications for pancreatic cancer cell migration[J]. Sci Rep, 2017, 7: 42575. DOI:10.1038/srep42575 |
| [7] |
MOHAMMAD RM, LI Y, MUQBIL I, et al. Targeting Rho GTPase effector p21 activated kinase 4(PAK4) suppresses p-Bad-microRNA drug resistance axis leading to inhibition of pancreatic ductal adenocarcinoma proliferation[J]. Small GTPases, 2019, 10(5): 367-377. DOI:10.1080/21541248.2017.1329694 |
| [8] |
TYAGI N, BHARDWAJ A, SINGH AP, et al. p-21 activated kinase 4 promotes proliferation and survival of pancreatic cancer cells through AKT-and ERK-dependent activation of NF-κB pathway[J]. Oncotarget, 2014, 5(18): 8778-8789. DOI:10.18632/oncotarget.2398 |
| [9] |
ZHOU X, MÜNGER K. Clld7, a candidate tumor suppressor on chromosome 13q14, regulates pathways of DNA damage/repair and apoptosis[J]. Cancer Res, 2010, 70(22): 9434-9443. DOI:10.1158/0008-5472.CAN-10-1960 |
| [10] |
MAUDUIT O, BRULARD C, LESLUYES T, et al. RCBTB1 deletion is associated with metastatic outcome and contributes to docetaxel resistance in nontranslocation-related pleomorphic sarcomas[J]. Cancers, 2019, 11(1): 81. DOI:10.3390/cancers11010081 |
| [11] |
WANG M, GAO Q, CHEN Y, et al. PAK4, a target of miR-9-5p, promotes cell proliferation and inhibits apoptosis in colorectal cancer[J]. Cell Mol Biol Lett, 2019, 24: 58. DOI:10.1186/s11658-019-0182-9 |
| [12] |
SIEGEL RL, MILLER KD, JEMAL A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [13] |
BOMPARD G, RABEHARIVELO G, FRANK M, et al. Subgroup ⅡPAK-mediated phosphorylation regulates Ran activity during mitosis[J]. J Cell Biol, 2010, 190(5): 807-822. DOI:10.1083/jcb.200912056 |
 2022, Vol. 51
2022, Vol. 51