文章信息
- 张舒蕾, 张丽艳, 李珍慧, 安一鸣, 高翔宇
- ZHANG Shulei, ZHANG Liyan, LI Zhenhui, AN Yiming, GAO Xiangyu
- 阿尔茨海默病小鼠模型中TRPC3通过上调ZO-1和LRP-1蛋白表达清除β淀粉样蛋白沉积
- TRPC3 cleared β-amyloid protein deposition by upregulating the expression of ZO-1 and LRP-1 proteins in a mouse model of Alzheimer disease
- 中国医科大学学报, 2022, 51(12): 1116-1120
- Journal of China Medical University, 2022, 51(12): 1116-1120
-
文章历史
- 收稿日期:2021-12-20
- 网络出版时间:2022-12-08 10:12:58
阿尔茨海默病(Alzheimer disease,AD)属于神经退行性疾病,临床上以认知功能障碍、人格改变和学习记忆能力进行性减退为主要表现。其发病机制复杂,相关学说众多,如β淀粉样蛋白(β-amyloid protein,Aβ)级联假说、血脑屏障(blood-brain barrier,BBB)受损学说、tau蛋白学说、氧化应激学说、胆碱能损伤学说、钙稳态失调假说等[1]。目前Aβ级联假说占主导地位,该学说认为Aβ在脑内异常沉积是引起患者认知功能障碍的主要原因。过多的Aβ引起神经原纤维缠结形成的同时还会激活小胶质细胞,影响突触功能,出现氧化应激和炎症反应等,这些反应又会进一步促进Aβ在脑内沉积,形成特殊的级联式放大效应[2]。
经典瞬时受体电位通道3(transient receptor potential canonical 3,TRPC3)是瞬时受体电位家族中的一个亚型,广泛表达于平滑肌细胞、内皮细胞和中枢神经系统中,特别是脑海马中。TRPC3主要通过调节钙离子稳态,维持细胞内、内质网和线粒体的钙离子水平,影响神经细胞结构和功能,调节神经元兴奋性和突触的控制[3]。本课题组前期研究[4]发现,AD模型中脑源性神经营养因子可通过上调TRPC3表达,减轻脑海马区的Aβ沉积,发挥神经营养作用,从而改善AD小鼠认知功能。Aβ的清除主要有经BBB转运出脑、细胞吞噬和Aβ降解酶降解3种途径[5]。研究[6]发现,正常生理状况下脑间质液中Aβ的浓度是血液中的6倍,通过BBB将Aβ转运至有强大清除能力的外周血液,是其最主要、最快速的清除路径。BBB对Aβ的高效转运性能主要与脑微血管内皮细胞表面存在的Aβ转运受体,如低密度脂蛋白受体相关蛋白1(low density lipoprotein receptor-related protein-1,LRP-1)、P糖蛋白(permeability glycoprotein,P-gp)、晚期糖基化终末产物受体(advanced glycation end product receptor,RAGE)等密切相关,同时还与血管壁完整性、配体亲和力和竞争力相关[7]。BBB功能障碍会影响Aβ的正常转运,从而导致Aβ沉积。同时,Aβ沉积会破坏脑微血管内皮细胞和紧密连接相关蛋白,导致BBB丧失完整性[8]。由此可见,BBB功能障碍和Aβ沉积可相互作用,共同促进疾病进展。本研究利用Aβ诱导AD小鼠模型,内源性激活和抑制TRPC3,通过检测小鼠的行为学改变、BBB通透性和功能变化、Aβ转运受体LRP-1表达情况、脑组织和血清中Aβ浓度,探讨TRPC3清除Aβ沉积的可能机制。
1 材料与方法 1.1 材料 1.1.1 实验动物和分组60只5周龄雄性费城癌症研究所小鼠(购自辽宁长生生物技术有限公司),体质量24~27 g,采用随机分组原则,分为假手术组、模型组、二酰基甘油类似物(1-oleoyl-2-acetyl-sn-glycerol,OAG)组、吡唑化合物[ethyl-1-(4-(2,3,3-trichloroacrylamide)phenyl)-5-(trifluoromethyl)-1H-pyrazole-4-carboxylate,Pyr3]组,每组15只。腹腔注射3.5%水合氯醛(0.1 mL/10 g)麻醉小鼠,模型组、OAG组和Pyr3组小鼠侧脑室注射Aβ1-42(410 pmol/3 μL),诱导AD小鼠模型,注射位置在脑中线向右1.1 mm、前囟后0.5 mm处,微量注射器注射深度3 mm,速度为0.6 μL/min,留针5 min。假手术组小鼠侧脑室注射等量灭菌生理盐水。同天,OAG组和Pyr3组小鼠分别腹腔注射TRPC3的特异性激动剂OAG(0.6 μg/g)和TRPC3的特异性抑制剂Pyr3(0.1 μg/g),1次/d,连续21 d,以上调和下调TRPC3的表达。
1.1.2 主要试剂Aβ1-42(英国Abcam公司);OAG、Pyr3(美国Cayman公司);紧密连接蛋白-1(zonula occluden-1,ZO-1)抗体(美国Affinity公司);鼠Aβ1-42蛋白抗体(英国Abcam公司);LRP-1蛋白抗体、β-actin小鼠单克隆抗体、羊抗兔IgG-HRP、羊抗小鼠IgG-HRP(中国Boster生物公司);伊文思蓝(Evans blue,EB,上海伊卡生物技术有限公司)。
1.2 方法 1.2.1 Morris水迷宫实验造模后第16天开始,持续6 d检测小鼠的学习和记忆能力。圆形水池等距离分为4个象限,装满黑色墨水,水温(25±1)℃。进行定位航行实验,在第3象限内设置1个圆形平台,隐藏在水位下约1 cm处,将小鼠面壁,于不同象限放入池内,记录小鼠上台时间,最长为60 s,若在60 s内未找到平台,则用木棒引导至平台上并停留5 s,3次/d。进行空间探索实验,将平台移走,记录小鼠在60 s内目标象限停留时间、穿越平台次数。
1.2.2 EB染色测定BBB通透性EB是一种经典的BBB示踪剂,可进行BBB通透性的定量、定性测定[9]。小鼠尾静脉注射2% EB(0.1 mL/10 g),2 h后染料在小鼠体内充分循环,小鼠眼周、鼻唇、四肢等浅表皮肤呈蓝色。水合氯醛麻醉小鼠,用肝素化生理盐水心脏灌流,直到小鼠右心房流出清亮透明液体。取脑组织,称重后置于3 mL甲酰胺中,60 ℃恒温水浴24 h,4 000 r/min离心15 min,取上清液比色,酶标仪检测波长为620 nm的吸光度。根据不同浓度标准品的吸光度绘制标准曲线,计算脑组织EB含量。
1.2.3 Western blotting检测ZO-1蛋白表达紧密连接受损时BBB通透性增加,ZO-1是目前公认的检测BBB通透性和功能的可靠指标[10]。小鼠末次给药2 h后取脑皮质,切碎均浆,10 000 r/min离心10 min后取上清液,进行蛋白浓度测定。蛋白缓冲液水浴变性后取30 μL上样于5% SDS-聚丙烯酰胺凝胶中,室温下垂直电泳2 h,转膜2 h,在摇床上封闭PVDF膜2 h,4 ℃下与ZO-1抗体(1∶1 000稀释)孵育过夜。第2天再与HRP-羊抗兔IgG(1∶5 000稀释)、HRP-羊抗鼠IgG(1∶5 000稀释)室温下孵育2 h,ECL显影,应用ImageJ软件分析蛋白条带灰度值。
1.2.4 Western blotting检测LRP-1蛋白表达LRP-1主要表达于脑微血管内皮细胞的腔外侧,是Aβ的主要转运受体,介导Aβ由脑内向血液流出过程[11]。取脑皮质,蛋白浓度测定同上。制备聚丙烯酰胺凝胶后每孔上样20 μL,室温下垂直电泳2 h,转膜2 h后浸入到5%(M/V)脱脂奶粉溶液中,摇床上封闭2 h,加入LRP-1抗体(1∶3 000稀释)4 ℃孵育过夜。第2天室温下与HRP-羊抗兔IgG(1∶2 000稀释)、HRP-羊抗鼠IgG(1∶1 500稀释)孵育2 h,ECL显影,应用ImageJ软件分析蛋白条带灰度值。
1.2.5 ELISA测定海马和血清Aβ1-42浓度小鼠末次给药2 h后断头取血,分离血清。取脑海马,匀浆,低温超速(10 000 r/min)离心10 min后得上清液,进行蛋白浓度测定。按ELISA试剂盒说明书操作,加入标准品、海马和血清稀释样品各100 μL,并加入HRP标记的Aβ1-42检测抗体4 ℃避光孵育过夜。第2天与TMB显色试剂混合15 min,加入终止液,可见溶液颜色从蓝色变为黄色。酶标仪在450 nm测量标准品、样本吸光度值,绘制标准曲线,计算样本的Aβ1-42浓度。
1.3 统计学分析采用Graphpad Prism 9软件进行统计学分析。数据以x±s表示,组间比较采用方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 上调TRPC3对AD小鼠空间学习和记忆能力有改善作用水迷宫定位航行实验发现,与假手术组比较,模型组第4天、第5天逃避潜伏期明显延长(P < 0.001);与模型组比较,OAG组第4天、第5天逃避潜伏期明显缩短(P < 0.05);Pyr3组与模型组比较,第4天、第5天逃避潜伏期无统计学差异(P > 0.05)。空间探索实验发现,与假手术组比较,模型组目标象限停留时间、穿越平台次数明显下降(P < 0.001);与模型组比较,OAG组目标象限停留时间、穿越平台次数明显增加(P < 0.05);Pyr3组与模型组比较,目标象限停留时间、穿越平台次数均无统计学差异(P > 0.05)。结果表明,AD造模成功,TRPC3激动剂对AD小鼠空间学习、记忆能力有改善作用,TRPC3抑制剂对AD小鼠行为学无明显作用。见表 1。
| Group | n | Escape latency(s) | Target quadrant occupancy(s) | Number of platform crossing | ||||
| 1 d | 2 d | 3 d | 4 d | 5 d | ||||
| Sham | 10 | 51.95±6.02 | 43.61±6.72 | 43.12±7.23 | 27.81±5.58 | 20.96±5.08 | 21.10±3.16 | 3.40±1.35 |
| Model | 10 | 59.12±2.21 | 53.04±5.92 | 49.10±11.53 | 45.58±9.821) | 38.19±8.211) | 14.32±3.471) | 1.30±0.821) |
| OAG | 10 | 52.90±5.97 | 49.32±7.76 | 44.34±10.46 | 36.94±7.932) | 30.27±6.622) | 18.22±3.612) | 2.50±1.352) |
| Pyr3 | 10 | 57.47±4.40 | 55.85±6.77 | 52.38±5.38 | 46.45±5.54 | 42.32±6.07 | 12.11±2.57 | 0.90±0.57 |
| 1)P < 0.001 vs sham group;2)P < 0.05 vs model group. | ||||||||
2.2 上调TRPC3能恢复AD小鼠BBB通透性
与假手术组比较,模型组脑组织EB含量增加(P < 0.05),BBB通透性增高;与模型组比较,OAG组脑组织EB含量减少(P < 0.05),BBB通透性下降;Pyr3组与模型组比较,脑组织EB含量无统计学差异(P > 0.05)。结果表明,TRPC3激动剂能恢复小鼠BBB通透性。见表 2。
| Group | EB content(μg/g)(n = 3) | ZO-1 protein level(n = 5) | LRP-1 protein level(n = 5) | Aβ1-42 concentration(n = 5) | |
| Hippocampus(pg/mg) | Serum(pg/mL) | ||||
| Sham | 9.278±1.420 | 0.780±0.150 | 1.027±0.092 | 172.03±23.393 | 185.22±13.078 |
| Model | 13.939±1.7861) | 0.463±0.0612) | 0.722±0.1072) | 231.67±25.1302) | 206.62±6.1001) |
| OAG | 10.365±1.1773) | 0.645±0.1633) | 0.866±0.0633) | 200.62±9.0073) | 220.36±9.4663) |
| Pyr3 | 14.894±1.886 | 0.394±0.105 | 0.555±0.157 | 260.47±41.486 | 191.34±5.9204) |
| 1)P < 0.05 vs sham group;2)P < 0.01 vs sham group;3)P < 0.05 vs model group;4)P < 0.01 vs model group. | |||||
2.3 上调TRPC3能够促进BBB紧密连接蛋白ZO-1的表达
与假手术组比较,模型组ZO-1表达下降(P < 0.01),表明BBB通透性增加、功能受损;与模型组比较,OAG组ZO-1表达增加(P < 0.05),表明受损的BBB通透性、功能有所恢复;Pyr3组与模型组比较,ZO-1表达无统计学差异(P > 0.05)。结果表明,TRPC3激动剂能恢复BBB通透性,改善受损的BBB功能。见表 2、图 1。
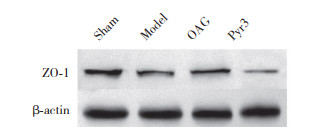
|
| 图 1 Western blotting检测各组小鼠ZO-1蛋白表达情况 Fig.1 Zonula occluden-1 protein expression in each group determined by Western blotting |
2.4 上调TRPC3能够促进Aβ转运受体LRP-1的表达
与假手术组比较,模型组LRP-1表达下降(P < 0.01);与模型组比较,OAG组LRP-1表达增加(P < 0.05);Pyr3组与模型组比较,LRP-1表达无统计学差异(P > 0.05)。结果表明,AD小鼠LRP-1表达下降,TRPC3激动剂能促进LRP-1的表达。见表 2、图 2。
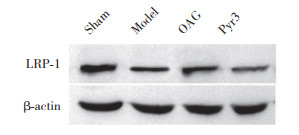
|
| 图 2 Western blotting检测各组小鼠LRP-1蛋白表达情况 Fig.2 Low density lipoprotein receptor-related protein-1 expression in each group determined by Western blotting |
2.5 上调TRPC3可促进脑组织的Aβ1-42向外周血转运
与假手术组比较,模型组小鼠海马和血清的Aβ1-42浓度均升高(P < 0.01,P < 0.05);与模型组比较,OAG组小鼠海马Aβ1-42浓度下降(P < 0.05),血清Aβ1-42浓度升高(P < 0.05);与模型组比较,Pyr3组小鼠海马Aβ1-42浓度无统计学差异(P > 0.05),血清Aβ1-42浓度下降(P < 0.01)。结果表明,上调TRPC3可减轻脑部Aβ1-42沉积,并促进其向外周血转运。见表 2。
3 讨论AD的病理特点为Aβ在脑内异常沉积形成老年斑,tau蛋白过度磷酸化形成神经元纤维缠结,海马等脑区突触和神经元大量丢失等[12]。Aβ由淀粉样前体蛋白产生,若出现代谢障碍,Aβ会沉积于脑并产生神经毒性,导致患者出现认知功能障碍。因此,找到减少脑部Aβ沉积的方法可能是治疗AD的关键。Aβ是一种极性、可溶性大分子物质,不能通过自由扩散方式在脑组织和外周血中转换。在Aβ的多种清除机制中,经BBB转运出脑是最主要的方式。大量研究表明,Aβ主要通过转运受体清除,如LRP-1、P-gp、RAGE等转运受体均高表达于脑微血管内皮细胞。研究[13-14]发现,AD中LRP-1表达降低;若抑制健康小鼠LRP-1的脑内表达,Aβ的外周转运率下降30%。脑微血管内皮细胞是BBB的重要组成成分,紧密连接使脑微血管内皮细胞形成连续的单层物理屏障,使跨细胞自由扩散受到抑制,同时还会调节离子、复合物在脑内流动。ZO-1是紧密连接蛋白中最主要的胞质蛋白,在许多神经功能障碍疾病中,ZO-1缺乏不仅直接影响紧密连接蛋白构成,其水平降低还是BBB损伤的重要标志。
本研究中,模型组EB含量增加,ZO-1、LRP-1表达下降,表明BBB受到破坏,BBB通透性增加,Aβ转运功能降低,Aβ清除不力,海马和血清的Aβ1-42浓度升高;而OAG组EB含量降低,ZO-1、LRP-1表达增加,表明在TPRC3激动剂的作用下,受损的BBB功能得到改善,BBB通透性降低,Aβ转运功能增强,海马Aβ1-42浓度降低,Aβ转运到周围血管,血清Aβ1-42浓度升高。
本课题组前期研究[14]发现,激活TRPC3表达可减轻脑部Aβ沉积,从而改善AD小鼠认知功能和突触功能障碍。本研究证明,TRPC3的激活表达,可能通过修复LRP-1等Aβ转运蛋白功能,加速Aβ清除,从而改善小鼠的认知功能。但尚不清楚TRPC3通过何种途径修复BBB及LRP-1等Aβ转运受体功能,需进行进一步实验探讨。
本研究中,给予TRPC3抑制剂后小鼠海马Aβ1-42浓度改变不明显。原因在于AD小鼠模型是通过侧脑室注射高浓度Aβ造模,即使Aβ转运功能受到抑制,海马Aβ浓度也不会有明显改变。但肝脏、肾脏等脏器对已通过BBB的Aβ有强大的清除能力,所以给予TRPC3抑制剂后,小鼠血清Aβ1-42浓度相对下降。
综上所述,本研究表明,激活TRPC3可恢复BBB功能,增加Aβ转运受体LRP-1蛋白表达,进而清除脑组织Aβ沉积,改善AD行为学症状。
| [1] |
KHAN S, BARVE KH, KUMAR MS. Recent advancements in pathogenesis, diagnostics and treatment of Alzheimer's disease[J]. Curr Neuropharmacol, 2020, 18(11): 1106-1125. DOI:10.2174/1570159X18666200528142429 |
| [2] |
QIANG W, YAU WM, LU JX, et al. Structural variation in amyloid-β fibrils from Alzheimer's disease clinical subtypes[J]. Nature, 2017, 541(7636): 217-221. DOI:10.1038/nature20814 |
| [3] |
CEDERHOLM JME, KIM Y, VON JONQUIERES G, et al. Human brain region-specific alternative splicing of TRPC3, the type 3 canonical transient receptor potential non-selective cation channel[J]. Cerebellum, 2019, 18(3): 536-543. DOI:10.1007/s12311-019-01026-4 |
| [4] |
李爽, 张丽艳, 李雪建, 等. β淀粉样蛋白诱导的阿尔茨海默病小鼠模型中BDNF通过上调TRPC3发挥神经保护作用[J]. 中国医科大学学报, 2020, 49(12): 1086-1090. DOI:10.12007/j.issn.0258-4646.2020.12.007 |
| [5] |
XIN SH, TAN L, CAO X, et al. Clearance of amyloid beta and tau in Alzheimer's disease: from mechanisms to therapy[J]. Neurotox Res, 2018, 34(3): 733-748. DOI:10.1007/s12640-018-9895-1 |
| [6] |
GOULAY R, MENA ROMO L, HOL EM, et al. From stroke to dementia: a comprehensive review exposing tight interactions between stroke and amyloid-β formation[J]. Transl Stroke Res, 2020, 11(4): 601-614. DOI:10.1007/s12975-019-00755-2 |
| [7] |
ERICKSON MA, BANKS WA. Blood-brain barrier dysfunction as a cause and consequence of Alzheimer's disease[J]. J Cereb Blood Flow Metab, 2013, 33(10): 1500-1513. DOI:10.1038/jcbfm.2013.135 |
| [8] |
CAI Z, QIAO PF, WAN CQ, et al. Role of blood-brain barrier in Alzheimer's disease[J]. J Alzheimers Dis, 2018, 63(4): 1223-1234. DOI:10.3233/JAD-180098 |
| [9] |
GOLDIM MPS, DELLA GIUSTINA A, PETRONILHO F. Using Evans blue dye to determine blood-brain barrier integrity in rodents[J]. Curr Protoc Immunol, 2019, 126(1): e83. DOI:10.1002/cpim.83 |
| [10] |
GRAY KM, KATZ DB, BROWN EG, et al. Quantitative phenotyping of cell-cell junctions to evaluate ZO-1 presentation in brain endothelial cells[J]. Ann Biomed Eng, 2019, 47(7): 1675-1687. DOI:10.1007/s10439-019-02266-5 |
| [11] |
STORCK SE, PIETRZIK CU. Endothelial LRP1-a potential target for the treatment of Alzheimer's disease: theme: drug discovery, development and delivery in Alzheimer's disease guest editor: Davide Brambilla[J]. Pharm Res, 2017, 34(12): 2637-2651. DOI:10.1007/s11095-017-2267-3 |
| [12] |
AIELLO BOWLES EJ, CRANE PK, WALKER RL, et al. Cognitive resilience to Alzheimer's disease pathology in the human brain[J]. J Alzheimers Dis, 2019, 68(3): 1071-1083. DOI:10.3233/JAD-180942 |
| [13] |
SHIBATA M, YAMADA S, KUMAR SR, et al. Clearance of Alzheimer's amyloid-ss(1-40) peptide from brain by LDL receptor-related protein-1 at the blood-brain barrier[J]. J Clin Invest, 2000, 106(12): 1489-1499. DOI:10.1172/JCI10498 |
| [14] |
VAN GOOL B, STORCK SE, REEKMANS SM, et al. LRP1 has a predominant role in production over clearance of Aβ in a mouse model of Alzheimer's disease[J]. Mol Neurobiol, 2019, 56(10): 7234-7245. DOI:10.1007/s12035-019-1594-2 |
 2022, Vol. 51
2022, Vol. 51




