文章信息
- 陈秀兰, 刘淑娟, 苏乌云, 闫海成, 窦佳, 李志伟, 王薇
- CHEN Xiulan, LIU Shujuan, SU Wuyun, YAN Haicheng, DOU Jia, LI Zhiwei, WANG Wei
- 白蛋白结合型紫杉醇诱导大鼠神经病理性疼痛的作用机制
- Effects and mechanism of albumin-bound paclitaxel-induced neuropathic pain in rats
- 中国医科大学学报, 2022, 51(12): 1102-1108, 1115
- Journal of China Medical University, 2022, 51(12): 1102-1108, 1115
-
文章历史
- 收稿日期:2022-05-28
- 网络出版时间:2022-12-08 11:04:09
2. 内蒙古医科大学附属医院肿瘤内科, 呼和浩特 010051;
3. 内蒙古医科大学附属医院神经外科, 呼和浩特 010051;
4. 内蒙古鄂托克旗第二人民医院急诊科, 内蒙古 鄂托克旗 016064
2. Department of Oncology, Affiliated Hospital of Inner Mongolia Medical University, Huhhot 010051, China;
3. Department of Neurosurgery, Affiliated Hospital of Inner Mongolia Medical University, Huhhot 010051, China;
4. Department of Internal Medicine, The Second People's Hospital of Etuoke Banner, Inner Mongolia Etuoke Banner 016064, China
白蛋白结合型紫杉醇(albumin-bound paclitaxel,Nab-PTX)是一种新型的紫杉醇制剂,已被广泛应用于多种实体肿瘤的治疗。该药抗肿瘤作用很强,但有较重的神经毒性,会引发周围神经病变(chemotherapy-induced neuropathic pain,CINP),患者常表述手足麻木和疼痛烧灼感,严重时可导致治疗中断。迄今为止,尚无有效的预防和治疗方法。研究[1-2]表明,神经系统的非神经元成分可能参与了CINP的产生,这为该疾病治疗的发展提供了新的靶点。
星形胶质细胞和小胶质细胞是中枢神经系统中介导先天免疫的主要细胞,通过表达的病原模式识别受体(pattern recognition receptors,PRRs)感知受损细胞释放的病原体衍生物或内源性配体,并启动先天免疫反应。Toll样受体家族(Toll-like receptors,TLRs)是第一个被识别的PRRs[3]。Toll样受体4(Toll-like receptor 4,TLR4)是TLR家族中被研究最多的成员,在脊髓背根神经节(dorsal root ganglia,DRG)和胶质细胞中表达增加,可调节脊髓损伤或慢性疼痛诱导的中枢致敏的胶质细胞活化和脊髓中炎症介质的释放[4]。TLR4通过激活NF-κB通路来诱导促炎细胞因子的释放,参与痛觉过敏和异常性疼痛的形成[5]。研究[6]发现TLR4介导的信号通路驱动神经胶质激活及炎症反应,但其在Nab-PTX引起CINP中的作用和机制尚不清楚,本研究旨在探究Nab-PTX诱导的神经病理性疼痛中TLR4/NF-κB信号通路、脊髓胶质细胞和炎性细胞因子的表达变化。
1 材料与方法 1.1 实验动物SPF级成年雄性SD大鼠30只(300~350 g),购自湖南斯莱克景达实验动物有限公司。随机分为Nab-PTX 4 mg/kg组、Nab-PTX 6 mg/kg组及对照组,每组10只。饲养条件:房间的温度和湿度均为恒定(温度20~26 ℃,湿度40%~70%),所有动物都在每日标准的光照7:00~19:00中饲养,自由摄食和饮水。所有动物实验程序均按照国际疼痛研究协会的指导方针进行,并获得动物护理和使用委员会批准。
1.2 实验药物、试剂与仪器 1.2.1 实验药物及试剂注射用Nab-PTX购自石药集团欧意药业有限公司(产品批号:B042003269);肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1beta,IL-1β)、白细胞介素-10(interleukin-10,IL-10)试剂盒(江苏酶免实业有限公司);GFAP(北京博奥森生物技术有限公司);Iba-1、Rabbit Anti TLR4、Mouse Anti P65(美国萊恩生物科技有限公司);山羊抗兔IgG cy3(爱博泰克生物技术有限公司);Trizon Reagent、超纯RNA提取试剂盒(北京康为世纪生物科技有限公司);ChamQ Universal SYBR qPCR Master Mix、HiScriptⅡQ RT SuperMix for qPCR(+gDNA wiper)(南京诺唯赞生物科技股份有限公司);Mouse Monoclonal Anti-GAPDH、辣根酶标记山羊抗鼠IgG(H+L)、辣根酶标记山羊抗兔IgG(H+L)(北京中杉金桥生物技术有限公司);BCA蛋白定量试剂盒(武汉伊莱瑞特生物科技有限公司);Marker(赛默飞世尔科技公司)。
1.2.2 仪器ZH-200热刺痛仪(安徽正华生物仪器设备有限公司);Von Frey纤毛机械刺激针(上海玉研科学仪器有限公司);荧光PCR仪(伯乐生命医学产品有限公司);蛋白垂直电泳仪、全自动酶标仪(北京市六一仪器厂);荧光显微镜(日本奥林巴斯公司)。
1.3 一般情况观测观察大鼠一般健康状况,饮食、腹泻、毛发,运动情况,测定体质量变化。
1.4 构建Nab-PTX化疗后大鼠神经病理性疼痛模型大鼠适应性饲养1周,参照YAMASHITA等[1]和SUN等[2]报道的Nab-PTX给药剂量,Nab-PTX给药组(Nab-PTX 6 mg/kg组和4 mg/kg组)分别于第1、8、15天腹腔注射给药,连续给药3次;对照组给予相同剂量的0.9%生理盐水。分别于给药前及给药后不同时间点检测各组大鼠体质量,同时分别于第0、5、7、11、14、18、21、25、28、32、35天检测各组大鼠机械缩足反射阈值(paw withdrawal mechanical threshold,PWMT)及热缩足反射潜伏期(paw withdrawal thermal latency,PWTL)。行为学测定和药物注射都在白天(9:00~17:00)进行。
1.5 行为学测试 1.5.1 PWMT的测定在安静环境中适应约30 min,将大鼠足底接触于带金属网底的有机玻璃笼内,按升序(1、2、4、6、8、10、15和26 g)逐渐增强的力度将校准的von Frey丝施加到左后足表面的中央皮肤5次,保持6~8 s,每次间隔15 s。当后爪在连续5次应用中有4次从特定长丝中迅速缩爪或舔足为阳性反应,即为大鼠的PWMT[7]。
1.5.2 PWTL采用热刺痛仪照射光束穿过透明的玻璃板,光束直接照射大鼠的左后足,会引起迅速缩足或者舔脚等抬脚动作,记录从光束照射开始到抬脚停止照射持续的时间,每侧重复照射5次,每次照射间隔15 min,取平均数,即为大鼠的PWTL[8]。
1.6 组织取材在实验第1、8、15天腹腔注射Nab-PTX,于第21天检测到大鼠PWMT最低值,故于第21天将大鼠处死,取各组大鼠脊髓腰膨大处组织。
1.7 检测方法 1.7.1 ELISA检测采用双抗体夹心法,分光光度计读数均使用酶标仪进行。标准曲线计算脊髓组织中炎性细胞因子TNF-α、IL-6、IL-1β、IL-10水平。所有实验重复3次。
1.7.2 免疫荧光检测取出大鼠脊髓组织,培养皿内滴加足够量的稀释好的一抗GFAP、Iba-1,4 ℃冰箱孵育过夜,次日用PBS浸洗培养皿3次,每次3 min,移液枪吸干培养皿内多余液体后滴加稀释好的荧光二抗CY3(1∶200),湿盒中37 ℃孵育30 min,PBS浸洗切片3次,每次5 min;最后滴加DAPI避光孵育5 min,对标本进行染核,用PBS冲洗多余的DAPI,自来水冲洗1 min。吸水纸吸干玻片上的液体,含抗荧光淬灭剂的封片液封片。在荧光显微镜下观察采集图像。
1.7.3 实时PCR检测取出大鼠脊髓组织,使用Trizol Reagent,提取RNA且测定浓度后,逆转录得到mRNA,再测定相对表达量,后进行实时PCR,反应体系如下:2×SYBR Green PCR Master Mix 10 μL;上游引物0.4 μL;下游引物0.4 μL;cDNA 1 μL;补充RNase Free dH2O 8.2 μL,反应总体积为20 μL,扩增条件:95 ℃变性10 s;58 ℃退火30 s;72 ℃延伸30 s;共需要40个循环。内参为β-actin,使用2-ΔΔCt法计算基因的相对表达量。其中Stem-loop primer为引物设计时一起合成,见表 1。
| Primer | Sequence(5’-3’) | Length of product(bp) |
| TLR4 | F,GTTGTTAAATGAGCTTGGTGGCT | 137 |
| TLR4 | R,CAGTGGCTGCTTGTCATCGT | |
| NF-κB p65 | F,GCAAAAGGACCTACGAGACC | 103 |
| NF-κB p65 | R,CGGGAAGGCACAGCAATA | |
| β-actin | F,GCCATGTACGTAGCCATCCA | 375 |
| β-actin | R,GAACCGCTCATTGCCGATAG |
1.7.4 Western blotting检测
取出大鼠脊髓组织,剪取样品置于离心管内,加入RIPA细胞裂解液匀浆。高速离心机12 000 r/min离心10 min。取上清液至新的EP管(BCA测定),弃沉淀。绘制标准曲线,测定蛋白浓度,配置SDS-PAGE胶,行蛋白电泳,后用300 mA恒流转膜1.5 h。用PVDF膜孵育一抗过夜,次日PVDF膜室温孵育二抗2 h,洗膜,显影成像。
1.8 统计学分析采用统计学软件SPSS 22.0进行统计分析。计量资料以x±s表示。行为学数据的分析采用重复测量方差分析(Repeated-Measure ANOVA),同一时间点组间比较采用Bonferroni检验;ELISA、免疫荧光、实时PCR、Western blotting等数据采用单因素方差分析(one-way ANOVA)和Bonferroni检验。P < 0.05为差异有统计学意义。
2 结果 2.1 动物一般状况及体质量变化在腹腔注射前,Nab-PTX给药组与对照组体质量无统计学差异。于第1、8、15天腹腔注射Nab-PTX后,与对照组相比,Nab-PTX 6 mg/kg组、4 mg/kg组体质量下降,但无统计学差异。给予Nab-PTX后,大鼠出现轻中度不良反应,如腹泻、戗毛、乏力、摄食减少、运动迟缓,体质量下降等,考虑为化疗药物引起的不良反应。见图 1。
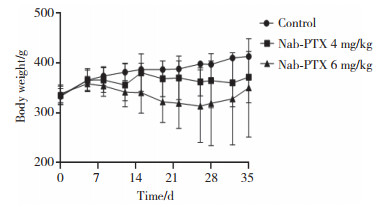
|
| 图 1 Nab-PTX对大鼠体质量的影响 Fig.1 Effect of Nab-PTX on the body mass of rats |
2.2 行为学变化测定结果 2.2.1 PWMT的测定结果
在腹腔注射前,Nab-PTX给药组与对照组PWMT无统计学差异。于第1、8、15天腹腔注射Nab-PTX,与对照组相比,Nab-PTX给药组左后足PWMT均呈逐渐下降趋势,于给药后第21天,Nab-PTX给药组大鼠PWMT降至最低点(P < 0.05)。随着停药时间的延长,Nab-PTX给药组PWMT逐渐回升,至第35天PWMT逐渐恢复。Nab-PTX给药组PWMT之间无统计学差异,表明Nab-PTX可诱发大鼠机械刺激痛觉超敏。见图 2。
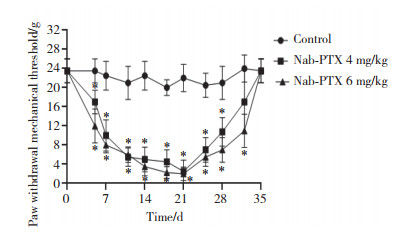
|
| *P < 0.05 compared with control group. 图 2 Nab-PTX给药组和对照组PWMT变化 Fig.2 Change in PWMT in the Nab-PTX and control groups |
2.2.2 PWTL的测定结果
给药组于第1、8、15天腹腔注射Nab-PTX,与对照组相比,给药组左后足PWTL均呈逐渐下降趋势;给药后第18天,Nab-PTX给药组大鼠PWTL值呈最低值(P < 0.05);随着停药时间的延长,Nab-PTX给药组PWTL逐渐恢复,至给药后第35天PWTL基本恢复正常。Nab-PTX给药组PWTL之间无统计学差异,表明Nab-PTX可诱发大鼠热辐射痛觉过敏反应。见图 3。
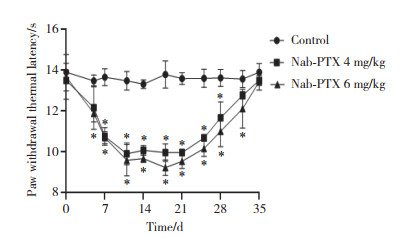
|
| *P < 0.05 compared with control group. 图 3 Nab-PTX给药组和对照组大鼠PWTL变化 Fig.3 Change in PWTL in the Nab-PTX and control groups |
2.3 Nab-PTX诱导的神经病理性疼痛大鼠脊髓中TNF-α、IL-6、IL-1β和IL-10的表达
ELISA法检测结果显示,腹腔注射Nab-PTX后,Nab-PTX 6 mg/kg组和4 mg/kg组TNF-α、IL-6和IL-1β表达水平与对照组相比显著上调,差异均有统计学意义(P < 0.05),然而IL-10表达水平无统计学差异;Nab-PTX 6 mg/kg组与4 mg/kg组之间TNF-α、IL-6、IL-1β和IL-10表达均无统计学差异。证实了炎性细胞因子参与Nab-PTX诱导的神经病理性疼痛的脊髓炎症反应。见表 2。
| Group | TNF-α | IL-6 | IL-1β | IL-10 |
| Control | 90.49±2.71 | 45.12±1.01 | 17.03±0.63 | 17.56±0.36 |
| Nab-PTX 4 mg/kg | 94.60±1.00 | 49.18±2.22 | 18.16±0.82 | 17.83±0.24 |
| Nab-PTX 6 mg/kg | 96.18±1.46 | 50.73±1.83 | 18.55±0.70 | 18.23±0.54 |
2.4 Nab-PTX诱导的神经病理性疼痛大鼠脊髓中GFAP和Iba-1的激活情况
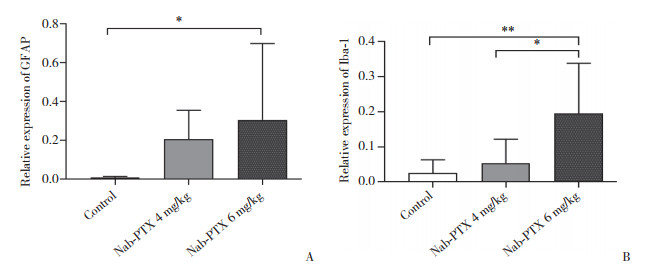
免疫荧光检测结果显示,腹腔注射Nab-PTX后,Nab-PTX 6 mg/kg组与4 mg/kg组GFAP和Iba-1表达均升高;与对照组GFAP和Iba-1表达(分别为0.01±0.01和0.03±0.04)相比,Nab-PTX 6 mg/kg组GFAP和Iba-1表达(0.30±0.39和0.19±0.14)有统计学差异(P < 0.05),而Nab-PTX 4 mg/kg组GFAP和Iba-1表达(0.21±0.12和0.05±0.07)无统计学差异;Nab-PTX 6 mg/kg组与4 mg/kg组之间GFAP表达无统计学差异;而Nab-PTX 6 mg/kg组与4 mg/kg组之间Iba-1表达有统计学差异(P < 0.005)。证实了Nab-PTX诱导的神经病理性疼痛大鼠脊髓中星形胶质细胞和小胶质细胞均被激活。见图 4、5。
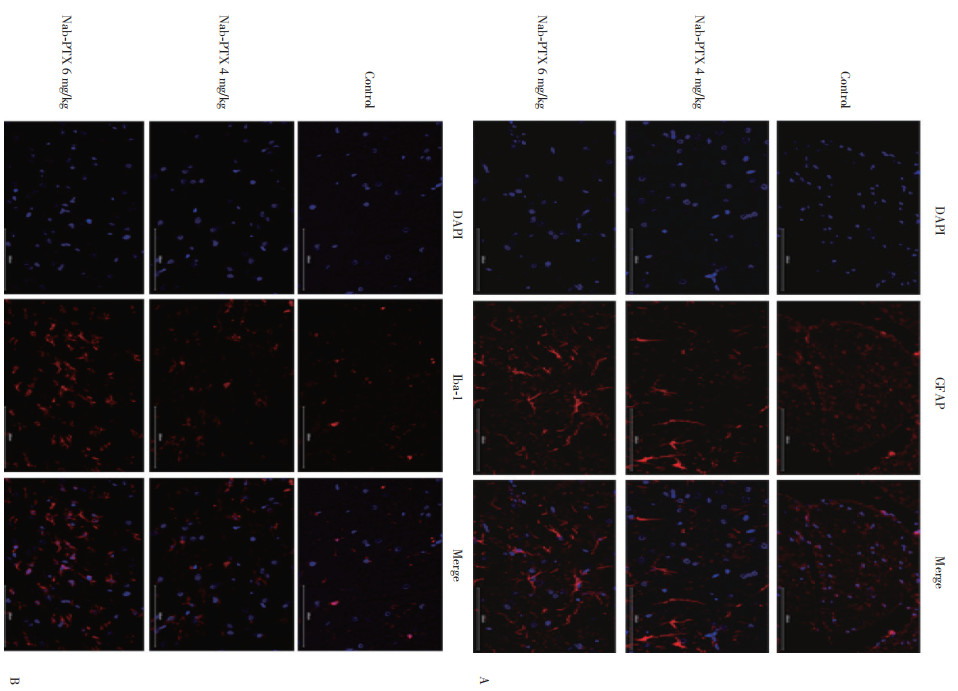
|
| 图 4 GFAP和Iba-1在3组中的染色情况×400 Fig.4 Staining of GFAP and Iba-1 in the 3 groups ×400 |
|
| A, relative protein expression level of GFAP; B, relative protein expression level of Iba-1. *P < 0.05, **P < 0.01. 图 5 Nab-PTX诱导的神经病理性疼痛大鼠脊髓中GFAP和Iba-1的表达 Fig.5 GFAP and Iba-1 expression in the spinal cord of rats with Nab-PTX-induced neuropathic pain |
2.5 Nab-PTX诱导的神经病理性疼痛大鼠脊髓中TLR4和NF-κB p65的mRNA水平的表达
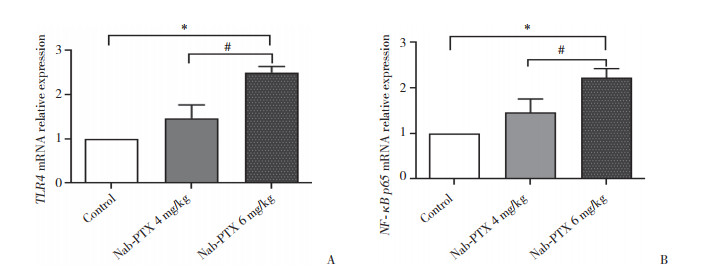
实时PCR检测结果显示,腹腔注射Nab-PTX后,Nab-PTX 6 mg/kg和4 mg/kg大鼠脊髓中TLR4和NF-κB p65的mRNA水平均上调。Nab-PTX 6 mg/kg组TLR4和NF-κB p65的mRNA水平(分别为2.5±0.13和2.22±0.20)与对照组(均为1.00±0.00)及Nab-PTX 4 mg/kg组(1.47±0.30和1.46±0.30)相比均显著上调(P < 0.01),然而Nab-PTX 4 mg/kg组与对照组TLR4和NF-κB p65的mRNA水平相比无统计学差异。证明腹腔注射Nab-PTX后,增加了大鼠脊髓组织中TLR4和NF-κB p65 mRNA水平的表达。见图 6。
|
| A, TLR4; B, NF-κB p65. *P < 0.001, #P < 0.01. 图 6 Nab-PTX诱导的神经病理性疼痛中大鼠脊髓TLR4和NF-κB p65的mRNA的相对表达水平 Fig.6 Relative expression of TLR4 and NF-κBp65 mRNA in the spinal cord of rats with Nab-PTX-induced neuropathic pain |
2.6 Nab-PTX诱导的神经病理性疼痛大鼠脊髓中TLR4和NF-κB p65蛋白水平的表达
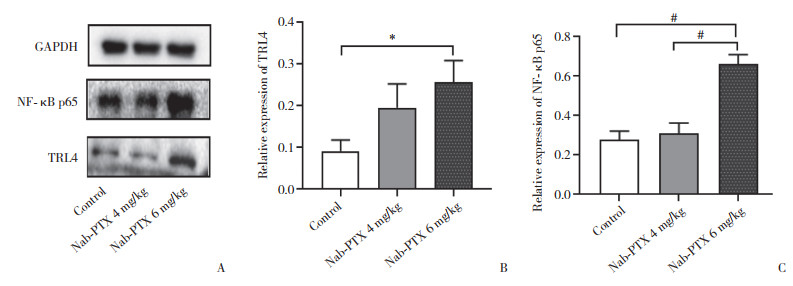
Western blotting检测结果显示,腹腔注射Nab-PTX后,Nab-PTX 6 mg/kg组和4 mg/kg组大鼠脊髓中TLR4和NF-κB p65蛋白表达水平均增加。与对照组TLR4和NF-κB p65蛋白表达(分别为0.09±0.03和0.28±0.04)相比,Nab-PTX 6 mg/kg组TLR4和NF-κB p65蛋白表达(0.26±0.05和0.66±0.05)差异有统计学意义(P < 0.05),而Nab-PTX 4 mg/kg组TLR4和NF-κB p65蛋白表达(0.20±0.06和0.31±0.05)无统计学差异;Nab-PTX 6 mg/kg组与4 mg/kg组之间TLR4蛋白表达无统计学差异,而NF-κB p65蛋白表达差异有统计学差异(P < 0.05)。证明腹腔注射Nab-PTX后,增加了大鼠脊髓组织中TLR4和NF-κB p65蛋白的表达水平。见图 7。
|
| A, expression of TRL4, NF-κB p65 and GAPDH reference band on PVDF membrane; B, protein expression level of TLR4;C, protein expression level of NF-κB p65. *P < 0.05, #P < 0.001. 图 7 Nab-PTX诱导的神经病理性疼痛大鼠脊髓中TLR4和NF-κB p65的蛋白表达水平 Fig.7 Protein expression of TLR4 and NF-κB p65 in the spinal cord of rats with Nab-PTX-induced neuropathic pain |
3 讨论
本研究结果显示,药物模型组PWMT和PWTL显著降低,表明Nab-PTX可诱导大鼠机械刺激痛觉超敏和热辐射痛觉过敏。同时发现Nab-PTX引起的神经病理性疼痛,随药物的停用逐渐消失。其次,在Nab-PTX诱导的神经病理性疼痛大鼠模型中,大鼠脊髓小胶质细胞和星形胶质细胞激活、TLR4/NF-κB p65信号通路上调以及炎性细胞因子TNF-α、IL-1β和IL-6的分泌增加。这些结果表明Nab-PTX在脊髓中引起明显的病理变化,这些可能是导致该药物引起神经病理性疼痛的原因之一。
目前研究[9]均在探索CIPN的确切机制及其最佳治疗方法,在疼痛的背景下,脊髓星形胶质细胞和小胶质细胞活化之间存在重要差异。然而,在Nab-PTX诱导的神经病理性疼痛动物模型中,GFAP、Iba-1均明显的激活,提示星型胶质细胞和小胶质细胞均参与了Nab-PTX诱导的神经病理性疼痛,并且与药物浓度相关。研究[10]表明,中枢神经系统中的细胞因子失调与多种神经病理性疼痛有关。本研究中证实了炎性细胞因子参与Nab-PTX诱导的神经病理性疼痛的脊髓炎症反应,这与研究中[11]报道的CIPN产生炎性细胞因子作用相同。因此,抑制促炎细胞因子的产生可能成为减轻Nab-PTX诱导的神经性疼痛的潜在靶点。
近年来,关于TLR4在神经病理性疼痛等免疫炎症性疾病中的作用引起了广泛关注,在免疫炎症应答和神经病理性疼痛之间起重要连接作用[12]。TLR4的活化最终表现在激活NF-κB,促进炎性细胞因子的合成与分泌和启动获得性免疫应答[13-14]。本研究结果显示,TLR4/NF-κB参与了Nab-PTX诱导的神经病理性疼痛,从而释放促进疼痛行为的促炎细胞因子合成与分泌。
本研究成功构建Nab-PTX诱导的神经病理性疼痛大鼠模型,观察了大鼠疼痛行为学变化及脊髓GFAP、Iba-1、TLR4、NF-κB p65及炎性细胞因子表达的变化。本研究结果显示,Nab-PTX引起神经病理性疼痛的同时,可诱发星形胶质细胞和小胶质细胞激活、TLR4、NF-κB p65信号通路上调及炎性细胞因子TNF-α、IL-6和IL-1β分泌增加,并且与药物剂量相关。对上述通路及靶点进行调节,有望找到一种新的神经病理性疼痛治疗手段,改善Nab-PTX化疗引起的神经病理性疼痛患者的临床预后,为其治疗以及药物筛选提供新的研究方向。
| [1] |
YAMASHITA Y, EGASHIRA N, MASUGUCHI K, et al. Comparison of peripheral neuropathy induced by standard and nanoparticle albumin-bound paclitaxel in rats[J]. J Pharmacol Sci, 2011, 117(2): 116-120. DOI:10.1254/jphs.11062sc |
| [2] |
SUN H, GUO X, WANG ZT, et al. Alphalipoic acid prevents oxidative stress and peripheral neuropathy in nab-paclitaxel-treated rats through the Nrf2 signalling pathway[J]. Oxid Med Cell Longev, 2019, 2019: 3142732. DOI:10.1155/2019/3142732 |
| [3] |
LACAGNINA MJ, WATKINS LR, GRACE PM. Toll-like receptors and their role in persistent pain[J]. Pharmacol Ther, 2018, 184: 145-158. DOI:10.1016/j.pharmthera.2017.10.006 |
| [4] |
BEHZADI P, GARCÍA-PERDOMO HA, KARPIŃSKI TM. Toll-like receptors: general molecular and structural biology[J]. J Immunol Res, 2021, 2021: 9914854. DOI:10.1155/2021/9914854 |
| [5] |
OH SH, LEE HY, KI YJ, et al. Gabexate mesilate ameliorates the neuropathic pain in a rat model by inhibition of proinflammatory cytokines and nitric oxide pathway via suppression of nuclear factor-κB[J]. Korean J Pain, 2020, 33(1): 30-39. DOI:10.3344/kjp.2020.33.1.30 |
| [6] |
VANDERWALL AG, MILLIGAN ED. Cytokines in pain: harnessing endogenous anti-inflammatory signaling for improved pain management[J]. Front Immunol, 2019, 10: 3009. DOI:10.3389/fimmu.2019.03009 |
| [7] |
CHAPLAN SR, BACH FW, POGREL JW, et al. Quantitative assessment of tactile allodynia in the rat paw[J]. J Neurosci Methods, 1994, 53(1): 55-63. DOI:10.1016/0165-0270(94)90144-9 |
| [8] |
HARGREAVES K, DUBNER R, BROWN F, et al. A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia[J]. Pain, 1988, 32(1): 77-88. DOI:10.1016/0304-3959(88)90026-7 |
| [9] |
FUMAGALLI G, MONZA L, CAVALETTI G, et al. Neuroinflammatory process involved in different preclinical models of chemotherapy-induced peripheral neuropathy[J]. Front Immunol, 2021, 11: 626687. DOI:10.3389/fimmu.2020.626687 |
| [10] |
ZHU LR, HUANG YL, HU YM, et al. Toll-like receptor 4/nuclear factor-kappa B pathway is involved in radicular pain by encouraging spinal microglia activation and inflammatory response in a rat model of lumbar disc herniation[J]. Korean J Pain, 2021, 34(1): 47-57. DOI:10.3344/kjp.2021.34.1.47 |
| [11] |
BA XY, WANG JL, ZHOU SY, et al. Cinobufacini protects against paclitaxel-induced peripheral neuropathic pain and suppresses TRPV1 up-regulation and spinal astrocyte activation in rats[J]. Biomed Pharmacother, 2018, 108: 76-84. DOI:10.1016/j.biopha.2018.09.018 |
| [12] |
ZUSSO M, LUNARDI V, FRANCESCHINI D, et al. Ciprofloxacin and levofloxacin attenuate microglia inflammatory response via TLR4/NF-kB pathway[J]. J Neuroin flammation, 2019, 16(1): 148. DOI:10.1186/s12974-019-1538-9 |
| [13] |
FAROOQ M, BATOOL M, KIM MS, et al. Toll-like receptors as a therapeutic target in the era of immunotherapies[J]. Front Cell Dev Biol, 2021, 9: 756315. DOI:10.3389/fcell.2021.756315 |
| [14] |
SU WL, CUI H, WU DN, et al. Suppression of TLR4-MyD88 signaling pathway attenuated chronic mechanical pain in a rat model of endometriosis[J]. J Neuroinflammation, 2021, 18(1): 65. DOI:10.1186/s12974-020-02066-y |
 2022, Vol. 51
2022, Vol. 51




