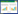文章信息
- 孙九许, 燕梦云, 翟晋娜, 丁凌, 孙雅嘉, 裴凌鹏
- SUN Jiuxu, YAN Mengyun, ZHAI Jinna, DING Ling, SUN Yajia, PEI Lingpeng
- 基于网络药理学探究刺老苞治疗肌肉减少症的作用机制
- Mechanism of Aralia echinocaulis for sarcopenia based on network pharmacology
- 中国医科大学学报, 2022, 51(11): 980-986
- Journal of China Medical University, 2022, 51(11): 980-986
-
文章历史
- 收稿日期:2021-11-08
- 网络出版时间:2022-11-04 13:17
2. 民族医药教育部重点实验室,北京 100081
2. Key Laboratory of Ethnomedicine, Ministry of Education, Beijing 100081, China
肌肉减少症是指骨骼肌质量和功能随年龄增加而逐渐丧失的慢性退行性疾病[1]。目前,我国肌肉减少症患病率呈上升趋势,严重影响老年人的生活质量。肌肉减少症是一种复杂的疾病,研究[2]发现其与胰岛素抵抗、慢性病、营养缺乏和运动等多种因素相关,但具体病因及机制尚不明确。
肌肉减少症归属于中医“虚劳”“肉痿”等范畴,年老者脾胃虚弱,气血生化乏源,肢体失于濡养,则见肢体倦怠乏力,肌肉萎缩[3]。刺老苞为五加科植物楤木或棘茎楤木的根皮或茎皮[4]。其成分以皂苷、黄酮等居多,具有保肝、抗癌以及提高免疫力等多种药理活性。《滇南本草》记载刺老苞归脾肾二经,脾主肌肉,肾主骨,目前对于它的研究多在骨科疾病方面,而骨肌系统是一个有机整体,相互协调、密不可分[5]。
本研究基于网络药理学分析刺老苞治疗肌肉减少症的活性成分、相关靶点和潜在信号通路,探讨其可能的作用机制,为后期相关研究提供指导。
1 材料与方法 1.1 仪器与试剂超高效液相色谱仪(日本岛津公司),高分辨质谱仪(美国赛默飞公司)。刺老苞根皮(批号091101)购自湖北施恩堂药业;甲醇、乙腈和甲酸均购自德国Merck公司。
1.2 方法 1.2.1 供试品溶液制备取刺老苞适量研磨(30 Hz,1.5 min)至粉末状;称取100 mg粉末,溶解于1.2 mL 70%甲醇中;每30 min涡旋1次,共涡旋6次,置于4 ℃冰箱过夜;离心(12 000 r/min,10 min)后取上清,用微孔滤膜(0.22 μm)过滤,保存于进样瓶中,用于液质分析。
1.2.2 色谱条件Agilent SB-C18(2.1 mm×100 mm,1.8 µm)色谱柱;流动相0.1% 甲酸溶液~乙腈,梯度洗脱(0.00 min乙腈比例为5%,9.00 min内乙腈比例线性增加到95%,并维持1 min;10.00~11.10 min乙腈比例降为5%,并以该比例平衡至14 min);柱温40 ℃;体积流量0.35 mL/min,进样量4 μL。
1.2.3 质谱条件电喷雾离子源,涡轮喷雾;源温度550 ℃;离子喷雾电压(ionspray voltage,IS)5.5 kV(正离子模式)/-4.5 kV(负离子模式);离子源气体(ion source gas,GS)Ⅰ,GSⅡ和帘气(curtain gas,CUR)分别设置为50、60和25.0 psi,碰撞诱导电离参数设置为高。
1.2.4 刺老苞成分获取及靶点预测将液质联用得到的成分输入TCMSP数据库(https://tcmspw.com/tcmsp.php),筛选口服生物利用度(oral bioavail ability,OB)≥30%和类药性(drug likeness,DL)≥0.18的化合物。利用TCMSP数据库、化合物蛋白质互作STITCH数据库(https://stitch.embl.de)获得化合物靶点。
1.2.5 肌肉减少症靶点及交集靶点筛选以“Muscle loss” “Sarcopenia”在Genecards数据库(https://www.genecards.org/)、OMIM数据库(https://www.omim.org/)中检索,得到疾病靶标。与化合物靶点交集后得到共同靶点。
1.2.6 刺老苞治疗肌肉减少症靶蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络图将交集靶点导入STRING平台(https://string-db.org/)获得PPI网络图。物种“Homo sapiens”,最低相互作用阈值“highest confidence 0.9”。使用Cytoscape3.8.2软件构建PPI网络,利用软件中的Analyze Network功能进行拓扑分析,获得各节点的中心度值(degree)。
1.2.7 “药物-活性成分-靶点-疾病”可视化网络图构建将药物、有效成分、疾病、交集靶点导入Cytoscape 3.8.2进行可视化分析,绘制网络图,然后通过Network Analysis插件分析节点度值。
1.2.8 交集靶点富集分析将交集靶点输入DAVID数据库(https://David.ncifcrf.gov)进行基因本体论(gene ontology,GO)分析和京都基因与基因组数据库(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。将分析结果根据FDR值从小至大进行排序,筛选前15条绘制气泡图和条形图。
2 结果 2.1 刺老苞成分筛选及靶点获取超高效液相色谱-电喷雾-串联质谱分析鉴定出445个化合物。OB值和DL值符合条件的有茵芋苷(MOL013083)、美洲茶酸(MOL001521)、花旗松素(MOL004576)、杜仲脂素A(MOL009007)、槲皮素(MOL000098)、N-阿魏酰酪胺(MOL008647)、槲皮万寿菊素(MOL002721)7个化合物。预测出163个化合物靶点。
2.2 肌肉减少症疾病靶点及交集靶点获取运用GeneCards、OMIM数据库检索肌肉减少症靶点,整理后得到靶点1 348个。与药物靶点取交集得到共同靶点64个。
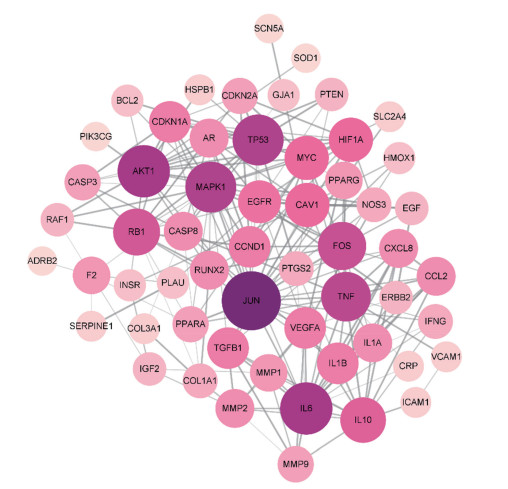
2.3 PPI网络构建结果结果显示,PPI网络有57个节点,211条边(图 1)。利用Analyze Network进行拓扑分析,获得各节点的中心度值,选取排名前20的靶点,以度值为横坐标,基因名为纵坐标绘制条形图(图 2)。JUN、AKT1、IL6、TP53以及MAPK1等排名前10的基因可能是刺老苞防治肌肉减少症的核心基因。
|
| 图 1 潜在PPI网络图 Fig.1 Protein-protein interaction network of potential targets |
|
| 图 2 PPI互作网络核心靶点 Fig.2 The core targets of the protein-protein interaction network |
2.4 可视化网络图构建
利用Cytoscape软件构建“刺老苞-活性成分-靶点-肌肉减少症”网络图(图 3)。图中包括73个节点,144条边,其中靶点64个,活性成分7个,疾病和药物各1个。同一成分对应多个作用靶点和多个成分对应同一靶点的关系,体现了刺老苞多成分多靶点治疗肌肉减少症的特点。对图中节点进行拓扑分析,发现槲皮素节点度值明显高于其他成分,表明其可能是刺老苞治疗肌肉减少症的关键成分。

|
| 图 3 刺老苞-活性成分-靶点-肌肉减少症互作网络 Fig.3 Aralia echinocaulis active components-targets-sarcopenia network |
2.5 GO分析及KEGG富集分析
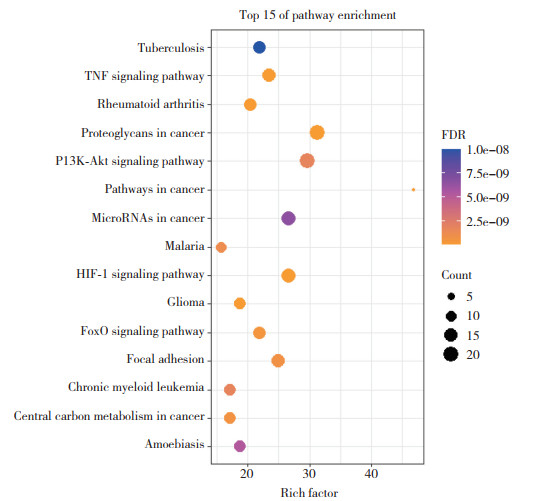
GO功能富集分析涉及生物过程(biological process,BP)456条,分子功能(molecular function,MF)57条,细胞组分(cellular component,CC)43条。选取FDR排名前10的基因绘制条形图(图 4)。KEGG通路分析涉及106条通路,筛选前15条通路进行分析(表 1),主要涉及TNF、FoxO以及PI3K-Akt信号通路等。运用RStudio软件对结果进行可视化分析(图 5),其中,气泡面积大小反映该通路富集基因数目的多少,气泡颜色深浅反映富集的显著程度。气泡越大表明富集到的基因数越多;气泡颜色越浅表明富集的显著程度越高。PI3K-Akt信号通路气泡面积大且颜色浅,可作为刺老苞治疗肌肉减少症的主要通路。
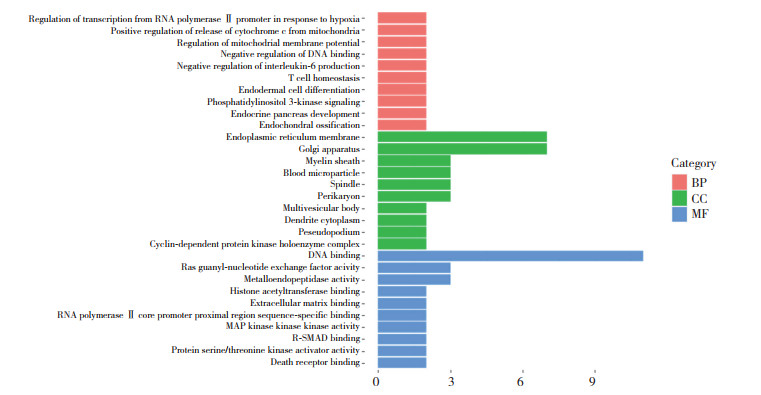
|
| 图 4 GO富集分析结果 Fig.4 GO enrichment analysis results |
| No. | Pathway name | Gene name |
| hsa05200 | Pathways in cancer | RB1, CDKN1A, CXCL8, PTEN, PTGS2, HIF1A, EGFR, PIK3CG, CASP8, CCND1, MYC, CASP3, ERBB2, AKT1, MAPK1, JUN, TGFB1, CDKN2A, MMP1, EGF, MMP2, FOS, MMP9, VEGFA, AR, IL6, BCL2, PPARG, RAF1, TP53 |
| hsa04066 | HIF-1 signaling pathway | CDKN1A, NOS3, EGF, INSR, SERPINE1, HIF1A, EGFR, PIK3CG, HK2, VEGFA, IL6, IFNG, ERBB2, BCL2, AKT1, MAPK1, HMOX1 |
| hsa05205 | Proteoglycans in cancer | CDKN1A, TGFB1, MMP2, CAV1, IGF2, HIF1A, TNF, MMP9, EGFR, PIK3CG, VEGFA, CCND1, PLAU, MYC, CASP3, ERBB2, AKT1, MAPK1, RAF1, TP53 |
| hsa04668 | TNF signaling pathway | JUN, VCAM1, FOS, PTGS2, TNF, MMP9, PIK3CG, ICAM1, IL6, CASP8, IL1B, CASP3, CCL2, AKT1, MAPK1 |
| hsa05214 | Glioma | RB1, CDKN1A, CCND1, CDKN2A, EGF, PTEN, MAPK1, AKT1, RAF1, TP53, EGFR, PIK3CG |
| hsa05323 | Rheumatoid arthritis | JUN, TGFB1, CXCL8, MMP1, FOS, TNF, ICAM1, VEGFA, IL1A, IL6, IFNG, IL1B, CCL2 |
| hsa04068 | FoxO signaling pathway | IL10, CDKN1A, TGFB1, EGF, INSR, PTEN, SLC2A4, EGFR, PIK3CG, IL6, CCND1, AKT1, MAPK1, RAF1 |
| hsa05230 | Central carbon metabolism in cancer | MYC, ERBB2, PTEN, MAPK1, AKT1, RAF1, HIF1A, TP53, EGFR, HK2, PIK3CG |
| hsa04510 | Focal adhesion | JUN, EGF, CAV1, PTEN, EGFR, PIK3CG, VEGFA, COL1A1, COL3A1, CCND1, ERBB2, SPP1, BCL2, AKT1, MAPK1, RAF1 |
| hsa05144 | Malaria | IL10, IL6, TGFB1, VCAM1, CXCL8, IFNG, IL1B, CCL2, TNF, ICAM1 |
| hsa04151 | PI3K-Aktsignaling pathway | CDKN1A, NOS3, EGF, INSR, PTEN, EGFR, PIK3CG, VEGFA, COL1A1, COL3A1, IL6, CCND1, MYC, SPP1, BCL2, AKT1, MAPK1, RAF1, TP53 |
| hsa05220 | Chronic myeloid leukemia | RB1, CDKN1A, TGFB1, CCND1, CDKN2A, MYC, MAPK1, AKT1, RAF1, TP53, PIK3CG |
| hsa05146 | Amoebiasis | IL10, COL1A1, COL3A1, IL6, TGFB1, CXCL8, IFNG, IL1B, CASP3, HSPB1, TNF, PIK3CG |
| hsa05206 | MicroRNAs in cancer | CDKN1A, CDKN2A, PTEN, PTGS2, MMP9, EGFR, VEGFA, CCND1, PLAU, MYC, CASP3, ERBB2, BCL2, CYP1B1, HMOX1, RAF1, TP53 |
| hsa05152 | Tuberculosis | IL10, TGFB1, TNF, IL1A, IL6, CASP8, IFNG, IL1B, CASP3, BCL2, AKT1, MAPK1, RAF1, CTSD |
|
| 图 5 KEGG通路富集气泡图 Fig.5 KEGG pathway enrichment bubble map |
3 讨论
本研究通过网络药理学发现刺老苞治疗肌肉减少症的7个活性成分和64个潜在靶点,其中槲皮素度值最高。槲皮素是一种黄酮类化合物,具有抗氧化、抗肿瘤和免疫调节等多种药理作用[6]。研究[7]发现,槲皮素可通过减少过氧化氢生成和提高线粒体抗氧化能力增加成肌细胞活力,抑制细胞凋亡,防止肌肉萎缩。
PPI网络分析筛选出度值排名前10的靶蛋白,这些靶蛋白很可能在刺老苞治疗肌肉减少症中发挥关键作用。其中,AP-1转录因子亚基可诱导肌原素分化进而引发肌细胞分化[8]。蛋白激酶Bα能抑制肌生成素的转录活性,诱导骨骼肌分化[9]。不同浓度白细胞介素-6(interleukin 6,IL-6)可诱导成肌细胞增殖与分化[10]。肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)可诱导肌肉萎缩,在肌肉病理机制中起到重要作用[11]。这些核心靶点参与成肌细胞的增殖、分化、凋亡等生物过程。
研究[12-17]报道,KEGG分析中的HIF-1、TNF、FoxO以及PI3K-Akt信号通路是目前研究肌肉减少症的主要通路。气泡图结果表明,PI3K-Akt通路很可能是刺老苞治疗肌肉减少症的一条重要通路。PI3K/AKT信号通路在骨骼肌修复再生方面发挥着重要作用,其不仅可以上调信号通路的蛋白表达、诱导磷酸化过程、促进肌卫星细胞增殖分化、抑制细胞凋亡,还能促进骨骼肌蛋白合成、骨骼肌再生以及修复损伤[12-13]。转录因子FoxOs可以通过促进肌细胞中特异性分化因子MyoD的表达影响肌纤维分化[14]。TNF-α在肌肉再生中对肌肉细胞有直接作用,在炎性和非炎性肌病中与肌纤维再生有关[15]。HIF-1可通过调节红细胞生成素介导的红细胞生成和血管内皮生长因子诱导的血管生成来增加氧转运,有助于骨骼肌对耐力运动的适应过程[16]。其中血管内皮生长因子可刺激肌肉血管生成和成肌细胞增殖[17]。
综上所述,本研究通过液质联用和网络药理学探讨了刺老苞治疗肌肉减少症的物质基础和作用网络,揭示了刺老苞多成分、多靶点、多通路协同发挥治疗作用的特点,从理论层面预测了刺老苞治疗肌肉减少症可能的作用机制,为后续研究提供思路,但仍需更多相关的分子以及细胞生物学实验对结论进行验证。
| [1] |
FIELDING RA, VELLAS B, EVANS WJ, et al. Sarcopenia: an undiagnosed condition in older adults. Current consensus definition: prevalence, etiology, and consequences[J]. J Am Med Dir Assoc, 2011, 12(4): 249-256. DOI:10.1016/j.jamda.2011.01.003 |
| [2] |
杨玲, 杜娟, 刘荣雁, 等. 肌肉减少症病因学研究现状与展望[J]. 中国骨质疏松杂志, 2020, 26(11): 1689-1693. DOI:10.3969/j.issn.1006-7108.2020.11.024 |
| [3] |
秦大平, 张晓刚, 宋敏, 等. 从筋骨并重理论探讨肌少症与骨质疏松症的中医药防治策略[J]. 中华中医药杂志, 2019, 34(9): 4364-4369. |
| [4] |
包柏林, 王忠壮. 棘茎楤木的资源学和生药学研究[J]. 中国中药杂志, 2004, 29(6): 508-510. DOI:10.3321/j.issn:1001-5302.2004.06.005 |
| [5] |
BONEWALD LF, KIEL DP, CLEMENS TL, et al. Forum on bone and skeletal muscle interactions: summary of the proceedings of an ASBMR workshop[J]. J Bone Miner Res, 2013, 28(9): 1857-1865. DOI:10.1002/jbmr.1980 |
| [6] |
杨颖, 王芸芸, 蒋琦辰. 槲皮素药理作用的研究进展[J]. 特种经济动植物, 2020, 23(5): 24-28. |
| [7] |
CHEN C, YANG JS, LU CC, et al. Effect of quercetin on dexamethasone-induced C2C12 skeletal muscle cell injury[J]. Molecules, 2020, 25(14): 3267. DOI:10.3390/molecules25143267 |
| [8] |
LEHTINEN SK, RAHKILA P, HELENIUS M, et al. Down-regulation of transcription factors AP-1, Sp-1, and NF-kappa B precedes myocyte differentiation[J]. Biochem Biophys Res Commun, 1996, 229(1): 36-43. DOI:10.1006/bbrc.1996.1754 |
| [9] |
GWAG T, PARK K, KIM E, et al. Inhibition of C2C12 myotube atrophy by a novel HSP70 inducer, celastrol, via activation of Akt1 and ERK1/2 pathways[J]. Arch Biochem Biophys, 2013, 537(1): 21-30. DOI:10.1016/j.abb.2013.06.006 |
| [10] |
STEYN PJ, DZOBO K, SMITH RI, et al. Interleukin-6 induces myogenic differentiation via JAK2-STAT3 signaling in mouse C2C12 myoblast cell line and primary human myoblasts[J]. Int J Mol Sci, 2019, 20(21): 5273. DOI:10.3390/ijms20215273 |
| [11] |
SISHI BJN, ENGELBRECHT AM. Tumor necrosis factor alpha (TNF-α) inactivates the PI3-kinase/PKB pathway and induces atrophy and apoptosis in L6 myotubes[J]. Cytokine, 2011, 54(2): 173-184. DOI:10.1016/j.cyto.2011.01.009 |
| [12] |
吕欣, 周达岸. PI3K/AKT信号通路对骨骼肌再生的影响研究进展[J]. 中国运动医学杂志, 2020, 39(11): 908-912. DOI:10.16038/j.1000-6710.2020.11.013 |
| [13] |
FU YY, LI S, TONG HL, et al. WDR13 promotes the differentiation of bovine skeletal muscle-derived satellite cells by affecting PI3K/AKT signaling[J]. Cell Biol Int, 2019, 43(7): 799-808. DOI:10.1002/cbin.11160 |
| [14] |
张聪聪, 陈博雅, 程乃萱, 等. AKT/FOXO1信号通路在心力衰竭小鼠骨骼肌萎缩中的作用[J]. 心肺血管病杂志, 2018, 37(1): 60-65. DOI:10.3969/j.issn.1007-5062.2018.01.016 |
| [15] |
TIDBALL JG, VILLALTA SA. Regulatory interactions between muscle and the immune system during muscle regeneration[J]. Am J Physiol Regul Integr Comp Physiol, 2010, 298(5): R1173-R1187. DOI:10.1152/ajpregu.00735.2009 |
| [16] |
BILLIN AN, HONEYCUTT SE, MCDOUGAL AV, et al. HIF prolyl hydroxylase inhibition protects skeletal muscle from eccentric contraction-induced injury[J]. Skelet Muscle, 2018, 8(1): 35. DOI:10.1186/s13395-018-0179-5 |
| [17] |
RISSANEN TT, VAJANTO I, HILTUNEN MO, et al. Expression of vascular endothelial growth factor and vascular endothelial growth factor receptor-2 (KDR/flk-1) in ischemic skeletal muscle and its regeneration[J]. Am J Pathol, 2002, 160(4): 1393-1403. DOI:10.1016/S0002-9440(10)62566-7 |
 2022, Vol. 51
2022, Vol. 51