文章信息
- 黄晨凤, 李淼
- HUANG Chenfeng, LI Miao
- 鱼腥草素钠对中性粒细胞哮喘小鼠炎性细胞因子和黏蛋白表达的影响
- Effect of sodium houttuyfonate on the expression of inflammatory factors and mucins in mice with neutrophilic asthma
- 中国医科大学学报, 2022, 51(11): 970-974
- Journal of China Medical University, 2022, 51(11): 970-974
-
文章历史
- 收稿日期:2021-12-08
- 网络出版时间:2022-11-04 13:43
支气管哮喘(简称哮喘)是一种异质性气道慢性炎症疾病,影响全球约3.34亿人,我国则有2 000余万人患有哮喘[1-2]。根据痰液炎症细胞的不同,哮喘可分为嗜酸性粒细胞哮喘、中性粒细胞哮喘(neutrophilic asthma,NA)、寡粒细胞哮喘和混合性粒细胞哮喘[3]。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)是哮喘中常见的炎性细胞因子,而黏蛋白5AC(mucin 5 subtype AC,MUC5AC)过度表达被认为是哮喘气道黏液高分泌的标志,丝氨酸/苏氨酸蛋白激酶(serine/threo-nine protein kinase,AKT)参与以上三者的形成过程。鱼腥草为食药同源中药,鱼腥草素钠(sodium houttuyfonate,SH)是鱼腥草素的化合物,具有抗炎作用[4]。既往研究[5]表明,SH能抑制哮喘气道高反应(airway hyperresponsiveness,AHR)及气道炎症。本研究拟探讨SH是否通过抑制AKT磷酸化减少炎性细胞因子及黏蛋白表达,从而缓解NA症状。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级Balb/c小鼠40只(购自北京华阜康生物科技股份有限公司),6~8周龄,体质量18~20 g。
1.1.2 主要试剂和仪器卵清蛋白(ovalbumin,OVA)购自美国Sigma公司;脂多糖(lipopolysaccharide,LPS)、SH购自大连美仑生物公司;免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司;RNAiso Plus购自宝日医生物技术(北京)有限公司;反转录试剂盒、实时荧光定量聚合酶链式反应(real-time fluorescent quantitative polymerase chain reaction,qRT-PCR)试剂盒购自北京全式金生物技术股份有限公司;兔抗TNF-α、GAPDH、AKT抗体、鼠抗p-AKT抗体购自美国Proteintech公司,鼠抗IL-1β抗体购自美国Cell Signaling Technology公司,鼠抗MUC5AC抗体购自美国ThermoFisher Scientific公司。压缩空气式雾化器(403M,中国鱼跃医疗股份有限公司),qRT-PCR仪购自美国Applied Biosystems公司,多功能酶标仪购自美国BioTek公司。
1.2 方法 1.2.1 动物分组和模型建立将小鼠随机分为正常对照(NC)组、NA组、SH组、地塞米松(dexamethasone,DXM)组、联合干预(SH + DXM)组,每组8只。建立小鼠NA模型[6],NC组小鼠鼻腔滴入20 μL生理盐水,其余组小鼠在实验第1、7、14天分别鼻腔滴入等量50 μg OVA+15 μg LPS的混合致敏液。实验第21~27天,对SH(10 mg/kg)组、DXM(2 mg/kg)组、SH+DXM(10 mg/kg+2 mg/kg)组小鼠腹腔注射相应剂量的药物,NA、NC组小鼠腹腔注射等量生理盐水,1 h后将除NC组以外的其他4组小鼠分批放置于雾化箱中,5% OVA溶液空气压缩雾化,30 min/次,1次/d;NC组小鼠用等量生理盐水雾化,余条件同前。
1.2.2 无创气道阻力检测最后一次雾化激发48 h内,用DSI Buxco无创双腔检测系统检测各组小鼠的特殊气道阻力(special resistance of airway,sRaw)。
1.2.3 单肺灌洗及细胞计数将小鼠麻醉后行单肺灌洗,将回收的支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)离心(1 500 r/min,4 ℃)10 min,弃上清,加入200 μL 4%多聚甲醛重悬,吸取适量BALF滴在血细胞计数板上,镜下计数白细胞总数;另取适量BALF根据瑞氏吉姆萨染色液试剂盒要求操作,镜下分类计数白细胞。
1.2.4 标本采集取小鼠右下肺,4%多聚甲醛固定,-80 ℃冻存,用于后续实验。
1.2.5 HE、PAS、Masson染色将固定好的肺组织制成石蜡切片,根据相应试剂盒说明书进行染色,镜下观察各组小鼠气道、气道周围、气道黏膜下的生理病理形态。
1.2.6 免疫组织化学(immunohistochemistry,IHC)染色石蜡切片常规脱蜡至水,根据抗体说明书进行抗原修复,内源性过氧化物酶阻断剂灭活30 min,非特异染色阻断剂封闭30 min,加入MUC5AC抗体(1∶200稀释)4 ℃过夜,加入二抗孵育20 min,SABC孵育20 min,DAB显色。
1.2.7 qRT-PCR检测各组小鼠肺组织中MUC5AC mRNA表达水平提取小鼠肺组织总RNA,按照试剂盒说明书反转录成cDNA,然后行PCR扩增。内参照β-actin正向引物序列5’-CTACCTCATGAAGATCCTGACC-3’,反向引物序列5’-CACAGCTTCTCTTTGATGTCAC-3’;MUC5AC正向引物序列5’-ATCTGTAAGGAAGCCACGCTAA-3’,反向引物序列5’-CTCCTCGTATGTGACTATCAGG-3’。qRT-PCR反应体系:qRT-PCR SuperMix 10 μL,上下游引物各0.4 μL,Dye 0.4 μL,cDNA模板2.0 μL,RNase-free H2O 6.8 μL,共20 μL。反应条件:94 ℃ 30 s,94 ℃ 5 s,60 ℃ 30 s,共40个循环。用2-∆∆Ct法分析相对表达量。
1.2.8 Western blotting检测各组小鼠肺组织中TNF-α、IL-1β、p-AKT/AKT蛋白表达量提取总蛋白,按照BCA试剂盒说明书进行蛋白定量,制备蛋白样品。经电泳、转膜、封闭,经一抗(TNF-α、IL-1β抗体稀释1∶1 000,GAPDH抗体稀释1∶10 000,p-AKT/AKT抗体稀释1∶3 000)4 ℃孵育、二抗(稀释1∶10 000)室温孵育后,ECL法发光显影。
1.3 统计学分析采用GraphPad Prism 8.0软件行统计学分析,符合正态分布的计量资料多组间比较采用单因素方差分析,多重比较采用Dunnett's T3检验。P < 0.05为差异有统计学意义。所有实验均重复3次以上。
2 结果 2.1 各组气道阻力比较气道阻力检测结果显示,NA组小鼠的sRaw [(3.11±1.00)cmH2O·s]明显高于NC组[(0.85±0.06)cmH2O·s],差异有统计学意义(P < 0.01);SH组[(1.46±0.12)cmH2O·s]、DXM组[(1.20±0.23)cmH2O·s]、SH+DXM组[(0.89±0.13)cmH2O·s]均低于NA组,差异有统计学意义(均P < 0.05)。
2.2 各组单肺灌洗及细胞计数比较BALF白细胞总数计数结果显示,NA组BALF中白细胞总数[(352.75±56.96)×104/mL]高于NC组[(19.54±11.52)×104/mL],差异有统计学意义(P < 0.01)。SH组、DXM组、SH + DXM组小鼠BALF中白细胞总数分别为(125.42±31.03)×104/mL、(55.96± 10.29)×104/mL、(47.13±6.97)×104/mL,均高于NC组,但较NA组均明显减少,差异有统计学意义(P < 0.01);DXM组、SH + DXM组BALF中的白细胞总数较SH组均减少,差异有统计学意义(P < 0.01)。
BALF瑞氏吉姆萨染色白细胞分类计数结果显示,NA组、SH组、DXM组的嗜酸性粒细胞数 [(18.50±0.71)×104/mL、(9.42±0.58)×104/mL、(7.83±0.75)×104/mL]均高于NC组[(3.67±0.92)×104/mL],中性粒细胞数[(71.08±5.93)×104/mL、(22.79±3.10)×104/mL、(5.79±0.89)×104/mL]亦均高于NC组[(2.17±1.10)×104/mL],差异有统计学意义(P < 0.01);SH+DXM组的嗜酸性粒细胞数[(4.42±0.89)×104/mL]及中性粒细胞数[(3.71±0.51)×104/mL]与SH组、DXM组的嗜酸性粒细胞数及中性粒细胞数较NA组均明显减少,差异有统计学意义(P < 0.01);DXM组、SH+DXM组的嗜酸性粒细胞数及中性粒细胞数较SH组均减少,差异有统计学意义(P < 0.01)。NA组、SH组、DXM组、SH + DXM组的巨噬细胞数分别为(36.42±11.44)×104/mL、(31.38±11.01)×104/mL、(21.29±4.57)×104/mL、(15.54±3.02)×104/mL,均高于NC组[(7.46±4.26)×104/mL],淋巴细胞数分别为(26.58 ±8.04)×104/mL、(30.00±11.84)×104/mL、(17.92±3.59)×104/mL、(16.17±2.06)×104/mL,亦高于NC组[(5.13±3.71)×104/mL],差异有统计学意义(P < 0.01)。
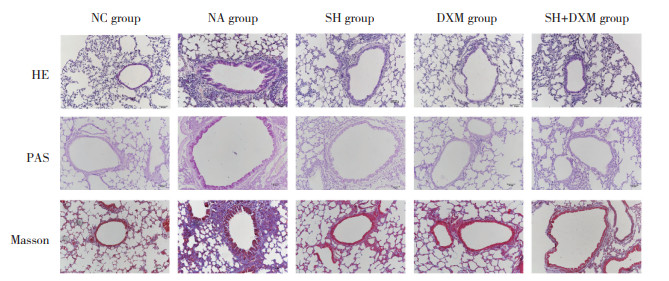
2.3 各组肺组织和气道组织染色结果比较HE染色显示,NC组小鼠气道无炎症表现,而NA组气道上皮细胞肥大、管壁增厚、管腔狭窄,肺组织及气道有明显的炎症细胞浸润,SH组、DXM组、SH+DXM组肺组织及气道炎症明显减轻。PAS染色显示,NA组小鼠气道有明显的黏液高分泌,NC组则几乎没有,SH组、DXM组、SH+DXM组分泌明显减少;Masson染色显示,NA组小鼠肺组织及气道黏膜下有明显的纤维化,NC组几乎没有纤维化发生,SH组、DXM组、SH+DXM组纤维化显著减少,见图 1。
|
| 图 1 各组小鼠肺组织及气道组织 HE、PAS、Masson 染色 ×200 Fig.1 HE, PAS, and Masson staining of lung tissues and airway of mice in each group ×200 |
2.4 各组小鼠肺组织中黏蛋白和炎性细胞因子表达水平比较
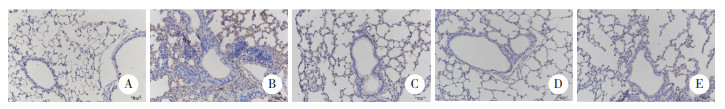
IHC染色显示,NA组肺组织中MUC5AC的表达(0.076±0.022)明显高于NC组(0.011±0.002),SH组(0.025±0.005)、DXM组(0.024±0.008)、SH+DXM组(0.021±0.003)的表达量较NA组明显减少,见图 2。
|
| A, NC group; B, NA group; C, SH group; D, DXM group; E, SH +DXM group. 图 2 各组小鼠肺组织及气道IHC染色 ×200 Fig.2 IHC staining of lung tissue and airway of mice in each group ×200 |
2.5 各组小鼠肺组织中MUC5AC mRNA表达水平比较
qRT-PCR结果显示,NA组小鼠肺组织中MUC5AC mRNA表达水平(25.02±13.52)显著高于NC组(0.85±0.44),差异有统计学意义(P < 0.01),SH组(12.26±7.03)、DXM组(2.04±1.07)、SH+DXM组(5.17±2.81)均低于NA组,差异有统计学意义(P < 0.05)。
2.6 各组小鼠肺组织中炎性细胞因子表达水平比较Western blotting结果显示,NA组小鼠肺组织中TNF-α蛋白相对表达量(1.38±0.17)高于NC组(1.00±0.69),SH组(1.01±0.10)、DXM组(0.85±0.12)、SH+DXM组(0.78±0.19)TNF-α相对表达量则低于NA组,差异有统计学意义(P < 0.05);NA组小鼠肺组织中IL-1β蛋白相对表达量(1.51±0.42)高于NC组(0.96±0.17),SH组(0.90±0.20)、DXM组(0.89±0.22)、SH+DXM组(0.80±0.30)IL-1β相对表达量低于NA组,差异有统计学意义(P < 0.05),见图 3。

|
| 图 3 Western blotting检测各组小鼠肺组织中TNF-α、IL-1β蛋白表达水平 Fig.3 TNF-α and IL-1β protein expression levels in lung tissues of mice in each group detected by Western blotting |
Western blotting结果还显示,NA组小鼠肺组织中p-AKT表达水平(1.51±0.30)高于NC组(0.75±0.10),SH组(0.99±0.31)、DXM组(0.80±0.28)、SH+DXM组(0.96±0.25)p-AKT表达水平低于NA组,差异有统计学意义(P < 0.05),见图 4。

|
| 图 4 各组小鼠肺组织中p-AKT/AKT蛋白表达水平 Fig.4 p-AKT/AKT protein expression in lung tissues of mice in each group |
3 讨论
NA是哮喘的表型之一[7],其特征是多数中性粒细胞聚集于肺组织和气道,释放大量炎症介质(如TNF-α、IL-1β),从而引发炎症反应[8-9]。本研究发现,NA组小鼠sRaw、BALF中白细胞总数及中性粒细胞计数、肺组织TNF-α及IL-1β蛋白表达量均较NC组增加。研究[10]发现,MUC5AC在NA中高表达,IL-1β可增加人原代气道上皮细胞中MUC5AC表达。研究[11]表明,NA气道上皮细胞中TNF-α、MUC5AC表达增加。本研究结果发现,NA组小鼠肺组织中MUC5AC mRNA及蛋白表达量较NC组增多。本研究结果还显示,SH组、DXM组、SH+DXM组小鼠肺组织中MUC5AC mRNA及蛋白表达量较NA组减少,说明SH、DXM及两者联合干预均可降低NA小鼠肺组织中MUC5AC mRNA及蛋白表达水平。
AKT是AGC蛋白家族成员之一,有研究[12]证明NA小鼠模型中AKT磷酸化信号增强。LI等[13]指出,TNF-α可能通过激活AKT磷酸化参与气道炎症。MA等[14]证实,车前草苷通过抑制AKT磷酸化降低MUC5AC及IL-1β的表达量。在本研究中,NA组小鼠肺组织中p-AKT/AKT蛋白表达量较NC组增多,SH组小鼠肺组织中p-AKT/AKT蛋白表达量较NA组明显减少,提示SH可以抑制NA小鼠肺组织中AKT磷酸化。
鱼腥草素是鱼腥草的主要活性成分。因SH较鱼腥草素注射液更安全稳定,故临床上通常使用SH。SH在多种细胞和动物模型中发挥抗炎作用,可抑制牛和小鼠乳腺上皮细胞中TNF-α、IL-1β的表达[15-16];降低大鼠BALF中TNF-α、IL-1β的水平[17],可通过抑制p38、JNK和ERK通路的磷酸化来抑制NF-κB活化。本研究中,SH组、DXM组、SH+DXM组小鼠的sRaw、BALF中白细胞总数及中性粒细胞计数、肺组织中TNF-α和IL-1β的蛋白表达量均低于NA组,提示SH、DXM及两者联合干预均可抑制NA小鼠的炎症。ZHU等[18]的研究结果表明,鱼腥草可抑制肺纤维化p-AKT/AKT的表达。本研究发现,DXM组、SH+DXM组小鼠肺组织中p-AKT/AKT的蛋白表达量较NA组减少,提示DXM干预、SH联合DXM干预均可抑制NA小鼠肺组织中AKT磷酸化。
综上所述,本研究发现SH可通过抑制AKT磷酸化,减少炎性细胞因子及黏蛋白的表达,缓解NA的炎症表现,为NA的治疗提供了一种新的策略。
| [1] |
BONSER LR, ERLE DJ. Airway mucus and asthma: the role of MUC5AC and MUC5B[J]. J Clin Med, 2017, 6(12): 112. DOI:10.3390/jcm6120112 |
| [2] |
ZHANG YZ, WU QJ, YANG X, et al. Effects of SIRT1/Akt pathway on chronic inflammatory response and lung function in patients with asthma[J]. Eur Rev Med Pharmacol Sci, 2019, 23(11): 4948-4953. DOI:10.26355/eurrev_201906_18085 |
| [3] |
DAVIES AR, HANCOX RJ. Induced sputum in asthma: diagnostic and therapeutic implications[J]. Curr Opin Pulm Med, 2013, 19(1): 60-65. DOI:10.1097/MCP.0b013e32835b118e |
| [4] |
LIU X, ZHONG LL, XIE JN, et al. Sodium houttuyfonate: a review of its antimicrobial, anti-inflammatory and cardiovascular protective effects[J]. Eur J Pharmacol, 2021, 902: 174110. DOI:10.1016/j.ejphar.2021.174110 |
| [5] |
陈叶, 黄丽娟, 胡智立, 等. 鱼腥草素钠对急性哮喘模型小鼠炎症的影响及机制研究[J]. 药物评价研究, 2019, 42(6): 1105-1109. |
| [6] |
周倩兰, 王天玥, 尚云晓. 中性粒细胞哮喘与嗜酸性粒细胞哮喘小鼠中Kv1.3钾离子通道表达及电流改变[J]. 国际儿科学杂志, 2017, 44(6): 409-414. DOI:10.3760/cma.j.issn.1673-4408.2017.06.011 |
| [7] |
SEYS SF, LOKWANI R, SIMPSON JL, et al. New insights in neutrophilic asthma[J]. Curr Opin Pulm Med, 2019, 25(1): 113-120. DOI:10.1097/mcp.0000000000000543 |
| [8] |
LIN JL, HUANG NN, LI J, et al. Cross-reactive antibodies against dust mite-derived enolase induce neutrophilic airway inflammation[J]. Eur Respir J, 2021, 57(1): 1902375. DOI:10.1183/13993003.02375-2019 |
| [9] |
RAY A, KOLLS JK. Neutrophilic inflammation in asthma and association with disease severity[J]. Trends Immunol, 2017, 38(12): 942-954. DOI:10.1016/j.it.2017.07.003 |
| [10] |
TAN HTT, HAGNER S, RUCHTI F, et al. Tight junction, mucin, and inflammasome-related molecules are differentially expressed in eosinophilic, mixed, and neutrophilic experimental asthma in mice[J]. Allergy, 2019, 74(2): 294-307. DOI:10.1111/all.13619 |
| [11] |
SHANG J, LIU WH, YIN CY, et al. Cucurbitacin E ameliorates lipopolysaccharide-evoked injury, inflammation and MUC5AC expression in bronchial epithelial cells by restraining the HMGB1-TLR4-NF-κB signaling[J]. Mol Immunol, 2019, 114: 571-577. DOI:10.1016/j.molimm.2019.09.008 |
| [12] |
KIM HK, LEE GH, BHATTARAI KR, et al. PI3Kδ contributes to ER stress-associated asthma through ER-redox disturbances: the involvement of the RIDD-RIG-I-NF-κB axis[J]. Exp Mol Med, 2018, 50(2): e444. DOI:10.1038/emm.2017.270 |
| [13] |
LI DG, CHEN DP, ZHANG XM, et al. C-Jun N-terminal kinase and Akt signalling pathways regulating tumour necrosis factor-α-induced interleukin-32 expression in human lung fibroblasts: implications in airway inflammation[J]. Immunology, 2015, 144(2): 282-290. DOI:10.1111/imm.12374 |
| [14] |
MA CN, MA W. Plantamajoside inhibits lipopolysaccharide-induced MUC5AC expression and inflammation through suppressing the PI3K/Akt and NF-κB signaling pathways in human airway epithelial cells[J]. Inflammation, 2018, 41(3): 795-802. DOI:10.1007/s10753-018-0733-7 |
| [15] |
WANG WQ, HU XY, SHEN P, et al. Sodium houttuyfonate inhibits LPS-induced inflammatory response via suppressing TLR4/NF-κB signaling pathway in bovine mammary epithelial cells[J]. Microb Pathog, 2017, 107: 12-16. DOI:10.1016/j.micpath.2017.03.011 |
| [16] |
LIU P, YANG C, LIN SH, et al. Sodium houttuyfonate inhibits LPS-induced mastitis in mice via the NF-κB signalling pathway[J]. Mol Med Rep, 2019, 19(3): 2279-2286. DOI:10.3892/mmr.2019.9846 |
| [17] |
WU ZH, TAN B, ZHANG HY, et al. Effects of sodium houttuyfonate on pulmonary inflammation in COPD model rats[J]. Inflammation, 2017, 40(6): 2109-2117. DOI:10.1007/s10753-017-0650-1 |
| [18] |
ZHU DW, YU Q, SUN JJ, et al. Evaluating the therapeutic mechanisms of selected active compounds in Houttuynia cordata thunb. in pulmonary fibrosis via network pharmacology analysis[J]. Front Pharmacol, 2021, 12: 733618. DOI:10.3389/fphar.2021.733618 |
 2022, Vol. 51
2022, Vol. 51