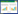文章信息
- 张爱, 张君杰, 高琳琳, 袁亦彤, 周华, 王艳秋
- ZHANG Ai, ZHANG Junjie, GAO Linlin, YUAN Yitong, ZHOU Hua, WANG Yanqiu
- 二甲双胍对单侧输尿管梗阻小鼠肾脏纤维化的影响及其作用机制
- Effect of metformin on renal fibrosis in mice with unilateral ureteral obstruction and its mechanism
- 中国医科大学学报, 2022, 51(11): 1021-1025, 1030
- Journal of China Medical University, 2022, 51(11): 1021-1025, 1030
-
文章历史
- 收稿日期:2022-03-09
- 网络出版时间:2022-11-4 15:09
2. 辽宁电力中心医院医疗服务保障部,沈阳 110002;
3. 沈阳医学院附属中心医院病理科,沈阳 110024
2. Medical Service Guarantee Department, Liaoning Electric Power Central Hospital, Shenyang 110002, China;
3. Department of Pathology, Central Hospital Affiliated to Shenyang Medical College, Shenyang 110024, China
肾纤维化是慢性肾脏病(chronic kidney di-sease,CKD)的共同特征,其机制复杂,包括细胞外基质蛋白(纤连蛋白和Ⅰ型胶原)产生及降解不平衡[1]、肾小管上皮细胞凋亡和萎缩、小管上皮-间质转化、免疫细胞浸润和分泌炎症介质[转化生长因子-β(transforming growth factor-β,TGF-β)等]多个环节[2]。目前肾纤维化尚无有效治疗方法,因此,探索新的有效干预靶点预防和治疗肾纤维化尤为重要。
已有研究显示,二甲双胍在癌症和心血管疾病[3]、非酒精性脂肪性肝炎[4]的治疗中也发挥重要作用。在小鼠模型中二甲双胍可以通过抑制TGF-β信号通路缓解叶酸诱导的肾间质纤维化[5]。在单侧输尿管梗阻(unilateral ureteral obstruction,UUO)小鼠模型中,二甲双胍也能通过抑制TGF-β信号通路减轻肾脏的纤维化[6]。
Hippo/YAP通路不但调节细胞分裂、增殖、分化和凋亡,还在机体的生长发育及调控器官大小等方面发挥重要作用。正常机体内,处于活化状态的Mst1/2能够磷酸化并激活其底物Lats1/2,进一步磷酸化其下游YAP,导致其无法入核,丧失转录辅助因子的功能。生理状态下的Hippo/YAP通路能够负调控其下游效应分子YAP的转录活性,以限制组织过度生长,从而在维持细胞增殖和凋亡稳态方面发挥作用。而在病理状态下,YAP发生去磷酸化并进入细胞核与其下游靶蛋白TEAD结合,促进Hippo/YAP通路下游靶基因的转录[7]。近年来Hippo/YAP通路的研究多集中于抗肿瘤领域[8]。近期研究[9]发现Hippo/YAP信号通路可能参与心血管疾病的血管重塑,与心血管疾病和肾脏疾病发生发展有密切关系。也有研究[10]提示Hippo/YAP信号通路可能参与缺血性急性肾损伤并促进肾纤维化。本研究探讨二甲双胍对UUO诱导的小鼠肾脏纤维化的影响及其作用机制,旨在为肾脏疾病的治疗提供新方案。
1 材料与方法 1.1 实验动物及试剂30只5~7月龄C57BL/6小鼠,体质量20~25 g,SPF级,购自辽宁长生生物技术股份有限公司。本研究已获得医院伦理委员会批准(2020PS664K)。主要试剂包括二甲双胍(美国Sigma公司),p-YAP(AP0489)、LATs1(A17992)、TEAD(武汉爱博泰克公司,A5218),YAP1(武汉赛维尔公司,GB11542),β-actin(武汉亚科因公司,A01011),F4/80(Sc-52664)、TGF-β1(美国Santa Cruz公司,Sc-1700),CD68(上海碧云天公司,AF6432)。
1.2 方法 1.2.1 动物模型的制备及分组小鼠随机均分为假手术组、UUO组、二甲双胍组,每组10只。采用单侧输尿管结扎术法[11]建立UUO小鼠模型,UUO组、二甲双胍组小鼠5%异戊巴比妥钠(50 mg/kg)腹腔注射麻醉,腹部消毒、备皮,取左侧腹部肾区切口进入腹腔,游离左侧输尿管,在其上1/3处及肾门处以4-0手术线结扎。假手术组小鼠仅分离左侧输尿管但不结扎。二甲双胍组手术前1 d开始采用二甲双胍灌胃[200 mg/(kg·d),溶剂为生理盐水],连续7 d。UUO组和假手术组同时间给予等量生理盐水灌胃。然后处死小鼠,膀胱穿刺收集尿样,心脏穿刺留取血标本。生理盐水灌注肾脏后,留取肾上极并进行石蜡固定,剩余肾组织及血、尿标本于-80 ℃冰箱储存。
1.2.2 血尿标本检测按试剂说明书应用比色法检测尿N-乙酰-β-D-葡萄糖苷酶(N-acetyl-β-D-glucosidase,NAG),肌氨酸氧化酶法检测血肌酐,脲酶法检测尿素氮。
1.2.3 HE染色肾脏组织石蜡切片(厚度4 μm)后HE染色,脱水封片,应用正置显微镜观察肾脏组织纤维化程度的变化。
1.2.4 Masson染色肾脏组织石蜡切片(厚度4 μm),烤片,脱蜡水化,Masson染色封片。显微镜(200倍)观察并拍照。肾间质纤维化程度评分[12]:每张切片观察20~30个视野并拍照,采用IPP软件计算,纤维化程度评分=纤维化面积/总面积×100%。
1.2.5 免疫组化染色肾脏石蜡切片(厚度4 μm),烤片、脱蜡,抗原修复,加一抗4 ℃过夜。二抗37 ℃反应45 min。DAB显色剂,脱水,封片。200倍镜下随机选取5张图像,使用ImageJ软件测量并计算平均光密度。
1.2.6 免疫荧光染色石蜡切片烤片、脱蜡,抗原修复,BSA封闭,一抗4 ℃过夜。二抗室温避光染色1 h。DAPI染核,封片,固定。200倍镜下随机选取5张图像,使用ImageJ软件测量并计算平均光密度。
1.2.7 Western blotting检测提取肾脏组织蛋白,BCA法测定总蛋白浓度。SDS-PAGE胶制备、上样、跑胶、转膜、封闭,一抗4 ℃过夜,二抗37 ℃ 60 min,ECL显色。应用ImageJ采集图像,以目的蛋白灰度值与内参蛋白灰度值比值来进行半定量分析。
1.3 统计学分析采用SPSS 22.0软件进行统计分析,计量资料采用x±s表示,多组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 3组小鼠尿NAG、血尿素氮和血肌酐水平比较结果显示,与假手术组比较,UUO组尿NAG显著升高(P < 0.05),提示UUO模型建模成功。与UUO组比较,二甲双胍组尿NAG显著降低(P < 0.05)。血尿素氮和血肌酐3组比较无统计学差异(均P > 0.05),见表 1。
| Group | Urea NAG(U/L) | blood urea nitrogen(mmol/L) | serum creatinine(μmoI/L) |
| Sham | 21.54±9.57 | 1.57±0.46 | 31.80±12.10 |
| UUO | 56.20±13.171) | 1.56±0.41 | 33.69±8.78 |
| Metformin | 41.19±12.672) | 1.28±0.35 | 30.54±11.81 |
| 1)P < 0.05 vs sham group;2)P < 0.05 vs UUO group. | |||
2.2 3组小鼠肾脏组织HE和Masson染色比较
HE染色结果显示,假手术组肾小球、肾小管结构基本正常,无明显炎症细胞浸润。UUO组肾小管明显扩张,呈不规则状,甚至融合成空洞,肾小管刷状缘完整性被破坏;集合管、远曲小管扩张呈囊状甚至消失;肾间质有较多炎症细胞浸润,纤维组织增生。与UUO组比较,二甲双胍组肾间质病变改善,炎症细胞浸润减少,见图 1。
|
| 图 1 3组小鼠肾脏病理HE和Masson染色结果×200 Fig.1 HE staining and Masson staining of renal tissue in the three group ×200 |
Masson染色结果显示,假手术组蓝色胶原沉积少,小管间质范围窄。UUO组大量胶原纤维沉积,间质范围增宽。而二甲双胍组较UUO组胶原沉积减少。见图 1、表 2。
| Group | Renal fibrosis | TGF-β1 | CD68 | YAP1 | F4/80 |
| Sham | 4.52±2.23 | 1.30±0.64 | 0.57±0.49 | 4.04±1.15 | 1.00±0 |
| UUO | 9.70±5.491) | 7.23±2.591) | 16.75±2.101) | 11.03±3.841) | 1.35±0.241) |
| metformin | 4.76±2.192) | 2.16±0.692) | 12.21±5.212) | 4.46±1.082) | 1.19±0.232) |
| 1)P < 0.05 vs sham group;2)P < 0.05 vs UUO group. | |||||
2.3 3组免疫组化检测及免疫荧光染色结果比较
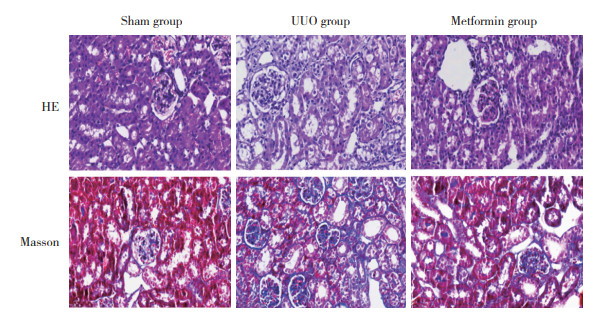
免疫组化结果显示,与假手术组比较,UUO组TGF-β1、CD68和YAP1表达显著增加(均P < 0.05);与UUO组比较,二甲双胍组TGF-β1、CD68和YAP1表达均明显下降(均P < 0.05)。见图 2、表 2。
|
| 图 2 3组TGF-β1、CD68和YAP1表达比较×200 Fig.2 Comparison of TGF-β1, CD68, and YAP1 expression in renal tissues among the three groups using immunohistochemical staining ×200 |
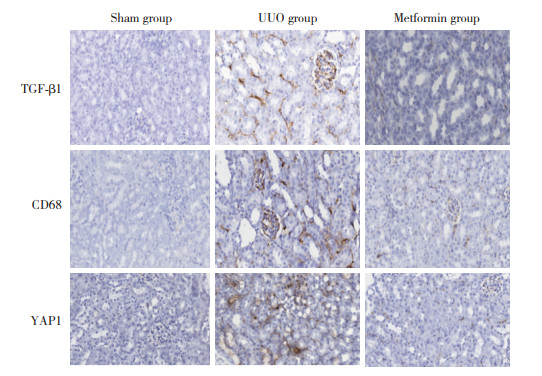
免疫荧光染色结果显示,与假手术组比较,UUO组F4/80表达明显增加(P < 0.05);与UUO组比较,二甲双胍组F4/80表达显著降低(P < 0.05)。见表 2、图 3。
|
| A, sham group; B, UUO group; C, metformin group. 图 3 3组免疫荧光染色结果×200 Fig.3 Immunofluorescence staining of renal tissue among the three group ×200 |
2.4 3组Western blotting检测结果比较
结果显示,与假手术组比较,UUO组肾脏组织中YAP1及下游靶蛋白TEAD的表达水平显著增加(均P < 0.05),p-YAP和YAP1上游负调控分子LATs1的表达水平显著减少(均P < 0.05)。与UUO组比较,二甲双胍组YAP1及TEAD表达水平下降,p-YAP、LATs1表达水平增加(均P < 0.05),见图 4。
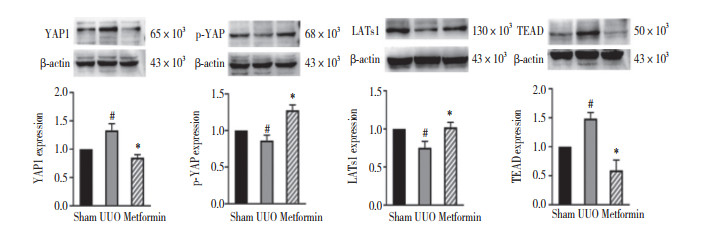
|
| # P < 0.05 vs sham group; * P < 0.05 vs UUO group. 图 4 3组小鼠肾脏组织中YAP1、p-YAP、LATs1、TEAD蛋白表达 Fig.4 Protein expression of YAP1, p-YAP, LATs1, and TEAD in renal tissues among the three groups |
3 讨论
研究[13]显示,正常肾脏组织结构损伤、纤维化的发生和发展是导致CKD的主要原因。在纤维化过程中肌成纤维细胞和炎症细胞被认为是关键因素,而TGF-β尤为重要[14]。肾脏含有多种固有免疫细胞(树突状细胞、巨噬细胞和NK淋巴细胞等),在维持组织稳态方面起着重要作用,一旦被激活,就会产生炎症介质,引发肾脏疾病[15]。有证据[16]表明肾组织中巨噬细胞浸润参与肾移植转归、肾间质纤维化和肾小管萎缩;而且其浸润水平和肾小球硬化、间质纤维化程度密切相关[17]。
关于UUO小鼠模型和进行性CKD患者的研究[18]显示,骨髓来源的单核细胞/巨噬细胞能够转变为肌成纤维细胞,并通过巨噬细胞标志物(F4/80、CD68)和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的共表达以及胶原蛋白的产生来鉴定。巨噬细胞的聚集和分化在肾损伤的各个阶段都至关重要[19]。巨噬细胞的过度积累是诱导肾损伤发生的重要因素,去除巨噬细胞可减少肾脏组织中的巨噬细胞募集及巨噬细胞来源的炎性细胞因子,降低肾脏的炎症、氧化应激反应以及肾纤维化过程,从而减少肾脏组织损伤[20]。
UUO模型是较成熟的研究肾小管间质纤维化的模型。本研究结果显示,与假手术组比较,UUO组尿NAG水平具有统计学差异(P < 0.05);而血肌酐、血尿素氮3组比较无统计学差异(均P > 0.05),考虑可能与小鼠造模时间短、肾小管间质损伤时间短以及机体代偿有关。本研究结果显示,与UUO组比较,二甲双胍组TGF-β1、CD68、F4/80的表达显著减少(均P < 0.05),推测二甲双胍可能通过抑制单核/巨噬细胞浸润来降低肾脏炎症反应,从而进一步抑制肾间质纤维化。
Hippo/YAP信号通路作为一种进化保守的通路,在从果蝇到人类的细胞增殖、凋亡和分化过程中发挥了重要作用。本研究结果显示,UUO模型能够显著上调肾组织中YAP、TEAD的表达,并显著下调其上游调控因子LATs和p-YAP的表达,而二甲双胍治疗能够逆转上述变化,提示肾组织中YAP信号通路的激活可能参与肾纤维化。
本研究结果显示,二甲双胍治疗能显著降低UUO小鼠的肾间质纤维化,而肾间质纤维化是CKD的共同特征,是进展为终末期肾病的病理基础。因此推测二甲双胍可能通过降低肾间质纤维化参与改善CKD的病理过程。Hippo/YAP信号通路在UUO模型肾组织中能显著激活,并能通过上调促纤维化因子TGF-β1的表达水平促进肾纤维化过程,通过上调巨噬细胞抗原CD68、F4/80,激活巨噬细胞系统和炎症反应,促进肾纤维化,进而导致肾脏结构和功能异常。
综上所述,二甲双胍可能通过干预Hippo/YAP信号通路来改善UUO模型小鼠的肾脏结构和功能异常。但本研究未获得二甲双胍通过抑制单核/巨噬细胞浸润来降低肾脏炎症反应的直接证据,因此结论有待进一步研究论证。
| [1] |
WANG J, ZHU HB, HUANG LQ, et al. Nrf2 signaling attenuates epithelial-to-mesenchymal transition and renal interstitial fibrosis via PI3K/Akt signaling pathways[J]. Exp Mol Pathol, 2019, 111: 104296. DOI:10.1016/j.yexmp.2019.104296 |
| [2] |
SONG JG, WANG TZ, CHI XC, et al. Kindlin-2 inhibits the hippo signaling pathway by promoting degradation of MOB1[J]. Cell Rep, 2019, 29(11): 3664-3677. DOI:10.1016/j.celrep.2019.11.035 |
| [3] |
DEPERALTA DK, WEI L, GHOSHAL S, et al. Metformin prevents hepatocellular carcinoma development by suppressing hepatic progenitor cell activation in a rat model of cirrhosis[J]. Cancer, 2016, 122(8): 1216-1227. DOI:10.1002/cncr.29912 |
| [4] |
YI H, HUANG CL, SHI Y, et al. Metformin attenuates folic-acid induced renal fibrosis in mice[J]. J Cell Physiol, 2018, 233(9): 7045-7054. DOI:10.1002/jcp.26505 |
| [5] |
CAVAGLIERI RC, DAY RT, FELIERS D, et al. Metformin prevents renal interstitial fibrosis in mice with unilateral ureteral obstruction[J]. Mol Cell Endocrinol, 2015, 412: 116-122. DOI:10.1016/j.mce.2015.06.006 |
| [6] |
PARK JA, KWON YG. Hippo-YAP/TAZ signaling in angiogenesis[J]. BMB Rep, 2018, 51(3): 157-162. DOI:10.5483/bmbrep.2018.51.3.016 |
| [7] |
MOYA IM, HALDER G. Hippo-YAP/TAZ signalling in organ regene- ration and regenerative medicine[J]. Nat Rev Mol Cell Biol, 2019, 20(4): 211-226. DOI:10.1038/s41580-018-0086-y |
| [8] |
ZHOU JL, ZHANG L, ZHOU W, et al. LIMD1 phosphorylation in mitosis is required for mitotic progression and its tumor-suppressing activity[J]. FEBS J, 2019, 286(5): 963-974. DOI:10.1111/febs.14743 |
| [9] |
IWAKURA T, FUJIGAKI Y, FUJIKURA T, et al. Cytoresistance after acute kidney injury is limited to the recovery period of proximal tubule integrity and possibly involves Hippo-YAP signaling[J]. Physiol Rep, 2017, 5(11): e13310. DOI:10.14814/phy2.13310 |
| [10] |
YANG F, QIN Y, WANG YQ, et al. Metformin inhibits the NLRP3 inflammasome via AMPK/mTOR-dependent effects in diabetic cardiomyopathy[J]. Int J Biol Sci, 2019, 15(5): 1010-1019. DOI:10.7150/ijbs.29680 |
| [11] |
NOGUEIRA A, PIRES MJ, OLIVEIRA PA. Pathophysiological mechanisms of renal fibrosis: a review of animal models and therapeutic strategies[J]. In Vivo, 2017, 31(1): 1-22. DOI:10.21873/invivo.11019 |
| [12] |
HUANG L, WANG AM, HAO Y, et al. Macrophage depletion lowe- red blood pressure and attenuated hypertensive renal injury and fibrosis[J]. Front Physiol, 2018, 9: 473. DOI:10.3389/fphys.2018.00473 |
| [13] |
CHEN YT, JHAO PY, HUNG CT, et al. Endoplasmic reticulum protein TXNDC5 promotes renal fibrosis by enforcing TGF-β signaling in kidney fibroblasts[J]. J Clin Invest, 2021, 131(5): e143645. DOI:10.1172/JCI143645 |
| [14] |
MA TT, MENG XM. TGF-β/smad and renal fibrosis[J]. Adv Exp Med Biol, 2019, 1165: 347-364. DOI:10.1007/978-981-13-8871-2_16 |
| [15] |
SERÓN D, O'VALLE F, MORESO F, et al. Immunophenotype of infiltrating cells in protocol renal allograft biopsies from tacrolimus-versus cyclosporine-treated patients[J]. Transplantation, 2007, 83(5): 649-652. DOI:10.1097/01.tp.0000253760.35580.d3 |
| [16] |
GUILLÉN-GÓMEZ E, DASILVA I, SILVA I, et al. Early macrophage infiltration and sustained inflammation in kidneys from deceased donors are associated with long-term renal function[J]. Am J Transplant, 2017, 17(3): 733-743. DOI:10.1111/ajt.13998 |
| [17] |
罗丛伟, 何晓洋, 彭芬芬, 等. 基于肾纤维化机制的药物临床研究进展[J]. 中华肾病研究电子杂志, 2020, 9(2): 78-81. DOI:10.3877/cma.j.issn.2095-3216.2020.02.006 |
| [18] |
ANDRADE-OLIVEIRA V, FORESTO-NETO O, WATANABE IKM, et al. Inflammation in renal diseases: new and old players[J]. Front Pharmacol, 2019, 10: 1192. DOI:10.3389/fphar.2019.01192 |
| [19] |
LU H, WU LF, LIU LP, et al. Quercetin ameliorates kidney injury and fibrosis by modulating M1/M2 macrophage polarization[J]. Biochem Pharmacol, 2018, 154: 203-212. DOI:10.1016/j.bcp.2018.05.007 |
| [20] |
黄蕾, 刘彦彬, 林宇涵, 等. 去除巨噬细胞对血管紧张素Ⅱ诱导的高血压小鼠肾脏的保护作用[J]. 肾脏病与透析肾移植杂志, 2017, 26(3): 240-245. DOI:10.3969/cndt.j.issn.1006-298X.2017.03.008 |
 2022, Vol. 51
2022, Vol. 51