文章信息
- 武彬, 丁雨溪, 王静, 夏建平, 马立威, 张劲松
- WU Bin, DING Yuxi, WANG Jing, XIA Jianping, MA Liwei, ZHANG Jinsong
- miR-146a-5p靶向调控Notch2促进人晶状体上皮细胞线粒体损伤诱导的细胞凋亡
- miR-146a-5p promotes cell apoptosis by inducing mitochondrial damage in human lens epithelial cells via targeting of Notch2
- 中国医科大学学报, 2022, 51(11): 1003-1008
- Journal of China Medical University, 2022, 51(11): 1003-1008
-
文章历史
- 收稿日期:2022-02-04
- 网络出版时间:2022-11-04 13:51
随着人口老龄化的日益严重,白内障的发生率逐年递增,已经成为影响老年人健康的严重问题[1]。白内障的发生、发展机制复杂,与多种生理进程密切相关,还与周围环境暴露和表观遗传有关[1]。微RNA (microRNA,miRNA) 对基因表达的调控是一种表观遗传调控机制。miRNA是短片段的非编码RNA序列,长度约为20~22个碱基序列。研究[2]报道,晶状体和白内障晶状体样本的中央上皮的miRNA表达谱不同,表明不同表达的miRNA可能在晶状体发育和白内障发生中发挥作用。
miR-146a-5p是miR-146家族的成员,miR-146a是最新研究热点之一,在多个物种中高度保守,人miR-146a位于5号染色体LOC285628基因的第2个外显子上[3]。miR-146a-5p主要参与调控细胞的增殖、凋亡、分化和细胞发育[4-6]。胃癌、肺癌和前列腺癌中,miR-146a-5p水平低于癌旁组织。miR-146-5p可以调控食管鳞状细胞上皮-间质转化,通过直接与Notch2的3’非翻译区(3’-untranslated region,3’-UTR) 靶向结合,抑制Notch2的表达,从而发挥作用[7]。然而,关于miR-146a-5p在年龄相关性白内障中作用的研究很少。本研究探讨了miR-146a-5p对人晶状体上皮细胞(human lens epithelial cell,HLEC) 凋亡的调控作用,采用实时定量PCR (real-time quantitative PCR,qRT-PCR) 检测白内障患者晶状体上皮组织中miR-146a-5p的表达,确定miR-146a-5p为潜在的疾病生物标志物;建立体外细胞模型,通过过表达miR-146a-5p,探讨其对细胞凋亡的影响以及线粒体相关蛋白的变化;并进一步验证miR-146a-5p对Notch2 3’-UTR的靶向调控作用,以及miR-146a-5p对Notch2下游蛋白表达的影响。
1 材料与方法 1.1 研究对象采集2018年12月至2020年10月间我院收治的白内障患者的晶状体上皮样本,通过完整的连续环形撕囊术获得晶状体上皮。所有患者均接受完整的术前眼科检查,除年龄相关性白内障外无其他眼部疾病。根据晶状体混浊分级系统Ⅲ的修订版本,对白内障的类型和严重程度进行分级和记录。选择CN 4~6分、C 4~5分和P 4~5分(C,皮质性混浊;N,晶状体核混浊;P,后囊下性混浊) 的15例患者晶状体为白内障组,患者年龄60~70岁,其中男8例,女7例。收集我院眼科眼库新鲜人眼晶状体上皮样本15例为对照组,患者年龄55~65岁,其中男9例,女6例。本研究通过我院伦理委员会的批准,所有患者均签署知情同意书。
1.2 qRT-PCR采用qRT-PCR检测组织或细胞中miR-146a-5p的表达水平。应用miRNeasy试剂盒(德国QIAGEN公司) 从总RNA中分离miRNA,并应用1 μg RNA和Prime Script RT试剂盒(日本TaKaRa公司) 进行反转录,以U6为内参。使用SYBR Premix Ex Taq (日本TaKaRa公司) 对特定产物进行3次扩增和检测,并对数据进行分析。PCR反应条件:95 ℃预变性反应15 min,94 ℃变性反应15 s,55 ℃退火反应30 s,70 ℃延伸反应30 s,40个循环反应。
采用qRT-PCR检测NDUFS8、SDHb、COX5b、ATP5a1 mRNA的表达水平,以β-actin为内参,TRIzol法提取RNA后,反转录为cDNA。PCR反应条件:95 ℃预变性3 min,95 ℃变性反应5 s,56 ℃退火反应30 s,72 ℃延伸反应30 s,40个循环反应。应用2-ΔΔCt法计算各组间mRNA的相对表达水平。
1.3 细胞培养和转染HLEC细胞系SRA01/04购自美国ATCC公司。在含有10%胎牛血清的DMEM培养基中,37 ℃、5%CO2条件下培养。将miR-146a-5p mimics和miR-146a-5p NC (中国上海生工股份有限公司) 转染到细胞中,采用Lipofectamine 2000转染试剂进行转染,转染24 h后采用qRT-PCR检测miR-146a-5p水平。
1.4 细胞凋亡检测采用Annexin V-FITC/PI凋亡检测试剂盒(美国eBioscience公司),将转染miR-146a-5p mimics和miR-146a-5p NC的细胞在转染后48 h进行细胞凋亡检测。按照试剂盒说明书,将转染48 h后的SRA01/04细胞1 000 g离心10 min,用预冷的PBS清洗,并重新悬浮在250 μL结合缓冲液中。将细胞与Annexin V-FITC和PI在室温下黑暗中孵育15 min,随后用流式细胞仪(美国BD公司) 进行分析。采用ImageJ软件分析细胞凋亡情况。
1.5 Western blotting检测将消化后的SRA01/04细胞在放射免疫沉淀法裂解缓冲液中4 ℃裂解30 min。使用线粒体分离试剂盒(美国赛默飞公司) 分离线粒体,蛋白定量、蛋白变性后,取30 μg蛋白在10%SDS-PAGE中分离,然后转移到PVDF膜上,4 ℃下与caspase 9、caspase 12、细胞色素c (cytochrome c,Cyt c)、Notch2、Hey1、GAPDH抗体孵育过夜;与HRP标记的二抗结合后,采用ECL Plus化学发光试剂盒(美国GE医疗公司) 检测,采用ImageJ软件进行灰度值分析。
1.6 活性氧(reactive oxygen species,ROS) 检测将转染miR-146a-5p mimics和miR-146a-5pNC的胞,使用2',7’-二氯二氢荧光素-二乙酸酯(DCFH-DA,美国Sigma公司) 对细胞产生的ROS进行定量。细胞与10.0 μmol/L DCFH-DA在37 ℃下孵化30 min。采用荧光电镜观察细胞内荧光强度变化,拍照后,采用ImageJ软件计算ROS水平。
1.7 生物信息学预测和双荧光素酶报告基因实验采用TargetScan生物信息学网站(https://www.targetscan.org/vert_42/) 预测miR-146a-5p靶点。采用双荧光素酶报告基因实验进行验证,用含有10%胎牛血清的DMEM培养HEK293T细胞。将Notch2 mRNA的野生型3’-UTR片段以及含有预测miR-146a-5p结合序列或无预测序列的miR-NC结合序列的构建体克隆到psiCHECK2荧光素酶报告载体中(美国Promega公司),分别为Notch2 3’-UTR WT+miR-146a-5p组和Notch2 3’-UTR WT+miR-NC组。携带Notch2 mRNA的3’-UTR突变片段以及结合序列的miR-NC也被克隆到psiCHECK2荧光素酶报告载体中,分别为Notch2 3’-UTR MUT+miR-146a-5p组和Notch2 3’-UTR MUT+miR-NC组。将HEK293T细胞接种在24孔板中,用FuGENE 6 (美国Promega公司) 与10 μmol/L miR-146a-5p或miR-NC和2.5 μg psiCHECK2载体共同转染,该载体含有Notch2 3’-UTR的突变或野生预测片段。扩增子被插入到荧光素酶报告基因的cDNA下游载体中。转染48 h后,使用双荧光素酶报告系统(美国Promega公司),自动微孔板测定仪测量相对荧光素酶表达,并计算活性值。
1.8 统计学分析采用SPSS 21.0进行统计分析。数据以x±s表示,2组间比较采用非配对t检验,多组间比较采用单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 miR-146a-5p在白内障患者晶状体上皮中表达上调与对照组相比,白内障组miR-146a-5p表达明显上调(P < 0.05),见图 1。
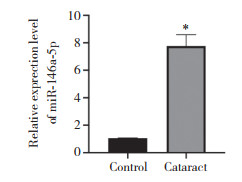
|
| * P < 0.05 vs control group. 图 1 qRT-PCR检测白内障组和对照组晶状体上皮中miR-146a-5p的表达 Fig.1 Expression of miR-146a-5p in lens epithelial samples of cataract patients and control subjects detected by qRT-PCR |
2.2 miR-146a-5p促进SRA01/04细胞的凋亡
qRT-PCR结果(图 2A) 显示,miR-146a-5p mimics转染SRA01/04细胞后,miR-145a-5p处于过表达状态。Annexin V和PI双染色结果(图 2B) 显示,miR-146a-5p过表达增加了SRA01/04细胞的早期和晚期凋亡水平。检测转染后细胞中caspase 9和caspase 12表达的变化,结果(图 2C) 显示,与miR-146a-5p NC组相比,miR-146a-5p mimics组细胞中caspase 9表达水平显著增高(P < 0.05),但caspase 12表达变化的差异无统计学意义(P > 0.05)。上述结果表明,线粒体功能紊乱是miR-146a-5p调控的第一步,通过caspase 9的激活引发miR-146a-5p诱导的细胞凋亡。
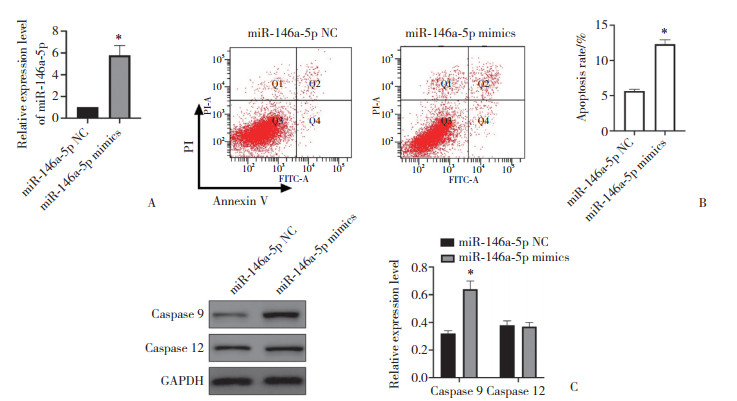
|
| A,expression of miR-146a-5p following transfection of miR-146a-5p mimics into SRA01/04 cells detected by qRT-qPCR;B,SRA01/04 cell apoptosis detected by flow cytometry;C,expression of caspases 9 and 12 detected by Western blotting. * P < 0.05 vs miR-145a-5p NC group. 图 2 miR-146a-5p模拟物促进SRA01/04细胞凋亡 Fig.2 miR-146a-5p mimics promotes apoptosis in lens epithelial SRA01/04 cells |
2.3 miR-146a-5p通过诱导线粒体功能紊乱促进SRA01/04细胞凋亡
miR-146a-5p mimics转染SRA01/04细胞后,MMP-2和MMP-9表达均下调(图 3A),表明miR-146a-5p mimics引发MMP蛋白破坏。进一步分离各组细胞中的线粒体和细胞质,Western blotting结果(图 3B) 显示,miR-146a-5p过表达导致Cyt c从线粒体转移到细胞质。miR-146a-5p NC或miR-146a-5p mimics转染SRA01/04细胞48 h后,qRT-PCR结果(图 3C) 显示,与miR-146a-5p NC组相比,miR-146a-5p mimics组细胞中NDUFS8、COX5b和ATP5a1 mRNA的表达水平显著下调(P < 0.05),表明线粒体电子运输链被增强的miR-146a-5p表达阻断。同时免疫荧光结果(图 3D) 显示,与miR-146a-5p NC组相比,miR-146a-5p mimics组细胞中ROS水平下降。结果证实,miR-146a-5p过表达可能促进HLEC中ROS的释放,激活氧化应激反应。
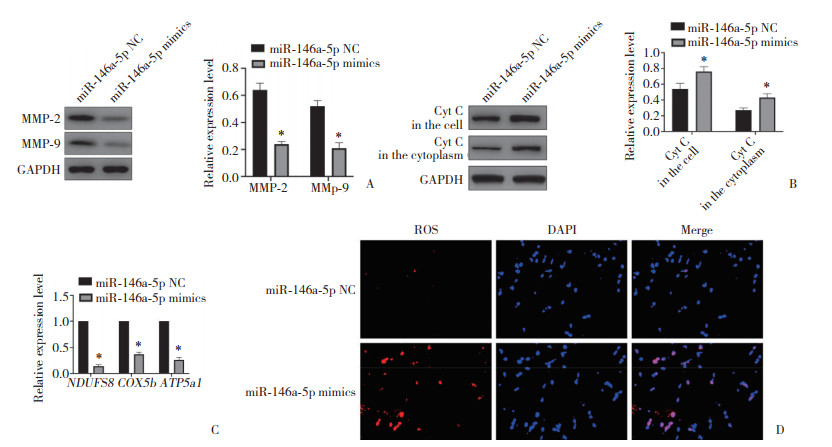
|
| A,MMP-2 and MMP-9 detected by Western blotting;B,cytochrome c detected by Western blotting;C,the levels of NDUFS8,COX5b and ATP5a1 mRNA detected by qRT-PCR;D,ROS detected by immunofluorescence staining (×200). * P < 0.05 vs miR-145a-5p-NC group. 图 3 miR-146a-5p通过诱导线粒体功能紊乱促进SRA01/04细胞凋亡 Fig.3 miR-146a-5p promotes the apoptosis of SRA01/04 cells by inducing mitochondrial dysfunction |
2.4 Notch2是miR-146a-5p的功能靶点
TargetScan网站预测分析结果(图 4A) 显示,Notch2 3’-UTR中部分核苷酸序列能与miR-146a-5p特异性互补配对。双荧光素酶报告基因实验(图 4B) 发现,与miR-146a-5p NC组相比,miR-146a-5p mimics组Notch2 3’-UTR WT载体的荧光素酶相对活性显著降低(P < 0.05),而Notch2 3’-UTR MUT荧光素酶相对活性无统计学差异(P > 0.05),结果表明,miR-146a-5p NC不影响突变体构建中的荧光素酶活性。Western blotting结果(图 4C) 证实,与miR-146a-5p NC组相比,miR-146a-5p mimics组Notch2的表达明显下调(P < 0.05)。
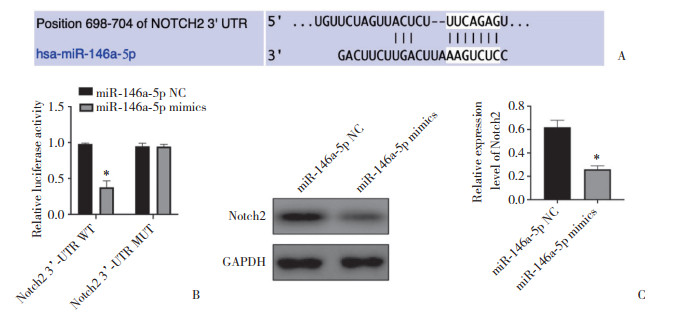
|
| A,miR146a-5p binding sequence of Notch2 predicted by TargetScan website;B,the results of luciferase reporter gene assay show miR-146a-5p targets Notch2;C,expression of Notch2 after miR-146a-5p transfected into lens epithelial SRA01/04 cells detected by Western blotting. * P < 0.05 vs miR-145a-5p NC group. 图 4 miR-146a-5p靶向结合Notch2的3’-UTR并下调Notch2的表达 Fig.4 miR-146a-5p specifically targets the 3'-UTR of Notch2 and reduces its expression |
2.5 miR-146a-5p对Notch2信号通路下游蛋白的影响
与miR-146a-5p NC组相比,miR-146a-5p mimics组SRA01/04细胞中Hey1蛋白表达明显下调(P < 0.05)。见图 5。

|
| A,expression of Hey1 detected by Western blotting;B,gray value of protein bands. * P < 0.05 vs miR-145a-5p-NC group. 图 5 Western blotting检测Hey1蛋白的表达水平 Fig.5 Expression of Hey1 protein detected by Western blotting |
3 讨论
白内障是致盲的主要原因之一,与衰老过程密切相关。近期有研究报道,miR-146a-5p过表达能够激活前列腺癌[4]和非小细胞肺癌[3]细胞凋亡,并引发细胞周期阻滞。同时,miR-146a-5p通过靶向调控Notch2的水平,影响心肌缺血再灌注大鼠的心肌损伤[8]。此外,miR-146a在多种细胞和组织中调控慢性炎症反应[9],而慢性炎症可诱发机体的氧化损伤、DNA损伤和干细胞衰老,这些均与加速衰老密切相关[10]。基于上述研究报道,本研究通过qRT-PCR发现,miR-146a在年龄相关性白内障晶状体上皮中表达上调。
大量研究[11]证实,多种因素与白内障的发生和发展密切相关,包括糖尿病、紫外线过量照射、不良药物使用和其他眼部疾病等。上述疾病因素中,氧化应激和由氧化应激产生的ROS被认为是白内障的主要易感因素。LI等[12]的研究表明,晶状体上皮细胞凋亡是哺乳动物非先天性白内障发生的特性表型。因此,本研究检测miR-146a-5p过表达的HLEC中的凋亡生物标志物和细胞功能,结果表明,miR-146a-5p通过线粒体功能障碍激活HLEC凋亡,包括阻断电子传递、形成ROS,进一步将Cyt c释放到细胞质中,并触发caspase 9激活。
为了鉴定miR-146a-5p的靶基因,本研究采用TargetScan靶预测工具,预测Notch2是miR-146a-5p的靶基因,并通过荧光素酶报告基因实验进一步验证了miR-146a-5p与Notch2的3’-UTR特异性结合,同时Western blotting结果证实miR-146a-5p与Notch2的表达呈负相关。1991年和1997年,WEINMASTER等[13]证实Notch受体分别在果蝇和发育中的大鼠眼睛中表达。对出生后大鼠晶状体上皮细胞分化进行的体外研究结果表明,在成纤维细胞生长因子依赖的次级纤维细胞分化过程中,Notch2信号被激活,但未检测到相应的Notch1激活。Notch2条件突变小鼠表现出严重的小眼畸形、纤维细胞形态破坏和白内障表型[14]。由此可见,Notch2突变和表达下调是白内障产生的主要原因之一。Hey1是Notch信号通路下游重要的调控蛋白,与胚胎血管形成有关[15]。本研究除发现miR-146a-5p抑制Notch2表达外,还发现Notch2下游的重要调控蛋白Hey1明显下调,进一步证实miR-146a-5p对Notch2信号通路的抑制作用。
综上所述,miR-146a-5p在白内障患者晶状体上皮组织中表达上调,其过表达能够促进HLEC凋亡,其作用机制与影响线粒体稳态和下调Notch2信号通路密切相关。
| [1] |
陈淑莹, 王开杰, 万修华. 人工智能在白内障诊断和分级中的应用[J]. 国际眼科纵览, 2021, 45(3): 231-236. |
| [2] |
FAN F, ZHUANG J, ZHOU P, et al. microRNA-34a promotes mitochondrial dysfunction-induced apoptosis in human lens epithelial cells by targeting Notch2[J]. Oncotarget, 2017, 8(66): 110209-110220. DOI:10.18632/oncotarget.22597 |
| [3] |
NAKASA T, MIYAKI S, OKUBO A, et al. Expression of microRNA-146 in rheumatoid arthritis synovial tissue[J]. Arthritis Rheum, 2008, 58(5): 1284-1292. DOI:10.1002/art.23429 |
| [4] |
LI YL, WANG J, ZHANG CY, et al. MiR-146a-5p inhibits cell proliferation and cell cycle progression in NSCLC cell lines by targeting CCND1 and CCND2[J]. Oncotarget, 2016, 7(37): 59287-59298. DOI:10.18632/oncotarget.11040 |
| [5] |
SUN Q, ZHAO X, LIU X, et al. miR-146a functions as a tumor suppressor in prostate cancer by targeting Rac1[J]. Prostate, 2014, 74(16): 1613-1621. DOI:10.1002/pros.22878 |
| [6] |
BLEAU AM, REDRADO M, NISTAL-VILLAN E, et al. miR-146a targets c-met and abolishes colorectal cancer liver metastasis[J]. Cancer Lett, 2018, 414: 257-267. DOI:10.1016/j.canlet.2017.11.008 |
| [7] |
WANG C, ZHANG WX, ZHANG L, et al. miR-146a-5p mediates epithelial-mesenchymal transition of oesophageal squamous cell carcinoma via targeting Notch2[J]. Br J Cancer, 2016, 115(12): 1548-1554. DOI:10.1038/bjc.2016.367 |
| [8] |
PRICE NL, GOMES AP, LING AJY, et al. SIRT1 is required for AMPK activation and the beneficial effects of resveratrol on mitochondrial function[J]. Cell Metab, 2012, 15(5): 675-690. DOI:10.1016/j.cmet.2012.04.003 |
| [9] |
牛丹丹, 刘振, 李方方. miR-146a-5p通过调控Notch2表达对心肌缺血再灌注模型大鼠心肌损伤的影响[J]. 中国免疫学杂志, 2020, 36(5): 530-537. DOI:10.3969/j.issn.1000-484X.2020.05.004 |
| [10] |
YE EA, STEINLE JJ. miR-146a attenuates inflammatory pathways mediated by TLR4/NF-κB and TNFα to protect primary human retinal microvascular endothelial cells grown in high glucose[J]. Mediators Inflamm, 2016, 2016: 3958453. DOI:10.1155/2016/3958453 |
| [11] |
BEKTAS A, SCHURMAN SH, SEN R, et al. Aging, inflammation and the environment[J]. Exp Gerontol, 2018, 105: 10-18. DOI:10.1016/j.exger.2017.12.015 |
| [12] |
LI WC, KUSZAK JR, DUNN K, et al. Lens epithelial cell apoptosis appears to be a common cellular basis for non-congenital cataract development in humans and animals[J]. J Cell Biol, 1995, 130(1): 169-181. DOI:10.1083/jcb.130.1.169 |
| [13] |
WEINMASTER G, ROBERTS VJ, LEMKE G. A homolog of Drosophila Notch expressed during mammalian development[J]. Development, 1991, 113(1): 199-205. DOI:10.1242/dev.113.1.199 |
| [14] |
SARAVANAMUTHU SS, GAO CY, ZELENKA PS. Notch signaling is required for lateral induction of Jagged1 during FGF-induced lens fiber differentiation[J]. Dev Biol, 2009, 332(1): 166-176. DOI:10.1016/j.ydbio.2009.05.566 |
| [15] |
FISCHER A, SCHUMACHER N, MAIER M, et al. The Notch target genes Hey1 and Hey2 are required for embryonic vascular development[J]. Genes Dev, 2004, 18(8): 901-911. DOI:10.1101/gad.291004 |
 2022, Vol. 51
2022, Vol. 51




