文章信息
- 郭明明, 贺琳晰, 杨妮
- 9例丙酸血症患儿临床、基因特点及随访观察
- Genetic features and clinical course of propionic academia: a case series of nine children
- 中国医科大学学报, 2022, 51(10): 951-954
- Journal of China Medical University, 2022, 51(10): 951-954
-
文章历史
- 收稿日期:2021-09-03
- 网络出版时间:2022-10-01 7:45
丙酸血症(propionic acidemia,PA)是一种常染色体隐性遗传病,由丙酰辅酶A羧化酶(propionyl CoA carboxylase,PCC)活性缺乏引起,发病率因地区不同存在差异,国外报道为1/10万~2/10万[1],我国尚无全国发病率的报道,但部分地区筛查提示发病率为0.5/10万~0.7/10万[2-3]。丙酰辅酶A是必需氨基酸异亮氨酸、缬氨酸、苏氨酸、蛋氨酸和奇链脂肪酸代谢的中间产物,通过转化为甲基丙二酰辅酶A等最终经三羧酸循环代谢[4]。PCC位于线粒体内,是催化丙酰辅酶A生成甲基丙二酰辅酶A的关键酶,由α和β 2个亚基组成,并分别由PCCA和PCCB基因编码,任何一个基因的双等位突变均可引起PCC活性降低,体内丙酰辅酶A及旁路途径产生的丙酸、3-羟基丙酸、甲基枸橼酸等积蓄,从而导致PA的发生。PA患儿临床表现多样,从多系统受累至单纯的心肌病均可发生[5],缺乏特异性,病死率和致残率高,早期诊断和及时治疗是改善预后的关键。本文对我院小儿重症监护病房确诊的9例PA患儿的临床表现、基因型特点及预后随访进行报道,以提高对本病的认识。
1 材料与方法 1.1 研究对象选取2015年1月至2020年12月于中国医科大学附属盛京医院小儿重症监护病房住院并确诊的PA患儿共9例,其中,男5例,女4例,发病年龄20 d~11岁。
1.2 诊断标准所有患儿符合以下诊断标准[6]:(1)气相色谱质谱仪尿有机酸分析中,丙酸、3-羟基丙酸、甲基枸橼酸升高;(2)液相色谱-串联质谱仪血液氨基酸、游离肉碱及酰基肉碱谱分析中,丙酰肉碱(propionyl carnitine,C3)浓度 > 5.0 μmol/L,且C3与乙酰肉碱(acetylcarnitine,C2)比值> 0.25;(3)基因检测最终确认存在PCCA或PCCB双等位基因突变。
1.3 研究方法回顾性分析患儿的病史及临床资料,根据发病年龄,分为早发型(发病年龄≤3个月)及晚发型(发病年龄 > 3个月)[7]。自患儿出院1个月开始,每3~6个月进行电话随访,随访时间最短1个月,最长3年。所有患儿完善血常规、尿常规、血气分析、血氨、血乳酸、血糖、肝肾功能、心肌酶及颅脑磁共振成像检查,同时取患儿及其父母外周静脉血进行基因检测。所有检查均已获得患儿家长知情同意。
2 结果 2.1 一般资料9例患儿中,3例为早发型,6例为晚发型。3例早发型患儿中,2例以呕吐伴嗜睡为首发症状,1例以频繁抽搐伴嗜睡为首发症状。6例晚发型患儿中,3例以发热伴嗜睡/意识障碍为首发症状,3例以呕吐伴意识障碍为首发症状。所有患儿发病前均无明显智力及运动发育迟缓表现。见表 1。
| 编号 | 性别 | 发病年龄 | 确诊年龄 | 首发症状 | 末次随访 | 随访结果 |
| 1 | 男 | 3个月 | 4个月 | 呕吐伴嗜睡2 d | 30个月后 | 死亡 |
| 2 | 男 | 11岁 | 11岁 | 呕吐1次,意识障碍7 h | 2年后 | 心肌病 |
| 3 | 女 | 6岁 | 6岁 | 呕吐2 d,抽搐伴意识障碍1 d | 1个月 | 死亡 |
| 4 | 男 | 4岁 | 4岁 | 呕吐5 d,意识障碍1 d | 3年后 | 发育迟缓 |
| 5 | 女 | 1个月 | 2个月 | 呕吐4 d,嗜睡1 d | 1年后 | 死亡 |
| 6 | 男 | 3岁 | 4岁 | 发热5 d,意识障碍伴抽搐3 d | 2年后 | 死亡 |
| 7 | 男 | 20 d | 2个月 | 抽搐2周,加重伴嗜睡1周 | 6个月后 | 死亡 |
| 8 | 女 | 6岁 | 6岁 | 发热3 d,嗜睡7 d | - | 院内死亡 |
| 9 | 女 | 9个月 | 10个月 | 发热2 d,嗜睡1 d | 1年后 | 死亡 |
2.2 实验室检查
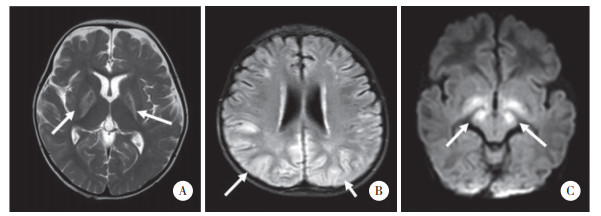
所有患儿血糖、血乳酸均未见异常;血常规5例正常,2例三系减少,1例粒细胞减少,1例血小板减少;血气分析3例代谢性酸中毒(pH 6.90~7.07),6例正常;除1例患儿血氨正常外,余8例血氨均升高(49.5~409.5 μmol/L,中位数为180.85 μmol/L,正常值:9~33 μmol/L)。除1例患儿颅脑磁共振正常,余8例均有异常,其中7例基底节区异常(4例仅苍白球受累,3例苍白球及尾状核均受累),4例皮层受累,3例丘脑受累,2例脑干受累,1例小脑受累(表 2、图 1)。1例患儿心脏彩超示左心室运动普遍稍弱,余8例正常。9例患儿C3为10.66~49.33 μmol/L,中位数为21.56 μmol/L(正常值0.5~5 μmol/L);C3/ C2为0.4~ 5.52,中位数为1.32(正常值0~0.25);3-羟基丙酸为2.6~995.2,中位数为77.15(正常值0~1.1)。
| 编号 | 血常规 | 血气 | 血氨(μmol/L) | 颅脑磁共振 |
| 1 | 三系减少 | 正常 | 211.3 | 右枕部长T1、长T2信号 |
| 2 | 正常 | 正常 | 正常 | 正常 |
| 3 | 正常 | 代谢性酸中毒 | 150.4 | 双大脑半球、基底节、丘脑、小脑齿状核、脑干DWI高信号 |
| 4 | 正常 | 代谢性酸中毒 | 240.2 | 双基底节长T2信号,flair高信号 |
| 5 | 三系减少 | 正常 | 256.5 | 双侧基底节、丘脑对称性DWI高信号 |
| 6 | 粒细胞减少 | 正常 | 75.4 | 双侧基底节对称性长T2信号 |
| 7 | 血小板减少 | 正常 | 409.5 | 双侧额叶皮层、基底节、丘脑、大脑脚DWI高信号 |
| 8 | 正常 | 正常 | 49.5 | 双侧额、顶叶皮层、基底节长T2信号,DWI高信号 |
| 9 | 正常 | 代谢性酸中毒 | 102.2 | 双基底节斑片状长T1、长T2信号,DWI高信号 |
|
| A,T2W示基底节区受累;B,T2 Flair示额叶或顶枕叶皮层受累;C,DWI示基底节/丘脑或丘脑/大脑脚受累. 图 1 PA患儿颅脑磁共振结果 |
2.3 基因检测结果分析
9例患儿均为复合杂合突变,未见纯合突变,其中,PCCA基因突变3例,PCCB基因突变6例。共发现基因突变19种,其中,错义突变12种,移码突变3种,无义突变2种,剪切突变2种。19种突变中16种为点突变(16/19,84.2%),2种插入突变,1种缺失突变。19种突变中10种为新发现的突变,9种为已知突变。见表 3。
| 编号 | 基因 | 外显子/内含子 | 突变位点 | 突变类型 | 是否报道 | |
| 等位基因(父源) | 等位基因(母源) | |||||
| 1 | PCCA | Ex2 | c.131G > T | - | 错义 | 否 |
| PCCA | Ex2 | c.129_c.130insTA | - | 移码 | 否 | |
| PCCA | Int22 | - | c.2041-1G > C | 剪切 | 否 | |
| 2 | PCCA | Ex19 | c.1772T > C | - | 错义 | 是 |
| PCCA | Ex2 | - | c.151C > T | 错义 | 是 | |
| 3 | PCCA | Ex6 | c.451G > T | - | 无义 | 是 |
| PCCA | Ex10 | - | c.809T > C | 错义 | 否 | |
| 4 | PCCB | Ex11 | c.1200C > G | - | 错义 | 否 |
| PCCB | Ex1 | - | c.172C > T | 无义 | 否 | |
| 5 | PCCB | Ex12 | c.1288A > C | - | 错义 | 是 |
| PCCB | Ex13 | - | c.1339C > T | 错义 | 否 | |
| 6 | PCCB | Ex8 | c.834_c.835insC | - | 移码 | 是 |
| PCCB | Ex14 | - | c.1466T > C | 错义 | 否 | |
| 7 | PCCB | Ex8 | c.839delT | - | 移码 | 是 |
| PCCB | Ex12 | - | c.1283C > T | 错义 | 是 | |
| 8 | PCCB | Ex12 | c.1334C > G | - | 错义 | 否 |
| PCCB | Ex13 | - | c.1399C > T | 错义 | 否 | |
| 9 | PCCB | Ex2 | c.241G > A | - | 错义 | 是 |
| PCCB | Int7 | - | c.764-2A > G | 剪切 | 是 | |
2.4 随访及预后
患儿确诊后均建议限制天然蛋白,改为特殊配方奶粉/营养粉+少量天然蛋白方式喂养,同时建议口服左卡尼汀及监测血氨。3例早发型患儿中,1例因频繁抽搐,家属放弃特殊喂养,6个月后随访时已死亡,另外2例早发型患儿虽坚持特殊喂养,但仍于1~3年后因感染性疾病急性加重后死亡。6例晚发型患儿,1例院内死亡;1例确诊后即表示放弃治疗,1个月后随访时已死亡;2例家属坚持特殊喂养1~2年后因感染性疾病急性加重后死亡;1例患儿坚持特殊喂养3年,随访时仍生存,但存在严重发育迟缓(智力轻度异常,仅能独坐,不能站立);1例患儿入院时仅有心肌病表现,出院后间断限制天然蛋白饮食及口服辅酶Q10治疗,第2年随访时心功能未见恶化,亦无其他新发异常。
3 讨论PA是一种遗传性疾病,新生儿至成年期均可发病。早发型为PA的常见类型,多在新生儿期出现喂养困难、呕吐、肌张力下降、嗜睡等症状,实验室检查可见代谢性酸中毒、高氨血症等,如不及时诊断治疗,可迅速进展出现抽搐、昏迷等症状,此时即使治疗,也常会遗留后遗症,甚至死亡[8];本组9例患儿3例为早发型,其中1号及5号家属提供的病史中无喂养困难及肌张力异常,因呕吐后嗜睡,腰穿正常,血常规三系减少,遂完善血尿质谱检查确诊;7号以抽搐起病,抽搐1周后出现肌张力下降及嗜睡,因抽搐起病年龄早,临床特征与特发性癫痫不同,完善检查确诊。晚发型PA患儿发病前常无异常,多在感染、手术后等应激状态下出现代谢危象,引发嗜睡、昏迷、精神异常等症状,易被误诊为脑炎[9]。本组6例晚发型患儿住院时均无智力及运动发育障碍,于发热/呕吐后迅速出现意识障碍,完善腰穿检查正常,遂完善血尿质谱检查确诊;其中6号患儿确诊前1年也曾有发热抽搐伴意识障碍病史(伴血小板减少),当时诊断为“重症脑炎”。
神经系统损害是PA最常见的合并症,典型损伤常位于基底节、丘脑、皮层,此外还可出现小脑及白质病变等[10]。本组9例中8例颅脑磁共振异常,7例为基底节受累,说明基底节对称性损伤,可作为PA的线索。心肌损害也是PA的常见合并症,QT间期延长、心肌病及心力衰竭是PA患者常见的死亡原因[11]。2号患儿入院后实验室检查、颅脑磁共振均正常,因心电图QT间期延长,心脏彩超示左心室功能减弱,考虑心肌病,进一步行基因检查确诊,提示单独发生的心肌病也可能是PA的不典型临床表型[5]。此外,研究[12]报道,高氨血症、低血糖、代谢性酸中毒、血液系统异常(贫血、粒细胞及血小板减少)等也是PA的常见合并症,但本组9例患儿均无低血糖发生,代谢性酸中毒及血液系统异常的发生率也不高。目前HGMD数据库共报道了153种PCCA和138种PCCB基因突变,以错义或无义突变为主,其余为插入/缺失及剪切突变等。本组9例患儿共检出PCCA基因突变7种(4种为新发现的突变),PCCB基因突变12种(6种为新发现的突变),较高的新发现突变率说明PCCA及PCCB基因无热点突变区域[13]。而本组患儿的高死亡率也提示相较于基因型,临床表型、早期诊断及积极持续的治疗才是影响PA患儿预后的主要因素。
现阶段PA仍缺少特异性的治疗方法,急性期可短期终止蛋白质摄入,补液、纠酸,必要时采取血液净化治疗。长期治疗以限制蛋白质饮食为主,保证充足热量,配合不含异亮氨酸、缬氨酸、苏氨酸、蛋氨酸的特殊配方奶粉/米粉,补充微量元素及矿物质,保障患儿的生长发育,少量低蛋白天然饮食对预防必须氨基酸缺乏仍是必要的[14]。另外间断口服甲硝唑或新霉素可抑制肠源性丙酸产生,苯甲酸钠和氨甲酰谷氨酸可用于高氨血症的治疗。而对于饮食及药物控制不良的PA患儿,建议在发生永久性神经系统损害前进行肝移植手术[15]。
综上所述,PA患儿临床表现严重,预后不良,但随着新生儿筛查及基因诊断技术的发展,早期诊断和特殊饮食治疗为改善患儿的预后提供了条件。希望随着酶替代治疗技术的发展和新生儿筛查的普及,PA患儿的预后能够获得进一步改善。
| [1] |
MYLES JG, MANOLI I, VENDITTI CP. Effects of medical food leucine content in the management of methylmalonic and propionic acidemias[J]. Curr Opin Clin Nutr Metab Care, 2018, 21(1): 42-48. DOI:10.1097/MCO.0000000000000428 |
| [2] |
洪芳, 黄新文, 张玉, 等. 浙江省新生儿有机酸尿症筛查及随访分析[J]. 浙江大学学报(医学版), 2017, 46(3): 240-247. DOI:10.3785/j.issn.1008-9292.2017.06.03 |
| [3] |
韩凤, 鄂慧姝, 韩连书, 等. 质谱技术检测羊水代谢物对丙酸血症进行产前诊断[J]. 中华生殖与避孕杂志, 2017, 37(11): 918-922. DOI:10.3760/cma.j.issn.2096-2916.2017.11.011 |
| [4] |
WONGKITTICHOTE P, AH MEW N, CHAPMAN KA. Propionyl-CoA carboxylase-A review[J]. Mol Genet Metab, 2017, 122(4): 145-152. DOI:10.1016/j.ymgme.2017.10.002 |
| [5] |
LEE TM, ADDONIZIO LJ, BARSHOP BA, et al. Unusual presentation of propionic acidaemia as isolated cardiomyopathy[J]. J Inherit Metab Dis, 2009, 32 Suppl 1(1): S97-S101. DOI:10.1007/s10545-009-1084-1 |
| [6] |
BAUMGARTNER MR, HÖRSTER F, DIONISI-VICI C, et al. Proposed guidelines for the diagnosis and management of methylmalonic and propionic academia[J]. Orphanet J Rare Dis, 2014, 9: 130. DOI:10.1186/s13023-014-0130-8 |
| [7] |
SASS JO, HOFMANN M, SKLADAL D, et al. Propionic acidemia revisited: a workshop report[J]. Clin Pediatr (Phila), 2004, 43(9): 837-843. DOI:10.1177/000992280404300908 |
| [8] |
MANOLI I, VENDITTI CP. Disorders of branched chain amino acid metabolism[J]. Transl Sci Rare Dis, 2016, 1(2): 91-110. DOI:10.3233/TRD-160009 |
| [9] |
SHIBATA N, HASEGAWA Y, YAMADA K, et al. Diversity in the incidence and spectrum of organic acidemias, fatty acid oxidation disorders, and amino acid disorders in Asian countries: selective screening vs. expanded newborn screening[J]. Mol Genet Metab Rep, 2018, 16: 5-10. DOI:10.1016/j.ymgmr.2018.05.003 |
| [10] |
WONGKITTICHOTE P, AH MEW N, CHAPMAN KA. Propionyl-CoA carboxylase-A review[J]. Mol Genet Metab, 2017, 122(4): 145-152. DOI:10.1016/j.ymgme.2017.10.002 |
| [11] |
BAUMGARTNER D, SCHOLL-BÜRGI S, SASS JO, et al. Prolonged QTc intervals and decreased left ventricular contractility in patients with propionic academia[J]. J Pediatr, 2007, 150(2): 192-197. DOI:10.1016/j.jpeds.2006.11.043 |
| [12] |
BERNHEIM S, DESCHÊNES G, SCHIFF M, et al. Antenatal nephromegaly and propionic acidemia: a case report[J]. BMC Nephrol, 2017, 18(1): 110. DOI:10.1186/s12882-017-0535-4 |
| [13] |
KÖR D, SEKER-YILMAZ B, BULUT FD, et al. Clinical features of 27 turkish propionic acidemia patients with 12 novel mutations[J]. Turk J Pediatr, 2019, 61(3): 330-336. DOI:10.24953/turkjped.2019.03.003 |
| [14] |
FRASER JL, VENDITTI CP. Methylmalonic and propionic acidemias: clinical management update[J]. Curr Opin Pediatr, 2016, 28(6): 682-693. DOI:10.1097/MOP.0000000000000422 |
| [15] |
RELA M, BATTULA N, MADANUR M, et al. Auxiliary liver transplantation for propionic acidemia: a 10-year follow-up[J]. Am J Transplant, 2007, 7(9): 2200-2203. DOI:10.1111/j.1600-6143.2007.01899.x |
 2022, Vol. 51
2022, Vol. 51