文章信息
- 郑乔今, 任卫东
- Autostrain RV技术在系统性红斑狼疮患者右心室收缩功能评价中的应用
- Application of the Autostrain RV technique in the evaluation of right ventricular systolic function in patients with systemic lupus erythematosus
- 中国医科大学学报, 2022, 51(10): 940-943
- Journal of China Medical University, 2022, 51(10): 940-943
-
文章历史
- 收稿日期:2021-11-23
- 网络出版时间:2022-10-06 13:50
系统性红斑狼疮(systemic lupus erythematosus,SLE)是多脏器受累的自身免疫性疾病,免疫介导的炎症反应和代谢失调会加速心血管事件的发生[1]。SLE患者心血管疾病的发病率和死亡率明显高于正常人[2],因此尽早评价SLE患者的心脏功能显得尤为重要。由于右心室肌束较多、心内膜难以识别及解剖位置特殊[3],评价右心功能具有一定难度。Autostrain RV技术是飞利浦公司推出的一款结合强大定量软件TomTec的自动应变分析技术,可精准获取右心室边界,快速获得右心室整体纵向应变值,不仅具有无角度依赖性、图像信噪比高、敏感度高等优点,而且可自动识别心室心内膜边界,不需要繁杂的手动描绘,方便快捷。本研究利用Autostrain RV技术评估35例SLE患者的右心室收缩功能,取得显著效果。现报道如下:
1 材料与方法 1.1 临床资料与分组选取2021年3月至9月就诊于我院的35例SLE患者作为SLE组,其中男7例,女28例,年龄20~57岁,平均(33.5±9.1)岁。纳入标准:符合中华医学会风湿病学分会修订的SLE诊断标准[4],且患者处于病情稳定期(SLEDAI活动性评分 < 4)。排除标准:(1)患有其他免疫相关性疾病及慢性炎症疾病;(2)患有先天性心脏病、冠状动脉粥样硬化性心脏病、心肌病、心脏瓣膜病、心包疾病、慢性肺心病、心律失常或严重束支传导阻滞等可能影响右心功能的疾病;(3)患有糖尿病、高血压、高血脂或具有其他心脑血管病史;(4)患者吸烟、酗酒、行动不便及超声图像欠佳。同期选择30例健康志愿者作为对照组,男7例,女23例,年龄21~59岁,平均(33.2±9.9)岁。2组年龄、性别、体质量指数(body mass index,BMI)、体表面积(body surface area,BSA)、舒张压比较差异无统计学意义(均P > 0.05),而SLE组的收缩压明显高于对照组(P < 0.05)。见表 1。本研究获得医院医学伦理委员会批准(伦理编号:2021PS057K)。所有研究对象均知情同意。
| 分组 | 年龄(岁) | 男/女 | BMI(kg/m2) | BSA(m2) | 收缩压(mmHg) | 舒张压(mmHg) |
| SLE组 | 33.5±9.1 | 7/28 | 22.66±3.08 | 1.64±0.13 | 119.30±7.56 | 76.86±7.65 |
| 对照组 | 33.2±9.9 | 7/23 | 23.86±4.63 | 1.65±0.19 | 111.40±7.27 | 76.63±4.80 |
| t/χ2 | 0.145 | 0.106 | 1.250 | 0.476 | 4.280 | 0.139 |
| P | 0.885 | 0.745 | 0.216 | 0.636 | < 0.001 | 0.890 |
1.2 图像采集与分析
采用Philips EPIQ 7C及Philips iE33超声诊断仪,S5-1探头,频率1~5 MHz;配备Qlab 13.0工作站。受试者左侧卧位,平静呼吸,同步连接心电图,先行常规超声心动图检查,然后将探头聚焦于右心室连续采集3个心动周期心尖四腔心切面的动态图像,频率 > 50帧/s。
1.2.1 常规超声心动图参数按照中华医学会中国成年人超声心动图测量指南[5]于心尖四腔心切面获取右心室基底部横径(right ventricular base diameter,RVBD)、右心室中部横径(right ventricular mid diameter,RVMD)及三尖瓣环平面中点至右心室心尖之间的距离(right ventricular length,RVL),并通过右心室舒张末期面积和收缩末期面积计算出右心室面积变化率(fractional area change,FAC);M型超声测量三尖瓣环收缩期平面位移(tricuspid annular plane systolic excursion,TAPSE);通过测量三尖瓣反流压差计算出肺动脉收缩压(pulmonary artery systolic pressure,PASP);通过组织多普勒超声获取三尖瓣环收缩期峰值流速(S')。
1.2.2 二维应变参数将采集到的动态图像以DICOM格式导入到Qlab13.0工作站,采用Autostrain RV技术应用程序进行自动斑点追踪分析,并对右心室边界描记有偏差之处进行微调,获取右心室游离壁整体纵向应变(right ventricular free-wall longitudinal strain,RVFWSL)、右心室整体长轴应变(right ventricular global longitudinal strain,RVGLS;图 1)、右心室游离壁基底部纵向应变(longitudinal strain of the basal segment of right ventricular free wall,B-RVFWSL)、右心室游离壁中部纵向应变(longitudinal strain of the mid segment of right ventricular free wall,M-RVFWSL)及右心室游离壁心尖部纵向应变(longitudinal strain of the apical segment of right ventricular free wall,A-RVFWSL)。连续测量3次取平均值。
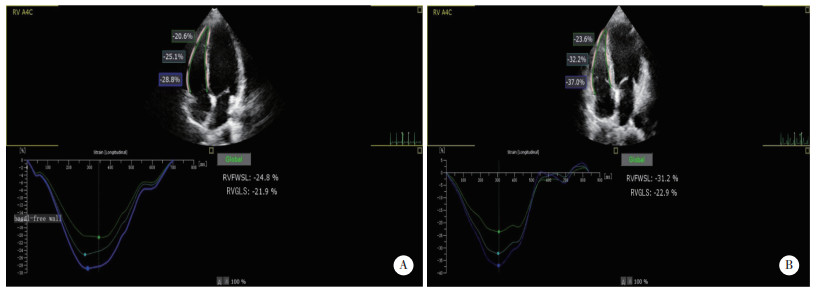
|
| A,SLE组,RVFWSL为-24.8%,RVGLS为-21.9%,右心室游离壁各节段达峰时间存在明显不一致;B,对照组,RVFWSL为-31.2%,RVGLS为-22.9%,右心室游离壁各节段达峰时间一致性好. 图 1 2组右心室整体长轴应变图 |
1.3 统计学分析
采用GraphPad Prism 8.0.1统计分析软件,计量资料采用x±s表示,组间比较采用独立样本t检验;计数资料以率(%)表示,组间比较采用χ2检验。P < 0.05为差异有统计学意义。
2 结果2组超声心动图结果显示,与对照组比较,SLE组TAPSE、FAC、S'均显著减小(均P < 0.05),PASP显著升高(P < 0.05),而2组RVBD、RVMD、RVL比较差异无统计学意义(均P > 0.05)。见表 2。与对照组比较,SLE组RVFWSL、RVGLS、B-RVFWSL、M-RVFWSL、A-RVFWSL绝对值均显著减小(均P < 0.05)。见表 3。
| 分组 | PASP(mmHg) | RVBD(mm) | RVMD(mm) | RVL(mm) | TAPSE(mm) | FAC(%) | S'(cm/s) |
| SLE组 | 25.19±6.21 | 31.89±4.78 | 26.83±4.30 | 56.77±6.10 | 22.60±2.77 | 40.75±5.06 | 13.02±1.95 |
| 对照组 | 21.93±4.74 | 31.67±3.80 | 27.03±2.94 | 58.20±7.98 | 24.27±3.39 | 45.27±5.38 | 14.09±2.04 |
| t | 2.349 | 0.202 | 0.220 | 0.817 | 2.181 | 3.487 | 2.146 |
| P | 0.022 | 0.840 | 0.826 | 0.417 | 0.033 | < 0.001 | 0.036 |
| PASP,肺动脉收缩压;RVBD,右心室基底部横径;RVMD,右心室中部横径;RVL,三尖瓣环平面中点至右心室心尖之间的距离;TAPSE,三尖瓣环收缩期平面位移;FAC,右心室面积变化率;S',三尖瓣环收缩期峰值流速. | |||||||
| 分组 | RVFWSL | RVGLS | B-RVFWSL | M-RVFWSL | A-RVFWSL |
| SLE组 | -26.44±7.46 | -21.71±5.09 | -26.54±18.81 | -21.95±14.59 | -19.70±12.78 |
| 对照组 | -30.35±3.67 | -24.42±2.59 | -35.38±6.09 | -28.64±3.81 | -26.31±5.13 |
| t | 2.610 | 2.637 | 2.464 | 2.437 | 2.656 |
| P | 0.011 | 0.011 | 0.017 | 0.018 | 0.010 |
| RVFWSL,右心室游离壁整体纵向应变;RVGLS,右心室整体长轴应变;B-RVFWSL,右心室游离壁基底部纵向应变;M-RVFWSL,右心室游离壁中部纵向应变;A-RVFWSL,右心室游离壁心尖部纵向应变. | |||||
3 讨论
研究显示,SLE相关的肺动脉高压是SLE患者常见的心血管并发症,是导致右心功能受损的重要原因[6]。SLE相关的右心功能损伤起病隐匿,早期临床症状不明显,常规超声心动图检查往往无特异性改变,因此若能在SLE患者出现肺动脉高压前准确监测右心室功能状态显得尤为重要。
右心室心肌纵向收缩泵血占整体右心每搏量的80%[7],临床上常用纵向心肌形变来反映整个右心室的收缩功能,而且室间隔主要属于左心室的组成部分,因此常通过右心室游离壁的纵向应变来反映右心室整体的纵向应变[8]。近年来随着超声技术的新进展,二维斑点追踪技术(two-dimensional speckle-tracking imaging,2D-STI)在临床中应用日渐成熟[9-10],已广泛用于早期心肌收缩功能评估。2015年,2D-STI纵向应变评价左心室收缩功能已纳入美国超声心动图学会指南[11]。传统的2D-STI需要手动描绘室壁边界,操作复杂,耗时较长,受操作者的主观影响较大;而自动识别右心室室壁的Autostrain RV技术可以精准快速分析出心肌整体长轴应变值,具有高效快捷、重复性好的优点。
本研究结果显示,2组右心室结构参数比较差异无统计学意义(均P > 0.05)。与对照组比较,SLE组TAPSE、FAC、S'均显著减小(均P < 0.05)、肺动脉收缩压显著升高(P < 0.05),说明SLE患者在右心室结构发生改变之前已存在右心功能损伤。另外,SLE组患者右心功能参数值均在正常值范围内,因此其早期右心室功能减低容易被忽视。本研究结果显示,与对照组比较,SLE组RVFWSL、B-RVFWSL、M-RVFWSL、A-RVFWSL及RVGLS绝对值均显著减小(均P < 0.05),提示SLE患者存在早期右心室收缩功能减低,这也说明Autostrain RV技术可以有效评估右心室收缩功能变化。
综上所述,SLE患者在未出现右心室结构改变及肺动脉压力升高时已经存在右心室收缩功能减低,Autostrain RV技术可以敏感地评估SLE患者右心室收缩功能情况,为临床的及时干预提供依据,因此具有良好的应用前景。本研究的不足之处:(1)样本较小,未排除患者病程等临床指标对数据的影响,可能存在偏倚;(2)缺乏对Autostrain RV技术的独立性检验,今后需进一步研究论证。
| [1] |
LIU YD, KAPLAN MJ. Cardiovascular disease in systemic lupus erythematosus: an update[J]. Curr Opin Rheumatol, 2018, 30(5): 441-448. DOI:10.1097/BOR.0000000000000528 |
| [2] |
FANOURIAKIS A, KOSTOPOULOU M, ALUNNO A, et al. 2019 update of the EULAR recommendations for the management of systemic lupus erythematosus[J]. Ann Rheum Dis, 2019, 78(6): 736-745. DOI:10.1136/annrheumdis-2019-215089 |
| [3] |
SANZ J, SÁNCHEZ-QUINTANA D, BOSSONE E, et al. Anatomy, function, and dysfunction of the right ventricle: jacc state-of-the-art review[J]. J Am Coll Cardiol, 2019, 73(12): 1463-1482. DOI:10.1016/j.jacc.2018.12.076 |
| [4] |
中华医学会风湿病学分会. 系统性红斑狼疮诊断及治疗指南中华医学会风湿病学分会[J]. 中华风湿病学杂志, 2010, 14(5): 342-346. DOI:10.3760/cma.j.issn.1007-7480.2010.05.016 |
| [5] |
中华医学会超声医学分会超声心动图学组. 中国成年人超声心动图检查测量指南[J]. 中华超声影像学杂志, 2016, 25(8): 645-666. DOI:10.3760/cma.j.issn.1004-4477.2016.08.001 |
| [6] |
JIA ET, GENG HL, LIU QP, et al. Cardiac manifestations of Han Chinese patients with systemic lupus erythematosus: a retrospective study[J]. Ir J Med Sci, 2019, 188(3): 801-806. DOI:10.1007/s11845-018-1934-7 |
| [7] |
CARLSSON M, UGANDER M, HEIBERG E, et al. The quantitative relationship between longitudinal and radial function in left, right, and total heart pumping in humans[J]. Am J Physiol Heart Circ Physiol, 2007, 293(1): H636-H644. DOI:10.1152/ajpheart.01376.2006 |
| [8] |
BADANO LP, KOLIAS TJ, MURARU D, et al. Standardization of left atrial, right ventricular, and right atrial deformation imaging using two-dimensional speckle tracking echocardiography: a consensus docu-ment of the EACVI/ASE/Industry Task Force to standardize deformation imaging[J]. Eur Heart J Cardiovasc Imaging, 2018, 19(6): 591-600. DOI:10.1093/ehjci/jey042 |
| [9] |
LUIS SA, PELLIKKA PA. Is speckle tracking imaging ready for prime time in current echo clinical practice?[J]. Prog Cardiovasc Dis, 2018, 61(5/6): 437-445. DOI:10.1016/j.pcad.2018.11.001 |
| [10] |
SADE LE. Speckle tracking strain imaging: practical approach for application[J]. Turk Kardiyol Dern Ars, 2017, 45(2): 197-205. DOI:10.5543/tkda.2017.24358 |
| [11] |
LANG RM, BADANO LP, MOR-AVI V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging[J]. Eur Heart J Cardiovasc Imaging, 2015, 16(3): 233-270. DOI:10.1093/ehjci/jev014 |
 2022, Vol. 51
2022, Vol. 51