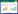文章信息
- 陈鹏, 唐少珊, 苏梦雪, 徐碧莹
- 肝结核误诊为肝转移癌2例报道并文献复习
- Hepatic tuberculosis misdiagnosed as hepatic metastasis: two cases report and literature review
- 中国医科大学学报, 2022, 51(10): 936-940
- Journal of China Medical University, 2022, 51(10): 936-940
-
文章历史
- 收稿日期:2021-11-01
- 网络出版时间:2022-10-01 7:35
结核病是一种由结核分枝杆菌感染引起的传染性疾病,是全球十大死亡原因之一[1]。肺外结核约占结核病例的16%[1],肝结核作为肺外结核的一种,可见于50%~100%接受尸检的结核患者中[2]。肝结核多为继发,可同时存在多种病理改变,缺乏典型的临床表现与体征,易被误诊为恶性肿瘤。本文报道了2例误诊为肝转移癌的肝结核病例的临床资料,并结合相关文献,归纳其临床特征及影像学表现。
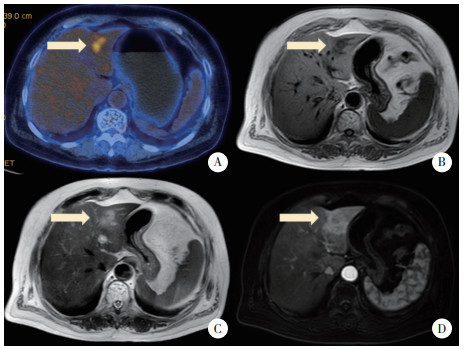
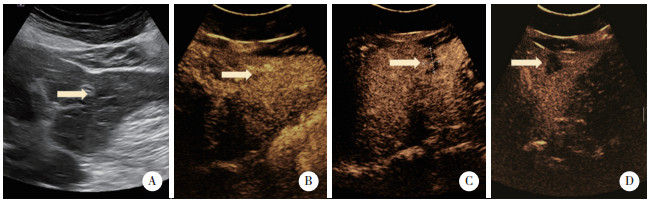
1 临床资料病例1,女,72岁,2020年7月以“发热5个月,发现肝占位性病变1月余”为主诉入院。患者5个月前无明显诱因发热,1个月前于外院行CT检查,提示肝内多发占位性病变,考虑转移癌可能性大。查体未见明显异常。既往史:否认肝炎及结核病史。实验室检查:癌胚抗原(carcinoembryonic antigen,CEA)6.40 ng/L,纤维蛋白原含量4.2 g/L,血常规、肝功能、肾功能、粪便常规、甲胎蛋白(alpha fetoprotein,AFP)、糖类抗原199-9(carbohydrate antigen 199-9,CA199-9)检查结果均正常。正电子发射计算机断层显像(positron emission tomography-computed tomography,PET-CT)显示:肝内多发18F-氟代脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)高代谢灶,符合恶性病变表现,不除外转移癌,见图 1A。回肠与结肠及其上方18F-FDG高代谢灶,炎症及生理性摄取可能性大。肝门区、肠系膜、腹膜后、右侧盆壁、髂血管旁及锁骨上多发18F-FDG高代谢淋巴结,不除外转移癌或炎症病变所致。为明确原发肿瘤,行纤维结肠镜检查,可见回盲部及升结肠多发白色瘢痕,管腔略变形,见多发溃疡性病变,较大者约环管腔1/4周,表面白苔,周围黏膜充血水肿,于较重处取组织病理活检。病理回报:黏膜炎症,伴肉芽肿性病变,建议除外结核。平扫+增强肝脏核磁共振成像(magnetic resonance imaging,MRI)显示:肝内多发长T1稍长T2信号结节,较大者位于肝S3段,大小约1.5 cm×2.7 cm,动脉相明显环形强化,门脉相环形强化增强,考虑肝转移癌可能性大,见图 1B、1C、1D。常规超声:肝左外叶S3段近肝表面隐约可见片状不均质灶,呈结节融合状,大小约1.2 cm×1.0 cm,边界欠清,形态欠规整。超声造影:经肘静脉团注SonoVue造影剂1.2 mL,病灶动脉相整体呈等增强,门脉相病灶内造影剂开始减退,逐渐呈低增强,范围约2.0 cm×1.5 cm,见图 2。肝左外叶S3段异常血流灌注区,性质待定,建议穿刺活检。行超声引导下肝左外叶异常回声区穿刺活检,病理回报为“肉芽肿性病变,倾向结核”,见图 3。穿刺后结核感染T细胞斑点试验结果阳性,C反应蛋白(C-reactive protein,CRP)10.20 mg/L。结核细菌抗体检测结果阴性。患者未经治疗后离院。于外院行异烟肼、利福平、乙胺丁醇药物治疗1个月后,体温恢复正常。
|
| A,PET-CT示肝左叶18F-FDG高代谢灶;B,MRI示肝左叶结节长T1信号;C,稍长T2信号;D,增强MRI示病灶动脉相明显环形强化. 图 1 病例1PET-CT及平扫+增强MRI图像 Fig.1 PET-CT, plain and contrast-enhanced MRI images of case 1 |
|
| A,常规超声示肝左叶片状不均质回声,呈结节融合状,边界欠清,形态欠规整;B,超声造影示病灶动脉相23 s整体呈等增强;C,门脉相1 min 22 s开始廓清;D,延迟相3 min 13 s呈低增强. 图 2 病例1常规超声及超声造影图像 Fig.2 Conventional ultrasound and contrast-enhanced ultrasound images of case1 |
|
| 图 3 病例1肝肿物病理图像HE ×40 Fig.3 Pathological image of the liver mass in case 1 HE ×40 |
病例2,女,56岁,2019年2月以“体检发现肝占位性病变15 d”为主诉入院。患者2018年8月于我院行诊断性刮宫术及腹腔镜下全子宫双侧附件切除术,病理回报子宫内膜腺癌。2019年1月于我院行全腹增强CT,提示肝顶部稍低密度影,转移癌可能性大,并出现右上腹间歇性隐痛,可自行缓解。查体未见明显异常。既往史:否认肝炎、结核病史。实验室检查:血常规、粪便常规、凝血功能、AFP、CEA、CA199检查结果均正常。平扫+增强CT:肝顶部不规则形稍低密度灶,大小约4.1 cm×1.2 cm,增强扫描动脉相见边缘强化,门脉相边缘强化增强,见图 4B、4C、4D。PET-CT:肝右叶膈顶部被膜下稍低密度灶,内部18F-FDG代谢增高,见图 4A。常规超声:肝右叶膈顶见片状低回声,呈结节融合状,大小约4.4 cm×2.5 cm,边界较清,形态欠规整。超声造影:经肘静脉团注SonoVue造影剂1.2 mL后,动脉相病灶整体呈等增强,34 s病灶内造影剂开始减退,逐渐呈低增强,考虑转移癌,见图 5。平扫+增强肝脏MRI:肝顶部不规则长T1稍长T2信号灶,范围约4.1 cm×2.0 cm×1.5 cm。增强扫描边缘可见强化,内部无强化,见图 6。所有影像学检查结果均提示转移癌。全麻下行肝部分切除术。病理检查光镜下见大片干酪样坏死,周边见类上皮细胞及少许多核巨细胞。免疫荧光染色:抗酸分枝杆菌荧光染色阴性。病理诊断:肝肉芽肿样病变,不除外结核,见图 7。术后结核抗体测定弱阳性,痰液结核细菌涂片检查未找到抗酸杆菌。术后16 d离院。抗结核药物治疗1年后复查全腹CT,提示肝部分切除术后改变,余所见同前,自行停药。
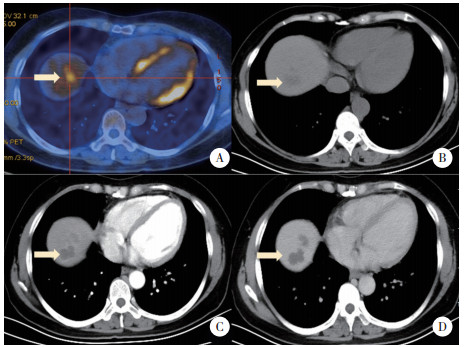
|
| A,PET-CT示肝顶部18F-FDG高代谢灶;B,CT平扫示肝顶部不规则形稍低密度灶;C,增强CT示病灶动脉相边缘强化;D,静脉相边缘强化增强. 图 4 病例2平扫+增强CT及PET-CT图像 Fig.4 Plain and contrast-enhanced CT and PET-CT images of case 2 |
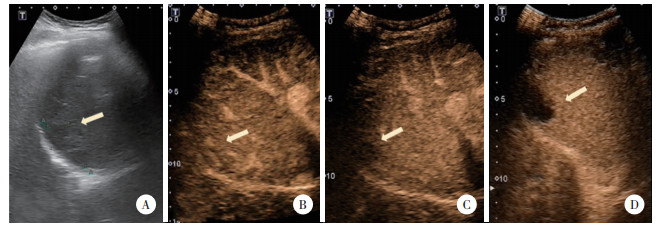
|
| A,常规超声示肝右叶膈顶部片状低回声,呈结节融合状,边界较清,形态欠规整;B,超声造影示病灶动脉相23 s呈等增强;C,动脉相晚期34 s开始廓清;D,门脉相1 min 31 s呈低增强. 图 5 病例2常规超声及超声造影图像 Fig.5 Conventional ultrasound and contrast-enhanced ultrasound images of case 2 |
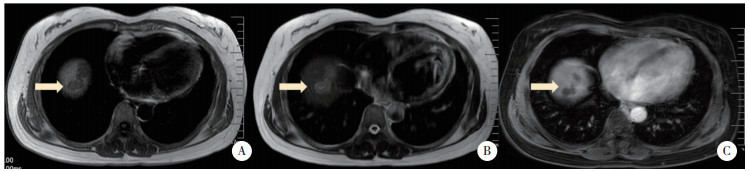
|
| A,MRI示肝顶部不规则长T1信号;B,稍长T2信号;C,增强MRI示病灶动脉相边缘强化,内部无强化. 图 6 病例2平扫+增强MRI图像 Fig.6 Plain and contrast-enhanced MRI images of case 2 |
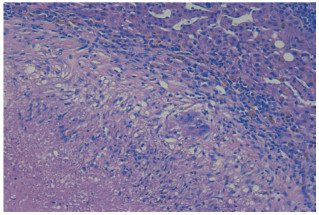
|
| 图 7 病例2术后病理图像HE×200 Fig.7 Postoperative pathological images of case 2 HE×200 |
2 讨论
肝结核多继发于肺结核或肠结核[3]。结核分枝杆菌感染肝脏主要通过肝动脉及门静脉,少数可通过淋巴系统或临近病灶直接感染肝脏[4]。肝脏血运丰富,含有大量具有强大吞噬及修复能力的单核吞噬细胞,同时胆汁可抑制结核分枝杆菌的生长,且肝脏的低氧环境不利于结核分枝杆菌的生长[5],因此,肝结核临床上罕见。当大量结核分枝杆菌入侵肝脏、机体免疫力低下、肝脏本身存在病变时易患肝结核[4]。肝结核的临床表现及体征缺乏特异性,可表现为低热、盗汗、右上腹痛、体质量减轻、肝肿大、黄疸等,实验室检查可出现贫血、血沉增快、肝功能轻度异常[6]。抗酸染色结核分枝杆菌检测、结核分枝杆菌聚合酶链反应、T细胞斑点试验检测的阳性结果有助于证实诊断[7]。肝结核的治疗方式多为药物治疗,也可行外科治疗切除病灶。
肝结核的主要病理改变为肉芽肿,处于不同阶段时可表现为干酪样坏死、液化坏死、纤维组织增生和钙化,多种病理改变可同时存在。肝结核影像学检查表现多样,与其病理改变一致。肝结核在CT平扫中多为低密度病灶;病理改变为肉芽肿时,CT增强病灶动脉期无强化或轻度强化,静脉期轻度强化,肉芽肿形成早期,炎症细胞浸润导致周围肝组织充血、水肿,CT增强常见病灶周围的“晕状”强化;发生干酪样或液化坏死时,CT增强表现为环形强化或无强化,同时可伴有附近肝实质的异常灌注[5]。在MRI检查中,肉芽肿早期T1呈低信号,T2呈高信号;纤维化期T1呈低信号,T2呈低信号,增强后边缘强化或不强化[8]。二维超声表现为多样化,呈高回声、低回声、混合回声、无回声、伴有声影的强回声。在未发生干酪样或液化坏死的肉芽肿早期,超声造影表现为动脉相的增强及延迟相的缓慢减退;当出现干酪样或液化坏死时,坏死区始终无增强,病灶周边炎症细胞或纤维组织增生,动脉期或门脉期表现为结节状或环状高增强[9]。肝结核在PET-CT显像中的表现与肝恶性肿瘤相似,也可有18F-FDG的摄取[10]。
肝结核尚无统一的分类标准,原发性肝结核指肝脏感染结核杆菌的同时不伴有肝外结核,占所有结核病例的不足1% [10]。REED等[11]将肝结核分类为血行播散继发型肝结核、原发性粟粒型肝结核、原发性肝结核瘤或结核性肝脓肿。病例1影像学检查提示肝内多发占位性病变,穿刺活检病理回报为肝结核,T细胞斑点试验结果阳性,抗结核治疗有效,同时存在肠结核,该病例属于血行播散继发型结核。病例2影像学检查提示肝占位性病变,未发现肝外结核,病理诊断为肝结核,结核抗体检测弱阳性,该病例属于原发性肝结核瘤。2例患者误诊为肝转移癌可能原因如下:(1)临床表现、体征及实验室检查结果不典型:病例1除不明原因发热外无其他阳性体征,实验室检查仅CEA升高;病例2右上腹间歇性隐痛、轻度压痛,皮肤黏膜黄染,实验室检查结果均正常;(2)肝内存在多发病灶或曾有恶性肿瘤史,影像学检查不能除外恶性肿瘤;(3)肝结核罕见,临床医师对其认识不足。
综上所述,肝结核临床表现与体征不典型,当既往有结核病史,存在肝外结核病灶,出现不明原因发热、右上腹痛、食欲下降、体质量减轻、黄疸,提示肝结核可能;影像学检查表现多样,与肝结核病理改变相一致,其中超声造影可实时动态观察病灶血流灌注特点,为判断肝结核的病理阶段提供依据;肉芽肿伴干酪样、液化坏死在所对应的病灶周边环状增强,伴中心坏死区无增强,或为其典型超声造影表现。但穿刺活检仍为诊断肝结核的金标准[10]。
| [1] |
CHAKAYA J, KHAN M, NTOUMI F, et al. Global Tuberculosis Report 2020-Reflections on the Global TB burden, treatment and prevention efforts[J]. Int J Infect Dis, 2021, 113(Suppl 1): S7-S12. DOI:10.1016/j.ijid.2021.02.107 |
| [2] |
TRITOU I, PRASSOPOULOS P, DASKALOGIANNAKI M, et al. Miliary hepatic tuberculosis not associated with splenic or lung involvement. A case report[J]. Acta Radiol, 2000, 41(5): 479-481. DOI:10.1080/028418500127345721 |
| [3] |
LIAO JR, ZHANG D, WU XL. Pulmonary tuberculosis combined with hepatic tuberculosis: a case report and literature review[J]. Clin Respir J, 2015, 9(4): 501-505. DOI:10.1111/crj.12167 |
| [4] |
肖科, 税雪姣, 赵东霞, 等. 肝脏结核1例并文献复习[J]. 中国感染与化疗杂志, 2019, 19(1): 32-37. DOI:10.16718/j.1009-7708.2019.01.007 |
| [5] |
何占平, 陈晶, 徐海霞, 等. 肝脏结核的CT诊断及其鉴别诊断[J]. 新发传染病电子杂志, 2019, 4(4): 212-216. DOI:10.19871/j.cnki.xfcrbzz.2019.04.006 |
| [6] |
王欣, 蒋诚诚, 李勇刚. 5例肝结核的影像学分析并文献复习[J]. 新发传染病电子杂志, 2017, 2(2): 100-103. DOI:10.19871/j.cnki.xfcrbzz.2017.02.010 |
| [7] |
YU HY, SHENG JF. Liver tuberculosis presenting as an uncommon cause of pyrexia of unknown origin: positron emission tomography/computed tomography identifies the correct site for biopsy[J]. Med Princ Pract, 2014, 23(6): 577-579. DOI:10.1159/000357869 |
| [8] |
余日胜, 孙继红, 李蓉芬. 肝结核的CT与MRI表现[J]. 中华放射学杂志, 2001, 35(5): 367-369. DOI:10.3760/j.issn:1005-1201.2001.05.014 |
| [9] |
王纯, 李霞, 赵蕾. 超声造影诊断继发性肝结核1例[J]. 中国肝脏病杂志(电子版), 2018, 10(2): 94-96. DOI:10.3969/j.issn.1674-7380.2018.02.018 |
| [10] |
PARK JI. Primary hepatic tuberculosis mimicking intrahepatic cholangiocarcinoma: report of two cases[J]. Ann Surg Treat Res, 2015, 89(2): 98-101. DOI:10.4174/astr.2015.89.2.98 |
| [11] |
REED DH, NASH AF, VALABHJI P. Radiological diagnosis and management of a solitary tuberculous hepatic abscess[J]. Br J Radiol, 1990, 63(755): 902-904. DOI:10.1259/0007-1285-63-755-902 |
 2022, Vol. 51
2022, Vol. 51